Лабораторные работы.
Аналитическая химия в 2 книгах.
Книга 1. Химические методы анализа

Ход определения. В колбу для титрования переносят пипеткой 100,0 мл исследуемой воды, приливают 5 мл аммонийной буферной смеси и прибавляют по каплям раствор индикатора (хромогена черного) до появления хорошо заметной, но не очень темной краснофиолетовой окраски. Комплексонометрическое титрование является стандартным методом определения общей жесткости природных вод, которую характеризуют… Читать ещё >
Лабораторные работы. Аналитическая химия в 2 книгах. Книга 1. Химические методы анализа (реферат, курсовая, диплом, контрольная)
Работа 19.5.1. Определение общей жесткости воды методом комплексонометрического титрования
Комплексонометрическое титрование является стандартным методом определения общей жесткости природных вод, которую характеризуют молярной концентрацией эквивалентов кальция и магния сэк(Са2+ + Mg2+) и выражают в миллимолях на кубический дециметр (ммоль/дм3).
В соответствии с номенклатурными правилами ИЮПАК по химии объем выражается в кубических дециметрах. В аналитической практике в качестве единицы измерения объема шире используется литр. С 1 января 2005 г. в России введена новая единица жесткости — градус жесткости (°Ж). Принятый в России градус жесткости равен 20,04 мг Са2+ или 12,15 мг Mg2+ в 1 дм3. Один градус жесткости (°Ж) равен 1 ммоль эквивалентов ионов Са2+ и Mg2+ в литре (дм3) воды:
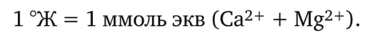
В зависимости от величины жесткости различают следующие типы вод: мягкая — с жесткостью 10,0 °Ж. Предельное значение жесткости для питьевой воды — 7,0 °Ж.
Сущность методики. Анализируемую воду подщелачивают аммонийной буферной смесью до pH ~ 10. Индикатором служит обычно хромоген черный специальный ЕТ-00, образующий с ионами Са2+ и Mg2+ растворимые комплексы красно-фиолетового цвета:

Константы устойчивости этих комплексов равны соответственно 2,6 • 106 и 1 • 107. Величина констант устойчивости комплексов Са2+ и Mg2+ с комплексоном III на порядок больше (3,7 • 107 и 5 • 108). Поэтому при титровании комплексы металлов с индикатором разрушаются и образуются более прочные комплексы с комплексоном III (при pH ~ 10):
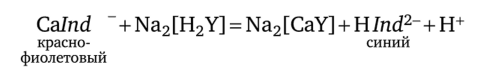
В точке эквивалентности красно-фиолетовая окраска раствора сменяется синей вследствие накопления анионов индикатора.
Приготовление аммонийной буферной смеси. Аммонийную буферную смесь готовят в мерной колбе вместимостью 1000 мл, смешивая 100 мл 20%-ного раствора хлорида аммония NH4C1 со 100 мл 20%-ного раствора аммиака NH3, доводя водой объем смеси до метки.
Приготовление раствора комплексона III. Обычно природную воду титруют 0,05 н. раствором комплексона III. Раствор комплексона III Na2C10H14O8N2−2H2O готовят, используя точную навеску этого химически чистого препарата. Навеска рассчитывается исходя из того, что молярная масса эквивалентов комплексона III в данной реакции равна половине его молярной массы (z3K = 2). Иногда концентрацию раствора комплексона устанавливают по 0,05 н. раствору сульфата магния MgS04-7H20, приготовленному из фиксанала.
Ход определения. В колбу для титрования переносят пипеткой 100,0 мл исследуемой воды, приливают 5 мл аммонийной буферной смеси и прибавляют по каплям раствор индикатора (хромогена черного) до появления хорошо заметной, но не очень темной краснофиолетовой окраски.
Титруют воду 0,05 н. раствором комплексона III до перехода краснофиолетовой окраски в синюю. В конце титрования раствор комплексона прибавляют по одной капле, добиваясь, чтобы красноватый оттенок совершенно исчез. Повторяют титрование 2—3 раза и из сходящихся отсчетов находят среднее.
Общую жесткость воды Жобщ (сумма концентраций Са2+ и Mg2+ на 1 л) вычисляют по формуле.
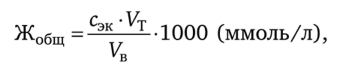
где сэк— молярная концентрация эквивалентов раствора комплексона III, моль/л; Ут — объем рабочего раствора комплексона III, затраченный на титрование, мл; VB — объем воды, взятый для определения, мл.
Например, на титрование 100,0 мл природной воды пошло в среднем 17,60 мл 0,5 022 н. раствора комплексона. Тогда.
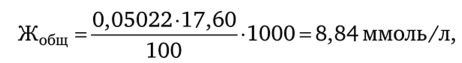
или в градусах жесткости 