Бронхиальная астма.
Болезни органов дыхания

Основной метод функциональной диагностики, позволяющий оценить состояние бронхиальной проходимости, — спирометрия. Это самый простой и распространенный метод, который можно рассматривать в качестве первого, начального этапа диагностики вентиляционных нарушений при оценке функции внешнего дыхания. Снижение ОФВ1, уменьшение коэффициента Тиффно (соотношение ОФВ1 и ЖЕЛ, выраженное в процентах… Читать ещё >
Бронхиальная астма. Болезни органов дыхания (реферат, курсовая, диплом, контрольная)
Бронхиальная астма (БА) — хроническое заболевание, в основе которого лежит воспалительный процесс в дыхательных путях с участием разнообразных клеточных элементов, включая тучные клетки, эозинофилы и Т-лимфоциты. У предрасположенных лиц этот процесс приводит к развитию генерализованной бронхиальной обструкции разной степени выраженности, полностью или частично обратимой спонтанно или под влиянием лечения. Хроническое воспаление вызывает гиперреактивность дыхательных путей, приводящую к возникновению повторных эпизодов свистящих хрипов, одышки, чувства стеснения в груди и кашля (особенно ночью или ранним утром).
Это определение дано в международных рекомендациях «Глобальная стратегия по лечению и профилактике бронхиальной астмы» (GINA) пересмотра 2006 г. В отличие от предшествующих, оно стало возможным в связи с тем, что за последние годы значительно изменилось представление о сути БА, ее этиологии, патогенезе, клинической картине, лечении и профилактике.
В основе БА (независимо от степени тяжести) лежит хронический воспалительный процесс в дыхательных путях. Гиперреактивность бронхов, изменяющаяся со временем бронхиальная обструкция и связанные с этим клинические симптомы болезни — следствие персистирующего воспаления в бронхах.
Этиология
БА — распространенное заболевание (распространенность колеблется от 3 до 8%). Резкий рост заболеваемости БА произошел во второй половине XX в., когда за период с 30-х по 80-е годы отмечено десятикратное увеличение ее распространенности как среди детского, так и среди взрослого населения. В настоящее время в мире живет около 300 млн больных БА.
В возникновении БА имеет значение наследственная предрасположенность. Установлена связь некоторых антигенов гистосовместимости (HLA) с тяжестью течения БА. Увеличение последней особенно часто отмечают у носителей антигенов А2, В7, В12, В13, В27, В35, DR2, DR5 и их комбинации. Показано увеличение распространенности БА среди кровных родственников больных, страдающих этим заболеванием (20−25% по сравнению с 4% в общей популяции), что может свидетельствовать об участии в его развитии генетических факторов. Их вклад в формирование болезни составляет от 35 до 70%.
В развитии заболевания играют роль внутренние и внешние факторы.
Внутренние (генетические) факторы — биологические дефекты иммунной, эндокринной, вегетативной нервной систем, чувствительности и реактивности бронхов, мукоцилиарного клиренса, эндотелия сосудов легких, системы быстрого реагирования (тучные клетки и др.), метаболизма арахидоновой кислоты и т. д. Среди них особо выделяют гены, предрасполагающие к атопии, и гены, предрасполагающие к бронхиальной гиперреактивности. В международных рекомендациях GINA (2006) к внутренним факторам, влияющим на развитие и манифестацию БА, относят ожирение и пол (женщины чаще болеют БА, чем мужчины).
Внешние факторы, способствующие клинической реализации биологических дефектов, включают:
- * аллергены (пыльцевые, пылевые, пищевые, лекарственные, производственные, клещей, насекомых, животных и др.);
- * возбудителей инфекционных заболеваний (главным образом, вирусы, грибы и некоторые виды бактерий);
- * механические и химические раздражители (металлическая, древесная, силикатная, хлопковая пыль, пары кислот и щелочей, дымы и др.);
- * метеорологические и физико-химические факторы (изменение температуры и влажности воздуха, колебания барометрического давления, магнитного поля земли, физические усилия и др.);
- * стрессовые нервно-психические воздействия и физическую нагрузку;
- * фармакологические воздействия (в-адреноблокаторы, НПВС и т. д.);
- * курение табака (активное и пассивное).
У больных БА курение табака сопровождается ускоренным ухудшением функций легких и увеличением степени тяжести заболевания. Курение может приводить к снижению ответа на применение глюкокортикоидов, а также уменьшать вероятность достижения контроля за БА.
Инфекционные агенты, помимо аллергизирующего действия, могут также:
- * снижать порог чувствительности организма к неинфекционным (атопическим) аллергенам и повышать проницаемость слизистой оболочки дыхательных путей для них;
- * неиммунологическим путем формировать изменение реактивности клеток-мишеней (тучные клетки, базофилы, моноциты и др.) и эффекторных систем.
Известно, что некоторые вирусы и бактерии оказывают бета-адреноблокирующее действие и способны воздействовать на эфферентные зоны вагусного бронхоконстриктивного механизма. Различные вирусные инфекции (респираторносинцитиальный вирус, вирус парагриппа), перенесенные в младенческом возрасте, способствуют формированию астматического фенотипа.
Как правило, при БА у одного и того же больного можно заподозрить или обнаружить сочетание нескольких этиологических факторов. Вместе с тем важнейшим идентифицируемым предрасполагающим фактором развития заболевания служит атопия, т. е. выработка избыточного количества IgE как реакция на воздействие аллергенов окружающей среды.
При продолжительном течении болезни большее значение приобретают различные неспецифические раздражения и психогенные факторы. Аллерген, первоначально вызвавший развитие БА, со временем может утратить свое значение, исчезнув из зоны окружения больного; собственно обострения болезни обусловлены иными причинами.
Патогенез
Центральное звено патогенеза БА — неинфекционный воспалительный процесс в бронхах, вызванный воздействием различных воспалительных клеток и выделяемых ими биологически активных веществ — медиаторов. В свою очередь, воспаление бронхов ведет к развитию их гиперчувствительности и гиперреактивности, предрасполагая, таким образом, бронхиальное дерево к сужению в ответ на действие различных стимулов (рис. 1−6).
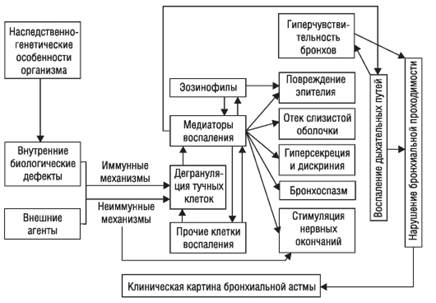
Рис. 1−6. Патогенез бронхиальной астмы.
Иммунные механизмы. В подавляющем большинстве случаев БА — аллергическое заболевание, поэтому главным механизмом формирования патологического процесса служит иммунный. Согласно классификации R. Coombs и P. Gell, у значительной части больных БА нарушения иммунокомпетентной системы протекают по I, III и IV типу реакций гиперчувствительности. Развитие реакций II (цитотоксического) типа при БА пока не описано.
Чаще других основную роль играют механизмы гиперчувствительности I (анафилактического или атопического) типа. К этому типу аллергии относят немедленные реакции, развивающиеся вследствие взаимодействия аллергена (антигена) со специфическим IgE. Реакция происходит преимущественно на поверхности субмукозных тучных клеток дыхательных путей и базофилов, циркулирующих в крови. В результате происходит их дегрануляция с высвобождением биологически активных молекул, среди которых преобладают медиаторы воспаления. Уже через несколько секунд после реакции дегрануляции клетки секретируют ранее синтезированные вазоактивные амины — гистамин и серотонин. Более отдаленным последствием активации тучных клеток служит запуск продукции метаболитов арахидоновой кислоты (простагландинов, лейкотриенов), тромбоксанов и цитокинов, которые участвуют в поддержании воспалительной реакции в тканях (ИЛ-3, -4, -5, -8; нейтрофильный хемотаксический фактор, фактор агрегации тромбоцитов, гранулоцитарно-макрофагальный колониестимулирующий фактор и др.).
Секретируемые тучными клетками медиаторы и цитокины вызывают интенсивный приток эозинофилов и других клеток воспаления (гранулоцитов, моноцитов, Т-лимфоцитов) к месту проникновения аллергена. Через 6−12 ч развивается поздняя стадия аллергической реакции, при которой доминирует клеточная инфильтрация. Эозинофил рассматривают в качестве ключевой клетки в повреждении эпителия дыхательных путей, что связано с продукцией и секрецией им эозинофильного катионного белка, а также выделения фактора активации тромбоцитов и так называемого большого основного протеина. В свою очередь, повреждение эпителия бронхов эозинофильным большим основным протеином приводит к развитию неспецифической гиперреактивности и гиперчувствительности.
Медиаторы тучных клеток привлекают в зону воспаления нейтрофилы и способствуют выделению ими активных форм кислорода. Активированные нейтрофилы стимулируют дегрануляцию тучных клеток, что замыкает «порочный круг» .
В развитии хронического воспаления в бронхах велика роль лимфоцитов, выделяющих интерлейкины, с последующей активацией тучных клеток и эозинофилов. Кроме того, макрофаги и моноциты вырабатывают вещества, обладающие мощным бронхоспастическим действием и потенцирующие воспаление.
Под влиянием всех вышеописанных изменений повышается проницаемость микроциркуляторного русла, развиваются отек, гипери дискриния, бронхоспазм и прочие признаки неинфекционного воспаления дыхательных путей. Клинически это выражается острым нарушением проходимости бронхов и развитием приступа БА.
В возникновении реакции I типа большую роль отводят избыточному синтезу реагинов, дефициту секреторного IgA и, главное, снижению Т-супрессорной функции лимфоцитов.
Реакция III типа (иммунокомплексный тип или феномен Артюса) происходит в зоне избытка антигена с участием преципитирующих антител. Она развивается под воздействием экзоаллергенов (микроорганизмы, ферменты, пыль, антибиотики и др.) и эндоаллергенов (инфекционное и/или аллергическое воспаление, различные раздражители и другие факторы могут приводить к денатурации белков бронхиол и альвеол с последующим формированием эндоаллергенов — аутоаллергенов).
При иммунокомплексных реакциях III типа образуются антитела, принадлежащие преимущественно к иммуноглобулинам класса G и М. Повреждающее действие образованного комплекса «антиген-антитело» реализуется, главным образом, через активацию комплемента и освобождение лизосомных ферментов. Происходят повреждение базальных мембран, спазм гладких мышц бронхов, расширение сосудов и повышение проницаемости микроциркуляторного русла.
Тип IV (клеточный), при котором повреждающее действие оказывают сенсибилизированные лимфоциты, относят к гиперчувствительности замедленного типа (ГЗТ).
Основные медиаторы аллергической реакции IV типа — интерлейкины. Это лимфокины, действующие на макрофаги и эпителиальные клетки, и лизосомные ферменты. Не исключена роль активации кининовой системы. Под влиянием этих веществ развиваются отек, набухание слизистой оболочки, бронхоспазм и гиперпродукция вязкого бронхиального секрета. Выделямые лимфоцитами интерлейкины способствуют привлечению к месту аллергической реакции других клеток воспаления с развитием персистирующей воспалительной реакции. Все это приводит к длительному нарушению бронхиальной проходимости.
В патогенезе БА определенная роль принадлежит местной «поломке» иммунной защиты: отмечают уменьшение концентрации секреторного IgA и изменение системы фагоцитоза, действие которой в органах дыхания в основном обеспечивают альвеолярные макрофаги. При нарушении их функции (воздействие лимфокинов и др.) резко снижается противовирусная защита организма, что связано со снижением продукции интерферона. Воспаление приобретает персистирующий характер.
Основные этапы развития аллергической реакции включают:
- * нарушение соотношения субпопуляций лимфоцитов (Тh1-Тh2-лимфоцитов), приводящее к поляризации Тh2-лимфоцитов;
- * синтез Т-лимфоцитами цитокинов (ИЛ-4, -5, -10);
- * стимуляция интерлейкинами внутриклеточной продукции IgE, индукция под их влиянием активности и пролиферации эозинофилов, а также созревания тучных клеток;
- * вовлечение в аллергическую реакцию других клеток (базофилы, макрофаги, эпителиальные клетки, фибробласты);
- * высвобождение активированными клетками провоспалительных медиаторов — гистамина, цистеиниловых лейкотриенов, эйкозаноидов, активных форм кислорода и др.;
- * высвобождение нейротрансмиттеров и активация афферентных нервов.
Воспалительный процесс, возникший в результате аллергической реакции, затрагивает все структуры стенки бронхов, включая эпителиальный покров, базальную мембрану, ассоциированные с бронхами лимфоидные узелки (так называемую БАЛТ-систему), сосуды и гладкие мышцы. Это приводит к целому ряду патоморфологических изменений:
- * спазму гладких мышц (острая бронхоконстрикция);
- * гипертрофии слизистых желез, гиперсекреции слизи и образованию слизистых пробок в просвете бронхов;
- * отеку слизистой оболочки и ее инфильтрации активированными клетками;
- * дилатации и пролиферации сосудов, а также повышению их проницаемости;
- * перестройке (ремоделированию) морфологических структур легочной ткани (гибели эпителиального покрова, утолщению стенок бронхов, изменению размеров базальной мембраны, васкуляризации слизистых оболочек дыхательных путей).
Неиммунные механизмы. Известно, что помимо антигензависимой дегрануляции тучных клеток существует большое количество неспецифических факторов (токсины, ферменты, лекарственные средства, различные макромолекулы и др.), вызывающих дегрануляцию тучных клеток неиммунным путем. Различные физические, механические и химические раздражители (например, дым, двуокись серы, пыль, холодный воздух и др.), инфекционные агенты (без сенсибилизации и аллергизации) провоцируют рефлекторный бронхоспазм путем стимуляции рецепторов в дыхательных путях. Ранее полагали, что такая реакция осуществляется посредством повышения активности парасимпатической нервной системы. В настоящее время этот механизм не считают основным. Обнаружена распространенная сеть нервных волокон неадренергической нехолинергической регуляции бронхов, содержащих мощные нейропептиды (нейрокин, А и В, субстанцию Р, вазоактивный интестинальный пептид и др.), которые имеют отношение к развитию большинства признаков обострения бронхиальной астмы.
В формировании нестабильного метаболизма тучных клеток предполагают участие глюкокортикоидной недостаточности, нарушений функционирования яичников (гиперэстрогенемия и гипопрогестеронемия) и нервно-психических нарушений.
Глюкокортикоидная недостаточность способствует развитию гиперреактивности тучных клеток, снижению синтеза катехоламинов, активации простагландинов F2a, а также нарушению иммунокомпетентной системы (комплексное участие в патогенезе БА, иммунологических и неиммунологических механизмах).
Гиперэстрогенемия и гипопрогестеронемия воздействуют главным образом на aи бета-адренорецепторы, повышая активность первых и снижая активность последних.
При нарушении бронхиальной проходимости, обусловленном любыми другими механизмами, также отмечают адренергический дисбаланс, выражающийся в преобладании системы гуанилатциклазы над системой аденилатциклазы. Кроме того, изменяется содержание внутриклеточного фермента фосфодиэстеразы, усиливается поступление ионов кальция в клетку и нарушается обмен простагландинов.
Преобладание того или иного механизма в патогенезе БА позволяет выделить ее различные патогенетические варианты (Г.Б. Федосеев, 1982; А. Г. Чучалин, 1985).
Классификация
Единой классификации БА до настоящего времени не существует. В 1982 г. Г. Б. Федосеев предложил классификацию, подчеркивающую многообразие патогенетических механизмов развития БА. Она не отменяет таковую, разработанную А. Д. Адо и П. К. Булатовым (1969), но развивает ее с учетом результатов новых исследований.
Классификация бронхиальной астмы (Г.Б. Федосеев, 1982).
- * Этапы развития БА:
- — состояние предастмы;
- — клинически оформленная БА.
К предастме относят все состояния, которые могут привести к возникновению БА (острый и хронический бронхит, а также пневмония с элементами бронхоспазма, в сочетании с вазомоторным ринитом, крапивницей и другими состояниями, при которых обнаруживают эозинофилию в крови и увеличенное содержание эозинофилов в мокроте). После первого приступа или сразу возникшего астматического статуса БА считают клинически оформленной.
- * Формы БА:
- — иммунологическая;
- — неиммунологическая (не включают в формулировку клинического диагноза).
- * Патогенетические механизмы (клинико-патогенетические варианты) БА:
- — атопический;
- — инфекционно-зависимый;
- — аутоиммунный;
- — дисгормональный;
- — нервно-психический дисбаланс;
- — адренергический дисбаланс;
- — первично измененная реактивность бронхов.
Чаще всего обнаруживают атопический и инфекционно-зависимый варианты БА. Возможно их сочетание; в таких случаях говорят о смешанной БА.
Разделение БА по патогенетическим механизмам и выделение основного из них представляют трудную и часто неразрешимую задачу, особенно для врачей поликлиник. Тем не менее во всех случаях такая попытка оправдана, так как каждый из патогенетических механизмов предполагает определенный, свойственный только ему характер медикаментозного лечения.
У одного больного возможно сочетание нескольких клинико-патогенетических вариантов. В такой ситуации на момент обследования необходимо выделить основной вариант для конкретного больного, так как это важно для проведения полноценного лечения. При длительном течении БА возможна смена патогенетического механизма.
- * Тяжесть течения БА:
- — легкое;
- — средней тяжести;
- — тяжелое.
При легком течении БА обострения не длительные, возникают 2−3 раза в год. Приступы удушья купируют, как правило, приемом внутрь различных бронхолитических препаратов. В межприступном периоде признаки бронхоспазма, как правило, отсутствуют. Среднетяжелое течение характеризуется более частыми обострениями (3−4 раза в год). Приступы удушья протекают тяжелее; их купируют инъекциями лекарственных препаратов.
При тяжелом течении БА обострения возникают часто (5 раз в год и более) и отличаются длительностью. Приступы тяжелые и нередко переходят в астматическое состояние. В ряде случаев разделение БА по тяжести течения бывает условным. Так, при легком течении БА больной может погибнуть от внезапно развившегося астматического статуса. В то же время при довольно тяжелом течении болезни возможна спонтанная ремиссия.
- * Фазы течения БА:
- — обострение;
- — стихающее обострение;
- — ремиссия.
Фаза обострения характеризуется выраженными признаками заболевания и, прежде всего, повторно возникающими приступами БА или астматическими состояниями. В фазе стихающего обострения приступы становятся более редкими и нетяжелыми. Физикальные и функциональные признаки заболевания выражены меньше, чем в фазе обострения.
В фазе ремиссии исчезают типичные признаки БА: приступы удушья не возникают; полностью или частично восстанавливается проходимость бронхов.
- * Осложнения:
- — легочные (эмфизема легких, дыхательная недостаточность, ателектаз, пневмоторакс, астматический статус и др.);
- — внелегочные (дистрофия миокарда, легочное сердце (компенсированное и реже декомпенсированное с развитием правожелудочковой недостаточности при сочетании БА и хронического бронхита) и др.).
Примечания к классификации
- * Первично измененная реактивность бронхов может быть врожденной и приобретенной, манифестирует приступами удушья при физической нагрузке, воздействии холодного воздуха, лекарственных средств, возбудителей инфекционных заболеваний и др.
- * При инфекционно-зависимом варианте БА необходимо указывать характер инфекционной зависимости: стимуляция атопической реакции, инфекционная аллергия, формирование первично измененной реактивности бронхов. В тех случаях, когда инфекционный агент служит аллергеном, БА определяют как инфекционно-аллергическую.
Предлагаемая классификация, как и все остальные, не лишена недостатков, но более прогрессивна по сравнению с более ранними вариантами. Тем не менее и она не нашла широкого распространения. Неоднократно предпринимали попытки классифицировать БА на основе этиологии (особенно с учетом сенсибилизирующих внешних факторов) и предлагали называть ее экзогенной. Вместе с тем возможности такой классификации ограничены, так как для ряда больных не удается обнаружить четкие внешние факторы, способствующие развитию заболевания. Выделение аллергической БА, по мнению экспертов ВОЗ, нецелесообразно, так как причиной ее возникновения редко бывает единственный специфический аллерген.
В тех случаях, когда определяющую роль в развитии БА выполняют внутренние факторы, заболевание предлагали называть эндогенным.
В версии международного руководства (GINA, 2002) предложено ограничиваться классификацией БА по степени тяжести, разделив ее на интермиттирующую и персистирующую, выделив легкую, среднетяжелую и тяжелую персистирующую БА. Признаки, на которых основано определение степени тяжести БА, включают частоту дневных и ночных симптомов, значение пиковой скорости выдоха (ПСВ) и его вариабельность, показатели объема форсированного выдоха в первую секунду (ОФВ:) и их вариабельность, а также потребность в в2- агонистах.
Оценка тяжести БА по этим степеням позволяет осуществить так называемый ступенчатый подход к лечению больных: объем лечения должен увеличиваться при повышении степени тяжести болезни.
Кроме того, предложение экспертов ВОЗ классифицировать БА по степени тяжести базируется на том, что нередко другие рубрики вышеприведенной классификации невозможно достоверно определить у всех больных. Классификация БА, основанная на степени тяжести, наиболее важна, когда нужно принять решение о выборе лечения.
Классификация бронхиальной астмы по тяжести течения
- * Интермиттирующая (эпизодическая) БА:
- — кратковременные симптомы, возникающие реже 1 раза в неделю;
- — короткие обострения (от нескольких часов до нескольких дней);
- — ночные симптомы, возникающие реже 2 раз в месяц;
- — отсутствие симптомов и нормальная функция внешнего дыхания между обострениями;
- — ПСВ и ОФВ1 >80% должных значений;
- — вариабельность (суточный разброс) показателей ПСВ или ОФВ1 менее
- 20%. 1
- * Легкая персистирующая БА:
- — симптомы возникают от 1 раза в неделю до 1 раза в день;
- — обострения могут снижать физическую активность и нарушать сон;
- — ночные симптомы возникают более 2 раз в месяц;
- — ПСВ и ОФВ1 >80% должных показателей;
- — вариабельность (суточный разброс) показателей ПСВ или ОФВ1 не превышает 30%.
- * Среднетяжелая персистирующая БА:
- — ежедневное возникновение симптомов;
- — обострения могут приводить к ограничению физической активности и сна;
- — ночные симптомы возникают чаще 1 раза в неделю;
- — ПСВ и ОФВ1 составляют 60−80% должных значений;
- — вариабельность (суточный разброс) показателей ПСВ или ОФВ1 превышает 30%.
- * Тяжелая персистирующая БА:
- — постоянное присутствие симптомов;
- — частые ночные симптомы;
- — ограничение физической активности вследствие возникновения симптомов;
- — ПСВ и ОФВ1 <60% должных значений;
- — вариабельность (суточный разброс) показателей ПСВ или ОФВ1 превышает 30%.
Классификацию БА по степени тяжести целесообразно использовать при первичной диагностике и выборе начального лечения. Вместе с тем очень важно помнить, что степень тяжести заболевания зависит и от ответа на проводимое лечение. Основной недостаток этой классификации состоит в том, что с ее помощью трудно прогнозировать объем лечения, в котором будет нуждаться пациент, и ответ больного на него. Для этой цели в новой редакции GINA (2006) предложено оценивать степень контроля БА, что больше подходит для оценки ответа на лечение.
Предлагают выделять следующие степени контроля: контролируемая, частично контролируемая и неконтролируемая БА (табл. 1−6).
Полного контроля БА можно добиться с помощью лечения, направленного на его достижение и длительное поддержание. При этом следует учитывать безопасность лечения, риск развития побочных эффектов и стоимость лекарственных средств, необходимых для достижения этой цели.
Таблица 1−6. Степени контроля бронхиальной астмы (GINA, 2006)

Окончание табл. 1−6.
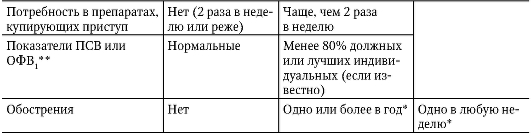
- * По определению, обострение на любой неделе делает ее неделей неконтролируемой бронхиальной астмы.
- ** Функция легких — недостоверный тест для детей в возрасте младше 5 лет.
Любое обострение требует анализа поддерживающего лечения, позволяющего убедиться в том, что его выбор правильный.
Клиническая картина
Наиболее характерный признак БА — приступы удушья. Клинический диагноз БА ставят с учетом оценки результатов всех трех этапов диагностического поиска, так как удушье может быть симптомом других заболеваний. Кроме того, у ряда больных вместо приступа удушья БА может манифестировать его эквивалентом — приступообразным надсадным кашлем, сопровождающимся острым нарушением бронхиальной проходимости. В связи с этим возникает необходимость на каждом из трех этапов диагностического поиска дифференцировать БА от заболеваний, составной частью которых служит бронхообструктивный синдром с развитием приступов удушья или их эквивалентов.
На первом этапе диагностического поиска определяют:
- * существование приступов удушья (их эквивалентов), их особенности и связь с определенными факторами;
- * аллергический анамнез (наследственную предрасположенность, непереносимость пищевых и лекарственных веществ);
- * указания на заболевания легких в анамнезе;
- * влияние метеорологических факторов, физических усилий, нарушений функций яичников и других причин на возникновение приступов удушья;
- * эффективность ранее проводимого лечения;
- * течение болезни, существование осложнений.
Больные жалуются на приступы удушья (затрудненное дыхание, преимущественно на выдохе), одышку и кашель. Характер последнего может быть разнообразным: чаще кашель сухой, надсадный, приступообразный или с выделением вязкой, трудноотделяемой мокроты. При развитии легочной недостаточности одышка беспокоит и в межприступном периоде. Повышение температуры тела может свидетельствовать об активной бронхолегочной инфекции. Затрудненное носовое дыхание, как правило, служит признаком аллергической риносинусопатии (вазомоторный ринит, полипоз) — частого спутника или предшественника БА. При расспросе больного необходимо уточнить частоту возникновения симптомов БА в неделю, обратив особое внимание на ночные симптомы. Эти данные особенно важны для оценки тяжести течения болезни на момент обследования больного.
Данные анамнеза помогают установить связь развития приступов с воздействием определенных аллергенов и других факторов. Причиной развития обострения, наряду с воздействием аллергена, может служить инфекционное поражение (особенно вирусное или вирусно-бактериальное) дыхательных путей. Уточняют влияние физических усилий (быстрая ходьба, смех и др.), изменений метеорологических факторов (холод, повышенная влажность и др.) и нарушений функций яичников на возникновение приступов удушья. Знакомство с условиями труда позволяет диагностировать профессиональную БА.
Изучение аллергологического анамнеза способствует диагностике атопического варианта БА. В подобных случаях можно получить сведения о поллинозе: обострения болезни имеют сезонный характер (чаще — весной и летом), сопровождаются ринитом и конъюнктивитом. У таких больных нередко возникают крапивница и отек Квинке, обнаруживают непереносимость пищевых продуктов и ряда лекарственных веществ, отмечают наследственную предрасположенность к аллергическим заболеваниям.
Ориентируясь на данные анамнеза, можно предположительно, а в ряде случаев и с уверенностью высказаться о так называемой аспириновой астме. Такие больные не страдают наследственной формой аллергических заболеваний. Их беспокоит нарушенное носовое дыхание (полипозные разрастания). Самый распространенный симптом у таких больных — непереносимость НПВС (ацетилсалициловая кислота, индометацин и др.), вызывающих возникновение астматических приступов. Уже на этом этапе можно предположить простагландиновый механизм развития БА.
Указание в анамнезе на прием системных глюкокортикоидов свидетельствует о тяжести болезни.
Данные о развитии в прошлом астматического статуса могут указывать на тяжесть течения заболевания и необходимость проведения лечения глюкокортикоидами. Предшествующие заболевания органов дыхания (хронический бронхит, ХП) обычно предопределяют тяжесть течения БА и отсутствие «светлых» промежутков.
БА может протекать монотонно, с постоянно нарушенным дыханием и потребностью в ежедневном приеме противоастматических средств.
Другой тип течения БА характеризуется периодическими обострениями с заметно усиливающимися признаками бронхиальной обструкции и ремиссиями, когда нарушения бронхиальной проходимости резко уменьшаются или исчезают. Такое течение БА наиболее характерно для атопического варианта заболевания.
Значение первого этапа диагностического поиска особенно велико для диагностики БА в начальном периоде заболевания, когда все симптомы БА имеют эпизодический характер, а физикальное исследование не дает достаточной информации для установления диагноза.
На втором этапе диагностического поиска в развернутой стадии болезни обнаруживают:
- * внелегочные признаки аллергии;
- * признаки бронхообструктивного синдрома;
- * осложнения БА;
- * другие заболевания, сопровождающиеся бронхоспазмом.
При обследовании кожного покрова иногда можно обнаружить изменения, характерные для аллергических заболеваний: крапивницу, папулезные и эритематозные высыпания. Они могут свидетельствовать об иммунологическом варианте БА. При аллергических формах заболеваниях возможно возникновение конъюнктивита (особенно часто — у больных поллинозами). Сочетание БА с экземой, нейродермитом и псориазом предрасполагает к тяжелому течению первой. Грибковое поражение кожи и ногтевых лож может сопровождаться гиперчувствительностью к грибковым аллергенам.
Часто можно обнаружить нарушение носового дыхания. Риниты и полипоз рассматривают как предастму. Гаймориты и другие синуситы служат очагом инфекции, который может провоцировать удушье. При физикальном обследовании можно обнаружить признаки эмфиземы.
Аускультация легких помогает определить признаки бронхиальной обструкции, для которой характерны удлиненный выдох и сухие, преимущественно свистящие хрипы. Иногда при обследовании вне приступа удушья сухих хрипов может быть немного или их не выслушивают. Форсированный выдох позволяет обнаружить скрытый бронхоспазм (возникновение или нарастание сухих хрипов).
При аускультации легких в положении больного лежа количество сухих хрипов увеличивается (при вагусном механизме их возникновения).
Постоянно выслушиваемые на определенном участке влажные звонкие («трескучие») мелкопузырчатые хрипы могут свидетельствовать о развившемся пневмосклерозе.
При астматическом статусе, несмотря на резкое нарастание удушья и одышки, отмечают уменьшение числа сухих хрипов при аускультации вплоть до развития «немого» легкого.
Объективное обследование больного помогает обнаружить симптомы других заболеваний («бабочка» на коже лица, лимфаденопатия в сочетании с увеличением печени и селезенки, стойкое повышение артериального давления (АД), упорная лихорадка и др.), при которых возникают приступы бронхиальной обструкции, манифестирующие удушьем (системная красная волчанка, узелковый периартериит, реже — другие диффузные заболевания соединительной ткани). В таких случаях диагноз БА маловероятен.
На третьем этапе диагностического поиска определяют:
- * нарушение бронхиальной проходимости;
- * измененную реактивность бронхов;
- * существование очагов инфекции и признаков воспаления;
- * осложнения БА.
Основной метод функциональной диагностики, позволяющий оценить состояние бронхиальной проходимости, — спирометрия. Это самый простой и распространенный метод, который можно рассматривать в качестве первого, начального этапа диагностики вентиляционных нарушений при оценке функции внешнего дыхания. Снижение ОФВ1, уменьшение коэффициента Тиффно (соотношение ОФВ1 и ЖЕЛ, выраженное в процентах) и процентного соотношения ОФВ1 к ФЖЕЛ (модифицированный коэффициент Тиффно) — характерные признаки нарушения бронхиальной проходимости по обструктивному типу, характерному для БА. При обострении заболевания значительно возрастает остаточный объем легких (на 100% и более по сравнению с исходным показателем) и функциональная остаточная емкость. Анализ спирограммы позволяет обнаружить признаки трахеобронхиальной дискинезии (зазубрина в верхней части нисходящего колена спирограммы — симптом Колбета-Висса).
Спирометрия с построением кривой «поток-объем» позволяет диагностировать нарушение бронхиальной проходимости раздельно на уровне верхних, средних и нижних отделов дыхательных путей (крупных, средних и мелких бронхов) по данным экспираторного потока при легочном объеме, равном 25, 50, 75% ФЖЕЛ. Для периферической обструкции характерно значительное снижение кривой «поток-объем» на участке 50−75% ФЖЕЛ (максимальная объемная скорость (МОС) 50−75).
По увеличению мощности выдоха и приросту показателей МОС25, MOC50, МОС75 после предварительного вдыхания больным бронхолитических (симпатомиметических или холинолитических) веществ определяют роль бронхоспазма в нарушении бронхиальной проходимости и степень его выраженности.
С помощью этих же методов подбирают наиболее активный для конкретного больного ингаляционный бронхолитический (симпатомиметический или холинолитический) препарат.
Повышенное бронхиальное сопротивление, зарегистрированное по данным исследования функции внешнего дыхания, в ответ на физическую нагрузку, вдыхание холодного воздуха, раздражающих газов, пылей и метахолина, свидетельствует об измененной реактивности бронхов.
Пикфлоуметрия — определение ПСВ — непременное условие контроля состояния больного. Ее проводят утром (до приема лекарственных средств) и вечером с помощью индивидуального карманного прибора — пикфлоуметра. Желательно, чтобы разброс утренних и вечерних значений ПСВ не превышал 20%.
Аллергологическое тестирование осуществляют только вне обострения заболевания и проводят с помощью набора разнообразных неинфекционных и инфекционных аллергенов.
Выполняют кожные аллергические пробы (аппликационный, скарификационный и внутрикожный способ нанесения аллергена). Для оценки провоцирующего действия обнаруженный аллерген можно наносить на конъюнктиву глаза и слизистую оболочку носа. Наиболее достоверный метод специфической диагностики БА — определение специфической гиперреактивности бронхов с помощью ингаляционных провокационных тестов. С большой осторожностью ингаляционно вводят аллерген, так как такой путь введения может спровоцировать развитие тяжелого приступа БА или астматического статуса. Определение аллергена и уточнение его провоцирующего действия — прямое доказательство аллергической этиологии БА.
Для специфической диагностики заболевания также применяют радиоиммуноаллергосорбентный тест, позволяющий количественно оценить содержание IgE к различным группам аллергенов. Повышение концентрации специфического IgE при соответствующих данных анамнеза подтверждает атопический механизм развития БА (этот тест применяют при невозможности проведения аллергологического тестирования).
При указаниях в анамнезе на ранее диагностированную БА, при отсутствии клинических признаков заболевания и сохранной бронхиальной проходимости проводят провокационный тест с метахолином.
Лабораторные исследования помогают подтвердить предполагаемый диагноз, оценить эволюцию заболевания и эффективность проводимого лечения.
Обнаружение эозинофилов в мокроте — один из основных диагностических критериев БА. Кроме того, диагностическое значение имеет определение в ней спиралей Куршмана и кристаллов Шарко-Лейдена. Эозинофильный лейкоцитоз — неспецифический признак, который может быть проявлением общей аллергической реакции организма.
Лабораторные исследования помогают решать вопрос о существовании активного воспалительного процесса и степени его выраженности (увеличение острофазовых показателей).
При обострении БА и астматическом статусе особое значение имеет исследование кислотно-основного состояния и газового состава крови, изменяющихся при усилении дыхательной недостаточности.
Рентгенологическое исследование помогает обнаружить очаги инфекции в придаточных пазухах, зубах и желчном пузыре, а также установить существование острого (пневмония) или обострения хронического воспалительного процесса в легких, эмфиземы легких и пневмосклероза.
На ЭКГ можно определить признаки развития компенсированного легочного сердца — гипертрофию его правых отделов (подробнее см. «Легочное сердце»). При подозрении на симптоматический характер бронхоспазма проводят дополнительное обследование по программе, определяемой предполагаемым заболеванием.
Астматический статус. Его развитие практически всегда служит результатом неправильного лечения:
- * бесконтрольный прием симпатомиметических средств и глюкокортикоидов;
- * резкое прерывание длительно проводимого лечения глюкокортикоидами;
- * обострение хронического или возникновение неэффективно леченного острого воспалительного процесса в бронхолегочной системе;
- * неудачно проведенная специфическая гипосенсибилизация;
- * злоупотребление снотворными и седативными средствами. Критерии астматического (метаболического) статуса:
- * прогрессирующее нарушение дренажной функции бронхов;
- * развернутая клиническая картина удушья, которая может осложняться легочной обструкцией, гипоксемической комой и острым легочным сердцем;
- * резистентность к симпатомиметическим и бронхолитическим препаратам;
- * гиперкапния;
- * гипоксия тканей.
Классификация астматического статуса:
- * I стадия — затянувшийся приступ удушья, сформировавшаяся резистентность к симпатомиметикам;
- * II стадия — нарастание дыхательной недостаточности по обструктивному типу;
- * III стадия — гипоксемическая, гиперкапническая кома.
Стадия I клинически характеризуется затянувшимся приступом удушья, вынужденным положением больного, учащенным дыханием, приступообразным кашлем со скудной, трудноотделяемой мокротой, тахикардией, часто — повышением АД.
Из физических симптомов отмечают несоответствие между интенсивностью дыхательных шумов, выслушиваемых дистанционно, и данными непосредственной аускультации легких (скудность хрипов, участки ослабленного дыхания).
Стадия I характеризуется умеренной артериальной гипоксемией (РаО2 составляет 60−70 мм рт.ст.) и нормоили гипокапнией (показатели РаСО2 нормальные или уменьшены в результате гипервентиляции и составляют менее 35 мм рт.ст.).
Для II стадии характерно очень тяжелое состояние больного: бледно-серый влажный кожный покров, учащенное поверхностное дыхание, при аускультации — «немое легкое» (хрипы почти не слышны), частый пульс малого наполнения, аритмия и снижение АД. Периоды безразличия у больного сменяются возбуждением.
II стадия характеризуется более выраженной гипоксемией (РаО2 50- 60 мм рт.ст.) и нарастающей гиперкапнией вследствие снижения эффективной (альвеолярной) вентиляции (РаСО2 50−70 мм рт.ст. и даже несколько выше).
В III стадии сознание отсутствует, отмечают тахипноэ, часто — разлитой «красный» цианоз и коллапс. Летальность на высоте астматического статуса достигает 5−20%. Наиболее частые причины смерти — асфиксия вследствие позднего проведения реанимационных мероприятий и невозможность восстановления эффективной вентиляции легких.
III стадия характеризуется тяжелой артериальной гипоксемией (РаО2 40- 55 мм рт.ст.) и резко выраженной гиперкапнией (РаСО2 около 80−90 мм рт.ст. и выше) с некомпенсированным респираторным ацидозом.
При своевременно начатом интенсивном лечении прогноз астматического статуса может быть благоприятным.
Все вышеизложенное касалось так называемого метаболического (медленно развивающегося) астматического статуса. Кроме этого существует немедленно развивающийся (анафилактический) астматический статус, обусловленный развитием гиперергической анафилактической реакции немедленного типа с мгновенным высвобождением медиаторов аллергии и воспаления, что приводит к тотальному бронхоспазму и асфиксии в момент контакта с аллергеном.
Диагностика
Диагностику БА осуществляют на основании обнаружения определенных признаков .
Основные признаки
- * Существование приступов удушья или их эквивалентов.
- * Генерализованная обратимая бронхиальная обструкция.
- * Обнаружение эозинофилов в мокроте.
- * Отсутствие заболеваний, сопровождающихся бронхоспастическим или бронхообструктивным синдромом (один из симптомов болезни).
Дополнительные признаки
- * Клинико-аллергологический анамнез.
- * Результаты аллергологического тестирования:
- — для определения аллергена — кожные пробы (аппликационные, внутрикожные, скарификационные);
- — для уточнения специфичности аллергена — назальные, ингаляционные, конъюнктивальные пробы (проводят в стадии стойкой ремиссии) и радиоаллергосорбентный тест;
- — провокационные пробы (с метахолином) — при сомнительном диагнозе.
- * Повышение содержания IgE в крови.
- * Эозинофилия.
Формулировка развернутого клинического диагноза БА должна учитывать :
- * основной клинико-патогенетический вариант БА (наиболее распространен атопический и инфекционно зависимый);
- * тяжесть течения (легкое, среднетяжелое, тяжелое);
- * уровень контроля (контролируемая, частично контролируемая, неконтролируемая);
- * фазу течения (обострение, стихающее обострение, ремиссия);
- * осложнения (дыхательная недостаточность (степень), сердечная недостаточность (степень), астматический статус (стадия), другие осложнения).
Примечание. При инфекционно зависимой БА рекомендуют указывать:
- * характер хронического поражения легких, на фоне которого развилась БА или которому она сопутствует;
- * характер инфекционной зависимости — инфекционный возбудитель, играющий роль аллергена, способствующий манифестации атопических реакций или же формирующий первично измененную реактивность бронхов;
- * уровень контроля (в качестве оценки эффективности проводимого лечения).
Лечение
Основные цели ведения больных БА эксперты ВОЗ сформулировали следующим образом:
- * достижение и поддержание контроля за симптомами болезни;
- * предотвращение обострений БА;
- * поддержание функции легких, близких к нормальным величинам (по возможности);
- * поддержание нормальной активности (в том числе физической);
- * исключение побочных эффектов противоастматических лекарственных препаратов;
- * предотвращение развития необратимой бронхиальной обструкции;
- * предотвращение смерти, связанной с БА.
Основные направления лечения больных БА для достижения поставленных целей можно представить в виде пяти взаимосвязанных компонентов:
- * развитие сотрудничества между пациентом и врачом;
- * определение факторов риска и уменьшение их воздействия;
- * оценка состояния лечения и мониторинг течения БА;
- * лечение обострений;
- * соблюдение пациентом рекомендаций врача (личный вклад больного в достижение и поддержание контроля БА).
Содержание этих компонентов представлено ниже.
Цель сотрудничества больного с врачом — дать возможность пациенту с БА приобретать знания, навыки и уверенность в его личном участии в лечении заболевания. Реализации этой цели можно добиться посредством обучения пациентов (занятия в астма-школе, чтение журнала для больных «Астма и аллергия», разработка индивидуальных планов медикаментозного лечения для длительного ведения больных и др.).
Уменьшение воздействия на пациента факторов риска некоторых категорий позволяет улучшить контроль за БА и снизить потребность в принимаемых лекарственных препаратах. Устранение воздействия известного аллергена позволяет избежать обострения заболевания.
Лекарственные препараты для лечения БА делят на средства, контролирующие течение БА (поддерживающее лечение), и средства неотложной помощи (облегчающее течение).
Препараты для поддерживающего лечения принимают ежедневно и длительно, так как благодаря противовоспалительному действию они обеспечивают контроль за БА. Средства для облегчения симптомов принимают по потребности. Эти лекарственные препараты действуют быстро, устраняя бронхоспазм и купируя связанные с ним нарушения.
Если у больного развивается приступ БА, то проводят неотложное лечение, а при развитии астматического статуса — интенсивную терапию. Лечение приступа БА проводят с учетом возраста пациента и тяжести приступа.
Легкий приступ больные, как правило, могут купировать самостоятельно. Используют лекарственные вещества в таблетках (аминофиллин) или ингаляторах (сальбутамол, фенотерол — Р2-адреностимуляторы; ипратропия бромид + фенотерол, сочетающий Р2-адреностимулирующий и холинолитический эффект). При отсутствии ингаляторов приступ купируют подкожным введением 5% раствора эфедрина (в дозе 0,5 мл) в сочетании с 2% раствором папаверина (в дозе 1 мл) и антигистаминного препарата (дифенгидрамин или хлоропирамин в дозе 1 мл).
Приступы средней тяжести у молодых пациентов с недлительным анамнезом купируют ингаляционным введением симпатомиметических средств. При отсутствии эффекта внутривенно вводят аминофиллин. Возможно введение растворов бронхолитических средств через небулайзер. Иногда приступ прекращается только после внутривенного введения преднизолона в дозе 60 мг.
Пожилым больным среднетяжелый и тяжелый приступ (особенно при длительном анамнезе) купируют с помощью введения бронхолитических средств через небулайзер (прибор, позволяющий распылять лекарственные вещества до мельчайших частиц, — 1−5 мкм, которые проникают в дыхательные пути). При отсутствии эффекта внутривенно вводят преднизолон.
При тяжелых приступах, помимо внутривенного введения преднизолона и его приема внутрь (в дозе 40−50 мг), возможной альтернативой может быть небулайзерная терапия бронхолитическими средствами с последующим (через 30 мин) введением глюкокортикоидов (суспензия будесонида в дозе 2 мг). При отсутствии небулайзера прибегают к повторному введению преднизолона. При тяжелом приступе рекомендована бронхолитическая терапия в сочетании с мукорегуляторами (амброксол, ацетилцистеин). Существенное значение имеет выравнивание измененного кислотно-основного состояния, в связи с чем проводят инфузионную терапию натрия гидрокарбонатом и изотоническим раствором хлорида натрия (особенно в тех случаях, когда приступ затягивается и мокрота отходит очень плохо). Больного в обязательном порядке госпитализируют.
Обычно для быстрейшего купирования приступа назначают кислородотерапию. Чтобы достичь сатурации крови кислородом более 90%, вдыхание кислорода следует проводить через интраназальный зонд (канюлю) или маску. Для поддержания удовлетворительной сатурации кислородотерапию следует титровать с помощью пульсоксиметрии.
При затянувшихся тяжелых приступах БА резко возрастает угроза развития астматического статуса.
Лечение астматического статуса заключается в проведении интенсивной терапии, которую необходимо начинать в максимально ранние сроки. Она включает следующие мероприятия.
- * Оксигенотерапия в виде непрерывной подачи кислородно-воздушной смеси с относительно небольшим содержанием кислорода (35−40%).
- * Инфузионная терапия, при которой внутривенно вводят декстраны, дектрозу, препарата инсулина, гепарин натрия в дозе 20 тыс. ЕД, натрия гидрокарбонат (под контролем показателей кислотно-основного состояния). Общий объем инфузии должен быть не менее 3−3,5 л в первые сутки. Это позволяет восполнить дефицит жидкости, устранить гемоконцентрацию и добиться разжижения бронхиального содержимого.
- * Небулайзерная терапия бронходилататорами и глюкокортикоидами (суспензия будесонида).
В качестве бронхорасширяющих средств используют небулайзерную терапию в2-агонистами или ипратропия бромидом + фенотеролом, несмотря на то, что ранее больной мог в больших дозах использовать в2-агонисты (фенотерол, сальбутамол) через дозированный аэрозольный ингалятор без выраженного эффекта.
* При отсутствии небулайзера назначают прием глюкокортикоидов внутрь (однократно преднизолон в дозе 40−60 мг) в сочетании с внутривенным введением гидрокортизона в дозе 1 мг/кг массы тела или преднизолона в дозе 60−90 мг каждые 2−4 ч (при I стадии статуса). Во II стадии суточную дозу преднизолона доводят до 1000−1500 мг. После выведения из астматического статуса дозу глюкокортикоидов ежесуточно уменьшают на 25% до достижения минимальной.
Для разжижения мокроты используют щелочное питье и парокислородные ингаляции. Применение мочегонных средств рекомендовано лишь при увеличении центрального венозного давления до 150 мм вод.ст. и более.
Для усиления отделения содержимого бронхов активно используют перкуссионный и вибрационный массаж грудной клетки.
Прогрессирующее нарушение легочной вентиляции, не поддающееся консервативному лечению, — показание к применению неинвазивной или искусственной вентиляции легких и лечебной бронхоскопии, а также к проведению бронхоальвеолярного лаважа с отмыванием и удалением бронхиального содержимого.
Лечение анафилактического варианта астматического статуса требует проведения немедленного парентерального введения лекарственных средств: 0,1% раствора эпинефрина в дозе 0,3−0,5 мл в 20 мл изотонического раствора хлорида натрия и струйного внутривенного введения преднизолона в дозе 120 мг (гидрокортизона в дозе 200−400 мг) с последующим переходом на их внутривенное капельное введение. Одновременно можно добавить 0,1% раствор атропина в дозе 0,5−1 мл, вводя его струйно в 10 мл изотонического раствора.
При отсутствии эффекта от перечисленных мероприятий проводят фторотановый наркоз и переводят больного на искусственную вентиляцию легких.
После купирования приступа БА проводят плановое лечение, направленное на ликвидацию обострений заболевания.
Лечебные мероприятия, осуществляемые в период обострения и ремиссии, имеют свои особенности.
Лечение больного БА в период обострения, помимо купирования приступа, включает ряд различных мероприятий:
- * устранение контакта с обнаруженным аллергеном;
- * медикаментозное противовоспалительное лечение. Глюкокортикоиды в настоящее время считают наиболее эффективными противовоспалительными средствами для лечения БА. Основной путь их введения — ингаляционный. Для доставки ингаляционных глюкокортикоидов в дыхательные пути используют различные устройства: дозированный аэрозольный ингалятор, дозированный аэрозольный ингалятор со спейсером, дозированный аэрозольный ингалятор, активируемый вдохом («Легкое дыхание»), и различные порошковые ингаляторы (турбухалер, хендихалер, спинхалер, дискус, аэролайзер и др.). При тяжелом обострении БА глюкокортикоиды назначают системно (внутрь или парентерально).
Предпочтительно ингаляционное введение глюкокортикоидов, оказывающее местный противовоспалительный эффект и обладающее минимумом побочных реакций. Применяют производные беклометазона дипропионата (беклометазон), которые следует использовать не менее 3 раз в день. Такие препараты как флутиказон, будесонид турбухалер и будесонид характеризуются большей продолжительностью действия, что позволяет использовать их 2 раза в сутки для надежного контроля за течением БА. В настоящее время считают желательным применение всех дозированных аэрозольных ингаляторов вместе со специальной пространственной насадкой (спейсером), что облегчает больному пользование аэрозолем, увеличивает его поступление в нижние дыхательные пути, а также дополнительно снижает риск развития местных и системных побочных эффектов. Наиболее эффективное устройство для ингаляционного введения глюкокортикоидов — небулайзер, но его чаще применяют для купирования тяжелого обострения.
Если высокие дозы ингалируемых глюкокортикоидов (более 1000 мкг/сут) не обеспечивают надежный контроль за течением БА, то добавляют их прием внутрь. При выраженной эозинофилии местное введение сочетают с приемом этих препаратов внутрь в виде так называемых толчков: три дня по 20−25 мг преднизолона (другого глюкокортикоида в соответствующей дозе). Большую часть суточной дозы рекомендуют принимать в утренние часы, а заканчивать прием не позднее 5−6 ч вечера.
За 30−40 мин до ингаляции глюкокортикоидов вдыхают коротко действующие бронхолитики.
Бронхолитическая терапия
Симпатомиметические и (или) холинолитические препараты короткого действия назначают в виде дозированного аэрозоля, как правило, при возникновении предвестников приступа удушья. Не рекомендуют плановое применение этих средств в ингаляторах чаще 4 раз в сутки во избежание развития побочных эффектов (тахикардия, повышение АД, нарушения ритма сердца). При БА, вызываемой физической нагрузкой, эффективны в2-адреностимуляторы, как и блокаторы медленных кальциевых каналов (А.Г. Чучалин, 1985). При тяжелом обострении БА эти препараты (специальные растворы фенотерола, ипратропия бромида или ипратропия бромида + фенотерола) можно вводить с помощью небулайзера.
В настоящее время наряду с ингаляционными в2-агонистами короткого действия — фенотеролом и сальбутамолом, длительность бронхолитического действия которых составляет 4−6 ч, — применяют пролонгированные в2-агонисты с продолжительностью действия более 12 ч, в частности салметерол и формотерол. Отличительная черта производных формотерола — не только их длительное действие, но и очень быстрый эффект, свойственный в2-агонистам короткого действия. Он обеспечивает их преимущество перед салметеролом.
Такие длительно действующие в2-агонисты, как салметерол и формотерол, помимо бронхолитического эффекта оказывают и слабое противоспалительное действие.
Симпатомиметики длительного действия также применяют в форме таблеток (вольмакс и др.). Их можно применять внутрь перед сном при ночных приступах БА только у лиц молодого возраста (у пожилых больных их применение нежелательно).
В настоящее время внутривенное введение аминофиллина не рекомендовано. Используют пролонгированные формы теофиллина.
Ингаляционные холинолитики (например, ипратропия бромид) имеют определенные преимущества перед в2-агонистами у лиц пожилого возраста. Ипратропия бромид также применяют в комбинации с фенотеролом (ипратропия бромид + фенотерол). Его использование особенно оправдано при лечении обострения БА, индуцированного вирусной инфекцией, которая, с одной стороны, снижает активность в2-агонистов, а с другой стороны, активирует холинергический механизм бронхиальной обструкции.
С учетом тяжести течения БА, определяемой согласно критериям GINA (2002), предложена следующая ступенчатая схема лечения заболевания с применением вышеописанных средств (табл. 1−7).
Таблица 1−7. Ступенчатый подход к лечению бронхиальной астмы (GINA, 2002)*.
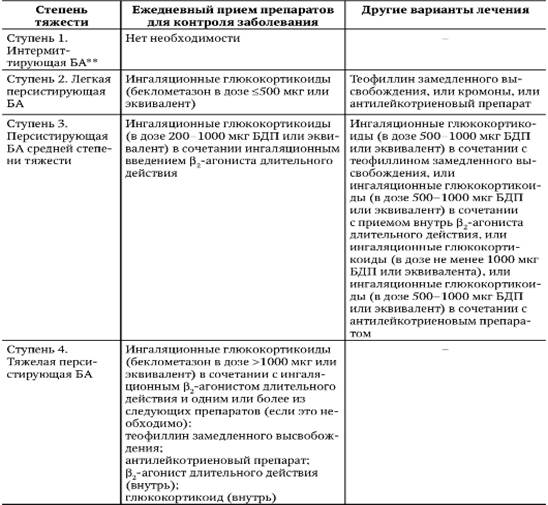
* Для всех ступеней: помимо ежедневного приема препаратов для контроля заболевания, для купирования острых симптомов по потребности следует применять ингаляционный Р2-агонист быстрого действия, но не чаще 3−4 раз в день. После достижения контроля за БА и его сохранения в течение, по крайней мере, 3 мес следует попытаться постепенно уменьшать поддерживающее лечение, чтобы установить его минимальный объем, требующийся для поддержания контроля. ** Пациенты с интермиттирующей БА, но с тяжелыми обострениями должны получать лечение соответственно персистирующей БА средней степени тяжести.
Кромоны (кромоглициевая кислота или недокромил) играют ограниченную роль в длительном лечении БА у взрослых. Они обладают слабым противовоспалительным действием и менее эффективны, чем низкие дозы ингаляционных глюкокортикоидов.
Теофиллины замедленного высвобождения (длительного действия), являясь бронхолитиками, обладают и небольшим противовоспалительным эффектом, но не могут в полной мере обеспечить лечебное воздействие в монотерапии. Кроме того, побочные эффекты теофиллина, особенно при его применении в высоких дозах, могут быть значительными, что ограничивает применение препарата.
Антилейкотриеновые препараты (антагонисты лейкотриеновых рецепторов — зафирлукаст и монтелукаст) обладают слабым бронхорасширяющим эффектом, уменьшают активность воспаления в дыхательных путях, могут снижать частоту обострений и выраженность симптомов. С учетом вышеизложенного, эти средства можно использовать в качестве препаратов второго ряда для лечения взрослых пациентов с легкой персистирующей БА. Кроме этого антилейкотриеновые препараты можно рекомендовать для лечения больных БА в сочетании с аллергической риносинусопатией (в том числе — полипозным риносинуситом), «аспириновой» БА и БА физического усилия.
В настоящее время наиболее современными препаратами, обеспечивающими выраженный противовоспалительный эффект, считают фиксированные комбинации длительно действующего в2-агониста (салметерол или формотерол) с ингаляционными глюкокортикоидами (флутиказон или будесонид).
Комбинация салметерола с флутиказоном, называемая серетидом* и выпускаемая в дозе 25/250 мкг или 50/250 мкг, как и комбинация будесонида с формотеролом, называемая симбикортом турбухалером*и выпускаемая в дозе 80/4,5 мкг или 160/4,5 мкг, по своей эффективности превышает сумму эффектов каждого из компонентов. Этот эффект обусловлен синергизмом их действия.
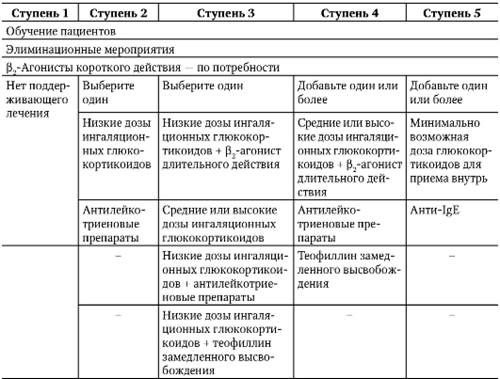
Поскольку БА — хроническое заболевание, основной целью его лечения считают не излечение самого заболевания, а достижение полноценного контроля над его течением. Для решения этой задачи в новой редакции GINA (2006, 2008) ступенчатый подход к лечению БА с учетом достижений последних лет и внедрения новых лекарственных препаратов выглядит несколько иначе (табл. 1−8) и состоит из пяти ступеней.
В новых рекомендациях повышена роль антилейкотриеновых препаратов: их можно использовать уже на второй ступени лечения в качестве монотерапии. На пятой ступени лечения рекомендовано добавить к терапии, назначаемой на четвертой ступени, минимально возможные дозы глюкокортикоидов для приема внутрь и (или) антитела к IgE. Применение анти-IgE (омализумаб) ограничено назначением пациентам с повышенным содержанием IgE в крови при тяжелой аллергической БА, контроля за которой не могут достичь с помощью применения ингаляционных глюкокортикоидов в оптимальных дозах.
Принцип использования бронхолитических препаратов с быстрым началом действия на каждой ступени лечения больных БА остается и в новых рекомендациях. Их применение возможно не чаще 3−4 раз в день на протяжении не более 3 сут подряд. Регулярное использование этих средств в указанных дозах делает необходимым переход лечения на более высокую ступень и требует увеличения объема противовоспалительной терапии до тех пор, пока не будет достигнут контроль за БА. Для его поддержания требуется постоянное мониторирование симптомов и значений ПСВ. С учетом того, что БА — вариабельное заболевание, возникает потребность в периодической коррекции лечения. Подчеркивают, что применение в2-агонистов длительного действия, обладающих способностью оказывать быстрый бронхорасширяющий эффект (формотерол), возможно лишь при использовании их по потребности и только в сочетании с ингаляционными глюкокортикоидами (будесонид + формотерол).
Если же достигнут стойкий контроль за БА, то не ранее чем через 3 мес можно уменьшить объем медикаментозного лечения, доведя его со временем до минимального, обеспечивающего контроль за заболеванием.
Таблица 1−8. Ступени лечения бронхиальной астмы (GINA, 2006)
Дополнительное лечение
- * При обострении инфекционно-воспалительного процесса в бронхолегочной системе у больного инфекционнозависимой БА применяют антибактериальные препараты.
- * При отсутствии эффекта от медикаментозного лечения у больных при сопутствующем катарально-гнойном и гнойном эндобронхите проводят лечебную бронхоскопию под наркозом. Местно вводят антибактериальные средства, предпочтение отдают 1% раствору гидроксиметилхиноксалиндиоксида. При необходимости эндобронхиально вводят глюкокортикоиды (гидрокортизон).
- * При вязкой, трудно отделяемой мокроте назначают муколитические препараты в виде ингаляции (амброксол, ацетилцистеин), таблеток, сиропов или растворов (амброксол, ацетилцистеин, алтея лекарственного травы экстракт). Хорошее секретолитическое действие оказывает горячее щелочное питье. Применение йодистых препаратов (3% раствор калия йодида по одной столовой ложке 3−4 раза в день) не рекомендовано в связи с возможным развитием побочных эффектов (слезотечение, ринорея, усиление бронхоспазма). Не следует использовать настои и отвары трав в качестве муколитической терапии вследствие их возможного аллергизирующего действия.
- * Противокашлевые препараты (бромгексин, преноксдиазин) назначают при упорном кашле. При сухом надсадном кашле рекомендовано применение кодеина, этилморфина и бутамирата + гвайфенезина.
- * Антигистаминные препараты при лечении больных БА имеют лишь вспомогательное значение. Используют их блокирующее действие на H1- рецепторы, уменьшая таким образом действие гистамина на гладкую мускулатуру бронхов. Существует две генерации блокаторов H1-рецепторов. Препараты первого поколения (дифенгидрамин, клемастин, хлоропирамин, прометазин, мебгидролин) оказывают ряд нежелательных эффектов (снотворный, сухость во рту, тахикардия, задержка мочи и др.), что резко ограничивает их применение. Их применяют в острых ситуациях при развитии аллергической реакции. Препараты второго поколения — лоратадин, дезлоратадин, эбастин, фексофенадин — лишены этих недостатков. Кроме того, помимо блокады Н1-рецепторов, в высоких дозах они уменьшают выделение медиаторов из тучных клеток и базофилов. Комбинацию сосудосуживающего средства с лоратадином (псевдоэфедрин в дозе 120 мг и лоратадин в дозе 5 мг) — клариназе8 — с успехом применяют для лечения аллергического ринита (по одной таблетке 2 раза в день). Лечение последних блокаторами Н1-рецепторов второго поколения, как и интраназальными глюкокортикоидами (мометазон, флутиказон, беклометазон, будесонид и др.), может уменьшить симптомы БА.
- * При выраженных невротических реакциях и гипервентиляционных расстройствах у больных БА можно использовать психотропные средства (тианептин, диазепам и др.).
- * При БА физического усилия и в случае сочетания БА с ИБС возможно назначение блокаторов медленных кальциевых каналов (верапамил), которые ингибируют трансмембранный поток кальция, что ведет к уменьшению выхода медиаторных веществ из тучных клеток и способствует расслаблению гладких мышц как бронхов, так и сосудов.
Помимо медикаментозного лечения при БА используют физиотерапевтические методы воздействия: массаж грудной клетки и занятия ЛФК, включающие комплекс дыхательной гимнастики. Благоприятный эффект в комплексном лечении больных БА может оказать иглорефлексотерапия.
Специфическая иммунотерапия (СИТ), согласно рекомендациям GINA (2006), играет небольшую роль в лечении пациентов с БА. Вместе с тем результатом ее проведения может быть уменьшение выраженности симптомов, потребности в лекарственных препаратах, а также снижение аллергенспецифической и неспецифической бронхиальной гиперреактивности. Для проведения полноценной СИТ необходимы определение и использование одного клинически значимого аллергена. При лечении его вводят в нарастающих дозах с целью выработки толерантности. Помимо этого существует множество противопоказаний к проведению СИТ, в том числе ограничение по возрасту (не более 50 лет).
Для успешного лечения больных с БА необходимо развивать сотрудничество между пациентом и медицинским работником, неотъемлемой частью которого служит обучение пациентов.
Обучение пациентов в программе лечения БА — одна из главных задач. Его цель — научить больного жить с БА, широко используя партнерство врача и больного в лечении заболевания. Пациенты проходят занятия в астма-школе, увеличивают объем знаний о сущности заболевания, принципах его лечения и самоконтроля. Знания закрепляют в процессе индивидуального общения врача и больного и составления индивидуальных планов борьбы с заболеванием. Последние помогают пациентам корректировать лечение в зависимости от уровня контроля за БА, установленного по изменению выраженности симптомов и (или) значения ПСВ. С этой целью пикфлоуметр, по которому пациент определяет значения ПСВ, измеряя их утром и вечером, и контролирует состояние бронхиальной проходимости, должен иметь каждый больной.
Прогноз
Прогноз при БА различен и зависит от многих причин, в том числе от тяжести и характера течения заболевания (при атопической БА он более благоприятный, чем при инфекционно зависимой), эффективности лечения, отношения пациента к заболеванию и соблюдения больным рекомендаций врача.
Отсутствие эффекта от лечения обычно отмечают среди молодых пациентов. Это может быть связано с небрежным отношением к приему противовоспалительных препаратов, невысокой степенью содружества с врачом или неправильной оценкой БА пациентами и медицинскими работниками.
Все больные БА должны постоянно находиться под наблюдением терапевта и врача-аллерголога.
Профилактика
Первичная профилактика БА состоит в лечении больных в состоянии предастмы и обнаружении у практически здоровых лиц с отягощенной наследственностью биологических дефектов, представляющих угрозу возникновения заболевания (повышенная чувствительность к метахолину* и др.).
Методы первичной профилактики должны включать устранение из окружающей больных среды потенциально опасных аллергенов, ирритантов и других факторов, которые могут привести к развитию болезни (гипоаллергенная диета, запрещение курения, прекращение контакта с производственными вредностями, занятия физкультурой и др.).
При лечении больных в состоянии предастмы необходимо санировать очаги инфекции, проводить лечение аллергической риносинусопатии, применять различные методы немедикаментозного воздействия, включая иглои психотерапию, ЛФК, баротерапию и санаторно-курортное лечение. Рекомендовано проведение специфической (при определении аллергена) и неспецифической гипосенсибилизации.