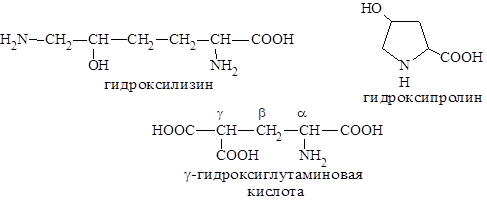Аминокислоты.
Амины, аминоспирты, аминокислоты, белки

Организм синтезирует аминокислоты главным образом из пищевых белков. Но есть целая группа аминокислот, которых организм сам синтезировать не может. Эти аминокислоты называют незаменимыми. К ним относятся (валин, лейцин, изолейцин, лизин, треонин, метионин, фенилаланин и триптофан) Такие аминокислоты должны поступать в организм извне. В настоящее время известно свыше 150 аминокислот, но только 20… Читать ещё >
Аминокислоты. Амины, аминоспирты, аминокислоты, белки (реферат, курсовая, диплом, контрольная)
аминокислота бензольный пептид Аминокислотами называют бифункциональные производные углеводородов, которые содержат карбоксильную группу COOH и аминогруппу NH2.
Номенклатура По систематической номенклатуре аминокислоты называют, по соответствующей карбоновой кислоте добавляя приставку амино-. Положение аминогруппы в углеродной цепи указывают цифрой:
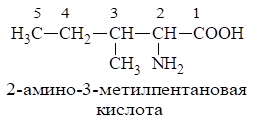
Подробнее номенклатурные правила для названий аминокислот изложены в пособии Левина И. Ю., Берлянд А. С. «Номенклатура, классификация и электронное строение химических связей в органических соединениях».
В зависимости от положения аминогруппы по отношению к карбоксильной группе различают б, в, г и так далее аминокислоты:

Все природные аминокислоты содержат аминогруппу только в б-положении и имеют общую формулу:
Помимо систематической, для природных аминокислот широко распространена тривиальная номенклатура (аланин, валин, лизин и т. д.). Иногда запись аминокислот осуществляют, используя трехбуквенные сокращения (Ala, Val, Lys и др.).
Классификация аминокислот
В настоящее время единой классификации аминокислот не существует.
Аминокислоты делят на природные (содержатся в растительных и животных организмах) и синтетические — получены икусственным путем.
Организм синтезирует аминокислоты главным образом из пищевых белков. Но есть целая группа аминокислот, которых организм сам синтезировать не может. Эти аминокислоты называют незаменимыми. К ним относятся (валин, лейцин, изолейцин, лизин, треонин, метионин, фенилаланин и триптофан) Такие аминокислоты должны поступать в организм извне. В настоящее время известно свыше 150 аминокислот, но только 20 из них входят в состав белков.
По природе радикала аминокислоты делят на:
1. Моноаминомонокарбоновые:
Строение радикала кислоты R. | Название. | Условное обозначение. | |
Тривиальное. | Cистематическое. | ||
H. | Глицин. | аминоэтановая. | Гли. Gly. |
CH3 | Аланин. | 2-аминопропановая. | Ала. Ala. |
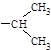 Валин. | 2-амино-3-метил-бутановая. | Вал. Val. | |
 Лейцин. | 2-амино-4-метил-пентановая. | Лей. Leu. | |
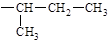 Изолейцин. | 2-амино-3-метил-пентановая. | Иле. Ile. |
2. Гидроксилсодержащие:
Строение радикала кислоты R. | Название. | Условное обозначение. |
Тривиальное. | Cистематическое. | |
Серин. | 2-амино-3-гидрокси-пропановая. | Сер Ser. |
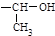 Треонин. | 2-амино-3-гидрокси-бутановая. | Тре. Thr. |
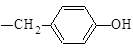 Тирозин. | 2-амино-3-(4-гидро-ксифенил)пропановая. | Тир Tyr. |
3. Серусодержащие:
Строение радикала кислоты R. | Название. | Условное обозначение. |
Тривиальное. | Cистематическое. | |
Цистеин. | 2-амино-3-мер-каптопропановая. | Цис. Cys. |
Метионин. | 2-амино-4-метил-тиобутановая. | Мет. Met. |
4. Аминокислоты, содержащие в радикале дополнительную аминогруппу или гуанидильный остаток.
Строение радикала кислоты R. | Название. | Условное обозначение. |
Тривиальное. | Cистематическое. | |
Лизин. | 2,6-диамино-гексановая. | Лиз. Lys. |
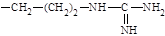 Аргинин (содержит гунидиновую группу). | 2-амино-5-гуанидил-пентановая. | Арг. Arg. |
5. Аминокислоты, которые содержат в радикале дополнительную карбоксильную или амидную группы:
Строение радикала кислоты R. | Название. | Условное обозначение. |
Тривиальное. | Cистематическое. | |
Аспарагиновая. | 2-аминобутан-диовая. | Асп. Asp. |
Глутаминовая. | 2-аминопентан-диовая. | Глу. Glu. |
 Аспарагин. | 2-амино-3-карбоксамидо-пропановая. | Асн. Asn. |
 Глутамин. | 2-амино-4-карбоксамидо-бутановая. | Глн. Gln. |
6. Ароматические и гетероциклические аминокислоты:
Строение радикала кислоты R. | Название. | Условное обозначение. |
Тривиальное. | Cистематическое. | |
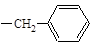 Фенилаланин. | 2-амино-3-фенил-пропановая. | Фен. Phe. |
 Триптофан. | 2-амино-3-индол-илпропановая. | Три. Trp. |
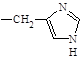 Гистидин (иминокислота). | 2-амино-3-имидо-золилпропановая. | Гис. His. |
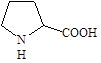 Пролин (полная форма). | 2-пирролидин-карбоновая. | Про. Pro. |
Современная рациональная классификация основана на полярности радикалов. Полярность радикала во многом определяет такое важное свойство аминокислот как растворимость в воде и в других полярных растворителях. Полярные группы радикала (COOH, NH2, OH и др.) притягивают воду и тем самым повышают растворимость аминокислот в воде, неполярные радикалы, наоборот, отталкивают воду и снижают растворимость аминокислот в воде.
В этой связи различают:
1. Аминокислоты с неполярными (гидрофобными) радикалами.
К ним относятся гидрофобные радикалы аланина, валина, лейцина, изолейцина, пролина, метионина, фенилаланина и триптофана. Радикалы этих аминокислот воду не притягивают, а стремятся друг к другу или к другим гидрофобным молекулам.
2. Аминокислоты с полярными (гидрофильными) радикалами.
К ним относятся серин, треонин, тирозин, аспарагин, глутамин и цистеин. В состав радикалов этих аминокислот входят полярные функциональные группы, образующие водородные связи с водой.
В свою очередь, эти аминокислоты делят на две группы:
1) способные к ионизации в условиях организма (ионогенные).
Например, при рН = 7 фенольная гидроксильная группа тирозина ионизирована на 0,01%; тиольная группа цистеина на 8%.
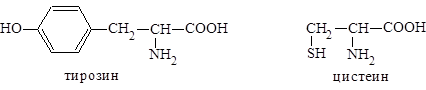
2) не способные к ионизации (неионогенные).
Например, гидроксильная группа треонина:
3. Аминокислоты с отрицательно заряженными радикалами.
К этой группе относят аспарагиновую и глутаминовую кислоты. Эти аминокислоты называют кислыми, так как они содержат дополнительную карбоксильную группу в радикале, которая диссоциирует с образованием карбоксилат-аниона. Полностью ионизированные формы этих кислот называют аспартатом и глутаматом:
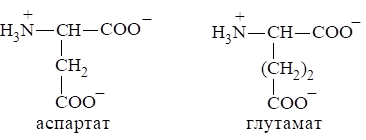
К этой же группе иногда относят аминокислоты аспарагин и глутамин, содержащие карбоксамидную группу (СОNH2), как потенциальную карбоксильную группу, возникающую в процессе гидролиза.
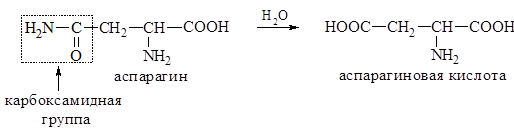
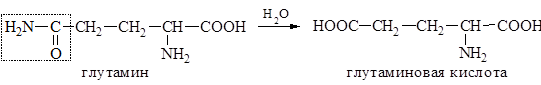
Величины рKa в-карбоксильной группы аспарагиновой кислоты и г-карбоксильной группы глутаминовой кислоты выше по сравнению с рKa б-карбоксильных групп и в большей степени соответствуют значениям рKa карбоновых кислот.
4. Аминокислоты с положительно заряженными радикалами К ним относят лизин, аргинин и гистидин. У лизина есть вторая аминогруппа, способная присоединять протон:
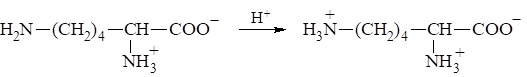
У аргинина положительный заряд приобретает гуанидиновая группа:
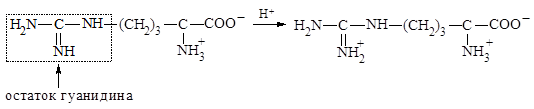
Один из атомов азота в имидазольном кольце гистидина содержит неподеленную пару электронов, которая также может присоединять протон:
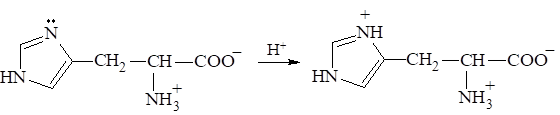
Эти аминокислоты называют оснувными.
Отдельно рассматриваются модифицированные аминокислоты, содержащие в радикале дополнительные функциональные группы: гидроксилизин, гидроксипролин, г-карбоксиглутаминовая кислота и др. Эти аминокислоты могут входить в состав белков, однако модификация аминокислотных остатков осуществляется уже в составе белков, т. е. только после окончания их синтеза.