Особенности биохимического процесса обмена веществ в организме человека.
Основные физиологические эффекты действия простагландина, кортизола, адреналина и инсулина

Согласно современным представлениям биосинтез инсулина осуществляется в Р-клетках панкреатических островков из своего предшественника — проинсулина, впервые выделенного Д. Стайнером в 1966 г. В настоящее время не только выяснена первичная структура проинсулина, но и осуществлен его химический синтез. Проинсулин представлен одной полипептидной цепью, содержащей 84 аминокислотных остатка; он лишен… Читать ещё >
Особенности биохимического процесса обмена веществ в организме человека. Основные физиологические эффекты действия простагландина, кортизола, адреналина и инсулина (реферат, курсовая, диплом, контрольная)
1. Энергетический режим организма. Общие понятия обмена веществ. Выход энергии при окислении пищевых веществ. Основной обмен. Использование энергии химических связей. Сущность окисления. Реакция между дегигидрогеназами. Флавиновые ферменты. Дыхательная цепь. Механизм окислительного фософорилирования. Фотосинтез Обмен веществ и энергии — закономерный порядок превращения веществ и энергии в живых системах, направленный на их сохранение и самовоспроизведение. Обмен веществ и обмен энергии неразрывно связаны и представляют собой диалектическое единство.
В живых организмах химическая энергия превращается в другие виды энергии и используется для выполнения ряда функций прямо без промежуточной теплопродукции. Поскольку в основе жизнедеятельности не лежит принцип непосредственного использования тепловой энергии, простое окисление органических веществ в организме с выделением энергии исключительно в тепловой форме явилось бы бесполезной потерей энергии.
Первичным источником энергии для всей живой природы является солнечное излучение. Все многообразие организмов, обитающих на Земле, по использованию источников энергии можно разделить на две основные группы: аутотрофные и гетеротрофные организмы. Первые (аутотрофы) — прежде всего зеленые растения, способны непосредственно использовать лучистую энергию Солнца в процессе фотосинтеза, создавая органические соединения (углеводы, аминокислоты, жирные кислоты и др.) из неорганических веществ (рис. 1). Остальные живые организмы (гетеротрофы) ассимилируют уже готовые органические вещества, используя их как источник энергии или пластического материала для построения своего тела. Следует отметить, что большинство микроорганизмов тоже являются гетеротрофами. Однако они не способны поглощать целые пищевые частицы и выделяют в окружающую их среду специальные переваривающие ферменты, которые расщепляют пищевые вещества, превращая их в малые, растворимые молекулы, которые могут проникнуть в клетки.
Как уже отмечалось, углеводы, жиры или белки и продукты их расщепления не могут непосредственно служить «топливом» для клеточных процессов. В результате таких процессов, как тканевое дыхание, брожение и гликолиз, которые занимают центральное место в обмене веществ, происходит постепенное освобождение и аккумуляция энергии, заключенной в молекулах сложных органических соединений.
Чтобы понять сущность процессов обмена энергии, необходимо познакомиться с рядом общих положений термодинамики. Первый закон термодинамики — это закон о сохранении энергии. Этот закон утверждает, что энергию нельзя ни создать, ни уничтожить. Математически первый закон термодинамики можно выразить следующей формулой:


Рис. 1. Схематическое изображение превращений энергии, протекающих в клетке
Данное уравнение справедливо для идеальной обратимой системы, т. е. такой системы, которая, будучи переведенной в новое состояние путем поглощения энергии, может вновь возвратиться в исходное состояние и освободить то же самое количество ранее поглощенной энергии. Последняя может быть использована для совершения новой работы. Однако в природе полностью обратимых систем не существует. Самопроизвольно химические процессы могут протекать лишь в одном направлении — в направлении состояния равновесия. Предсказать направление биохимических реакций позволяет второй закон термодинамики, согласно которому все самопроизвольные процессы протекают в направлении, соответствующем максимальной при данных условиях энтропии (5), до достижения состояния равновесия системы. Энтропия (S) — мера разупорядоченности системы. Увеличение энтропии системы препятствует возврату к исходному состоянию. Поэтому все реакции, которые сопровождаются возрастанием энтропии, необратимы. Для обращения их затрачивают дополнительную энергию. Существует также понятие — свободная энергия. Это та часть энергии системы, которую можно использовать для совершения работы при постоянных температуре и давлении. Ее изменение обозначают символом ДG. Ту же часть энергии химического процесса, которая не может быть превращена в работу, называют связанной энергией и выражают произведением TДS (где Т— абсолютная температура, a ДS изменение энтропии системы при данном химическом превращении). Сумма изменений свободной и связанной энергий называется энтальпией (или теплосодержанием системы) и, как уже отмечалось, обозначается символом ДН. Второй закон термодинамики может быть представлен следующей формулой:
Если (например, в ходе реакции А>В) величина ДG имеет отрицательное значение, то это означает, что свободная энергия вещества В меньше, чем свободная энергия вещества А. В этом случае реакция может происходить самопроизвольно с выделением свободной энергии (экзергонический процесс). Наоборот, если ДG — положительная величина, то свободная энергия у вещества В выше, чем у соединения А, и самопроизвольно реакция протекать не может. Она протекает с потреблением энергии извне (эндергонический процесс). Если система находится в состоянии равновесия, то количество свободной энергии (ДG) равно нулю.
Величины ДG могут выражаться в джоулях на моль или калориях на моль.
Высокоэнергетические фосфаты. В клетках освобождающаяся в результате катаболических процессов распада питательных веществ свободная энергия в дальнейшем может быть использована для осуществления многих химических реакций, протекающих с затратой энергии (см. рис. 1).
Запасание энергии происходит в виде богатых энергией химических связей особого класса соединений, большинство из которых является ангидридами фосфорной кислоты (нуклеозидтрифосфаты).
Существуют высокоэнергетические и низкоэнергетические фосфаты. Условной границей для этих двух групп соединений является величина свободной энергии гидролиза фосфатной связи. Следовательно, высокоэнергетические фосфаты имеют богатую энергией высокоэргическую (макроэргическую) фосфатную связь.
Когда говорят о богатых энергией связях, то в этом случае энергию связи определяют как разницу свободных энергий соединений, содержащего эту связь, и соединений, получающихся после ее разрыва. Макроэргическими (богатыми энергией) принято считать те связи, при гидролизе которых изменения свободной энергии системы (-ДG) составляют более 21 кЛж/моль (или более 5 ккал/моль).
Центральную роль в энергообмене клеток всех типов осуществляет система адениновых нуклеотидов, которая включает в себя АТФ, АДФ и АМФ, а также неорганический фосфат (Фн) и ионы магния. АТФ является термодинамически неустойчивой молекулой и гидро-лизуется с образованием АДФ или АМФ. Именно эта неустойчивость позволяет АТФ выполнять функцию переносчика химической энергии, необходимой для удовлетворения большей части энергетических потребностей клеток. К соединениям, обладающим богатой энергией связью, помимо АТФ, относятся также УТФ, ЦТФ, ГТФ, ТТФ, креатинфосфат, пирофосфат, некоторые тиоэфиры (например, ацетил-КоА), фосфоенолпируват, 1,3-бисфосфоглицерат и ряд других соединений (табл. 1). Однако образование этих соединений в большинстве случаев зависит от энергии, поставляемой АТФ.
Таблица 1. Стандартная свободная энергия гидролиза (ДG°) некоторых высокоэнергетических и низкоэнергетических соединений, а также свободная энергия гидролиза ряда соединений при физиологических условиях (Д<5ф).
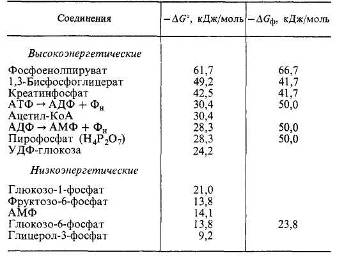
Стандартные условия: 1,0 М концентрации исходных и конечных продуктов, рН 7,0, температура 37 °C и избыток ионов магния. В этих условиях при гидролизе АТФ (АТФ + Н2О>АДФ + Фн) изменение свободной энергии (—AG0) составляет -30,4 кДж/моль. При физиологических условиях в клетке не имеется таких высоких концентраций исходных веществ и их продуктов, а также ионов магния. Кроме того, возможны отклонения и в значениях рН. Поэтому в физиологических условиях реальная свободная энергия (— ДGф) гидролиза концевой фосфатной связи ДТФ будет иная и приближается к -50,0 кДж/моль.
Величина — ДGф для других соединений отличается от стандартной (—ДG0), но не обязательно в сторону больших значений (см. табл. 1).
Заметим, что ДТФ, хотя и служит ключевым энергетическим посредником в обмене веществ, не является веществом, наиболее «богатым» энергией. АТФ находится в середине энергетической шкалы.
Возможно несколько вариантов освобождения энергии фосфатных связей АТФ. Основной вариант — это отщепление концевого фосфата АТФ (АТФ + Н2О > АДФ + Н3РО4). Другой вариант — пирофосфатное расщепление АТФ (АТФ + Н2О > АМФ + Н4Р2О7). Этот тип реакций значительно реже используется в биохимических процессах. Образующийся пирофосфат относится к «богатым энергией» веществам. Однако богатые энергией связи пирофосфата редко используются для синтеза других веществ, так как при его гидролизе энергия освобождается в виде теплоты.
При гидролизе концевой фосфатной связи АДФ высвобождается такое же количество энергии, как и при отщеплении концевой фосфатной связи АТФ. Казалось бы, что АДФ может во многих реакциях заменить АТФ, в частности в реакциях фосфорилирования. Однако эта возможность не реализуется в биохимических процессах. До сих пор реакции фосфорилирования при участии АДФ неизвестны. В действительности происходит гидролиз АДФ (АДФ + Н2О > АМФ + Н3РО4) до низкоэнергетических АМФ и фосфата с выделением теплоты.
Итак, накопление энергии в специфических фосфатных связях АТФ лежит в основе механизма переноса энергии в живой клетке. Есть основания считать, что в клетке существуют три основных типа перехода энергии АТФ: в энергию химических связей, в тепловую энергию и энергию, затрачиваемую на совершение работы (осмотичеекой, электрической, механической и др.).
Поскольку основным энергетическим источником для человека является энергия, запасенная в химических связях компонентов пищевых продуктов, питание человека следует рассматривать как один из факторов окружающей среды, существенно влияющий на его здоровье и продолжительность жизни. Разработкой основ рационального питания здоровых людей занимается гигиена питания, питанием больных — диетология. Для взрослого человека при средней по утомляемости работе требуется суточный рацион в 3000 ккал (1 ккал = 4,19 кДж). С увеличением энергозатрат возрастает и потребность в пищевых продуктах.
Существует понятие о сбалансированном рациональном питании, т. е. соотношении белков, жиров, углеводов — 1:1:4, за счет чего обеспечивается суточная энергетическая потребность организма. Белки обеспечивают 15% суточной энергетической потребности, жиры —30% и углеводы — 55%, причем белки животного происхождения должны составлять не менее половины общего количества белка, 75 — 80% общего количества жира должно приходиться на животные жиры и 20 — 25% — на растительные масла. Чтобы питание было полноценным, в пищевой рацион обязательно должны быть включены мясо, рыба, молочные продукты (основные источники белка и липидов), а также овощи, фрукты (источники углеводов), минеральные вещества, витамины.
Метаболизм — превращение веществ в организме с момента поступления их в клетки до образования конечных продуктов обмена, т. е. совокупность химических реакций, протекающих в живых клетках и обеспечивающих организм веществами и энергией для его жизнедеятельности, роста, размножения.
Попав внутрь клетки, питательное вещество претерпевает ряд химических изменений, катализируемых ферментами Определенная последовательность таких химических изменений называется метаболическим путем, а образующиеся промежуточные продукты — метаболитами. Различают две стороны обмена веществ — анаболизм и катаболизм Анаболические процессы направлены на образование и обновление структурных элементов клеток и тканей и заключаются в синтезе сложных молекул из более простых Эти процессы восстановительные и сопровождаются затратой свободной химической энергии (эндергонические процессы) Катаболические превращения — это расщепление сложных молекул, как поступивших с пищей, так и входящих в состав клетки, до простых компонентов, эти процессы окислительные и сопровождаются выделением свободной энергии (экзергонические процессы). Обе стороны метаболизма тесно взаимосвязаны во времени и пространстве Выяснение отдельных звеньев процесса обмена веществ и энергии у разных классов растений, животных и микроорганизмов обнаружило принципиальную общность путей биохимических превращений в живой природе Катаболические и анаболические пути, в особенности у эукариотических особей, отличаются по своей локализации в клетке В настоящее время благодаря электронно-микроскопическим и гистохимическим исследованиям, а также методу дифференциального центрифугирования достигнуты значительные успехи в определении внутриклеточной локализации ферментов На рис. 2 видно, что в клетке можно обнаружить клеточную, плазматическую, мембрану, ядро, митохондрии, лизосомы, рибосомы, систему канальцев и пузырьков — эндоплазматическую сеть, пластинчатый комплекс, различные вакуоли, внутриклеточные включения и др. Главную по массе недифференцированную часть клетки составляет гиалоплазма (или цитозоль).

Рис. 2. Схематическое изображение «обобщенной» клетки (по Леви и Сикевицу)
Установлено, что в ядре (точнее, в ядрышке) локализованы РНК-полимеразы, т. е. ферменты, катализирующие образование мРНК. В ядре содержатся ферменты, участвующие в процессе репликации ДНК, и некоторые другие.
С митохондриями связаны ферменты цепи биологического окисления (тканевого дыхания) и окислительного фосфорилирования, а также ферменты пируватдегидро-геназного комплекса, цикла трикарбоновых кислот, синтеза мочевины, окисления жирных кислот и др.
В лизосомах содержатся в основном гидролитические ферменты с оптимумом рН в области 5. Именно из-за гидролитической принадлежности ферментов эти частицы названы лизосомами.
В рибосомах локализованы ферменты белкового синтеза, в этих частицах происходят процессы трансляции мРНК и связывание аминокислот в полипептидные цепи с образованием молекул белка.
В эндоплазматической сети сосредоточены ферменты синтеза липидов, а также ферменты, участвующие в реакциях гидроксилирования.
С плазматической мембраной прежде всего связаны АТФаза, транспортирующая ионы Na+ и К+, аденилатциклаза и ряд других ферментов.
В цитозоле (гиалоплазме) локализованы ферменты гликолиза, пентозофосфатного цикла, синтеза жирных кислот и мононуклеотидов, активирования аминокислот, а также многие ферменты глюконеогенеза.
Существующая приуроченность ферментных систем к определенным участкам клетки (компартментализация) обеспечивает как разделение, так и интеграцию внутриклеточных функций, а также соответствующую регуляцию процессов обмена веществ и энергии в клетке.
Мультиферментные системы локализованы в структуре органелл таким образом, что каждый фермент располагается в непосредственной близости от следующего фермента данной последовательности реакций. Благодаря этому сокращается время, необходимое для диффузии промежуточных продуктов реакций, и вся последовательность реакций оказывается строго координированной во времени и пространстве. Это справедливо, например, для ферментов, участвующих в окислении пиро-виноградной кислоты и жирных кислот, синтезе белка, а также для ферментов переноса электронов в дыхательной цепи и окислительного фосфорилирования. Кроме того, компартментализация обеспечивает возможность протекания в одно и то же время как анаболических, так и катаболических процессов. Так, в клетке одновременно может происходить окисление жирных кислот с длинной цепью до стадии ацетил-КоА и противоположно направленный процесс — синтез жирных кислот из ацетил-КоА. Эти химически несовместимые процессы протекают в разных частях клетки: окисление жирных кислот — в митохондриях, а синтез — в гиалоплазме.
Регуляция метаболизма на клеточном и субклеточном уровнях осуществляется прежде всего путем регуляции синтеза и каталитической активности ферментов. К таким регуляторным механизмам относятся: подавление синтеза ферментов конечным продуктом метаболического пути, индукция синтеза одного или более ферментов субстратами, модуляция активности уже присутствующих молекул ферментов, в том числе аллостерическая регуляция. Большое значение имеет также регуляция скорости поступления метаболитов в клетку, где ведущую роль играют биологические мембраны, окружающие цитоплазму и находящиеся в ней ядро, митохондрии, лизосомы и другие субклеточные органеллы. В последующих главах приведено много примеров участия таких контрольных механизмов в регуляции метаболизма. Важнейшим средством, с помощью которого осуществляется регуляция обмена веществ в живых организмах, являются гормоны. Особая роль в механизме действия гормонов принадлежит циклическим нуклеотидам (цАМФ и цГМФ).
У животных и человека гормональная регуляция обмена веществ тесно связана с координирующей деятельностью нервной системы. Примером влияния нервной системы на углеводный обмен является так называемый сахарный укол Клода Бер-нара (механическое раздражение дна IV желудочка), который приводит к гипергликемии и глюкозурии в результате рефлекторного выброса надпочечниками адреналина в кровь и опосредованного аденилатциклазной системой расщепления гликогена в печени.
Важнейшая роль в процессах интеграции обмена веществ принадлежит коре большого мозга. Как указывал И. П. Павлов: «Чем совершеннее нервная система животного организма, тем она централизованнее, тем высший ее отдел является все в большей и большей степени распорядителем и распределителем всей деятельности организма… Этот высший отдел содержит в своем ведении все явления, происходящие в теле».
Биологическое окисление представляет собой совокупность реакций окисления, протекающих во всех живых клетках. Основной функцией этого процесса является обеспечение организма энергией в доступной для использования форме (прежде всего в форме АТФ).
Принципиальной особенностью биологического окисления, или тканевого дыхания, является то, что оно протекает постепенно, через многочисленные промежуточные ферментативные стадии, т. е. происходит многократная передача протонов и электронов или только электронов от одного соединения — донора к другому — акцептору; при этом протоны транспортируются лишь частью промежуточных переносчиков. У аэробов конечным акцептором электронов и протонов служит кислород.
В переносе электронов от субстратов к молекулярному кислороду принимают участие: 1) пиридинзависимые дегидрогеназы, для которых коферментами служат либо НАД, либо НАДФ; 2) флавинзависимые дегидрогеназы (флавиновые ферменты), у которых роль простетической группы играют ФАД или ФМН; 3) цитохромы, содержащие в качестве простетической группы железопорфириновую кольцевую систему. Среди компонентов дыхательной цепи обнаружены также убихинон (коэнзим Q) и белки, содержащие негемовое железо.
К числу пиридинзависимых дегидрогеназ относится большая группа ферментов, которые катализируют восстановление НАД+ и НАДФ+ различными органическими субстратами. Структура НАД была выяснена Г. Эйлер-Хельпиным и соавт. О. Варбургу принадлежит заслуга открытия НАДФ. Коферменты НАД и НАДФ являются динуклеотидами, в которых мононуклеотиды связаны между собой через остатки фосфорной кислоты. В состав одного из нуклеотидов входит амид никотиновой кислоты (витамин РР), другой представляет собой АМФ. В молекуле НАДФ имеется еще один остаток фосфорной кислоты, присоединенный к рибозе АМФ в положении 2'.

Рис. 3.
Катализируемые пиридинзависимыми дегидрогеназами реакции можно изобразить так:

Способность НАД+ и НАДФ+ играть роль промежуточного переносчика водорода связана с наличием в их структуре амида никотиновой кислоты. В электронно-протонной форме обратимое гидрирование — дегидрирование (присоединение и отдача протонов и электронов) этих коферментов может быть представлено с помощью следующего уравнения:

При переносе двух восстановительных эквивалентов от субстрата на НАД+ один из них включается в восстановленный кофермент в виде водорода, а другой — в виде электрона. Свободный ион Н+ остается в среде. Для простоты обозначения обычно восстановленные формы НАД и НАДФ изображают символами НАДН2 и НАДФН2.
Окисленные и восстановленные формы пиридиннуклеотидных коферментов обладают различными спектрами поглощения в УФ-области.
В окисленной форме НАД+ и НАДФ+ имеют одну узкую полосу поглощения с максимумом при 260 нм, зависящую от наличия аденина в его структуре. У восстановленной формы коферментов поглощение света в этой области понижается, и появляется вторая широкая полоса поглощения с максимумом при 340 нм, обусловленная исчезновением одной двойной связи в никотинамидном комплексе кофермента при его восстановлении.
Это свойство данных коферментов позволяет использовать спектрофотометрические методы анализа для быстрого количественного определения ряда субстратов — доноров водорода, а также исследования активности НАДи НАДФ-зависимых дегидрогеназ.
В клетках НАД-зависимые дегидрогеназы преимущественно участвуют в процессах, связанных с переносом электронов и протонов от органических субстратов к кислороду. В свою очередь НАДФ-зависимые дегидрогеназы играют существенную роль в реакциях биосинтеза (например, высших жирных кислот, стеринов и др.). В соответствии с этим коферменты НАД и НАДФ различаются по своей внутриклеточной локализации: НАД концентрируется главным образом в митохондриях, а большая часть НАДФ находится в цитоплазме (цитозоле) клеток.
Часть пиридинзависимых дегидрогеназ локализована в цитозоле клетки, а другая часть — в митохондриях. Некоторые дегидрогеназы присутствуют как в цитоплазме, так и в митохондриях клетки. Цитоплазматические дегидрогеназы способны взаимодействовать только с теми пиридиновыми нуклеотидами (коферментами), которые находятся в цитозоле. Митохондриальные дегидрогеназы обычно взаимодействуют только с пиридиновыми нуклеотидами, которые локализованы в матриксе митохондрий. Заметим, что цитозольный и митохондриальный пулы НАД и НАДФ отделены друг от друга митохондриальной мембраной, которая для этих коферментов непроницаема. Следующим акцептором атомов водорода является группа флавиновых ферментов, которые содержат в качестве кофермента (простетической группы) одно из двух производных витамина В2 (рибофлавина): флавинмононуклеотид (ФМН) или флавин-адениндинуклеотид (ФАД). ФМН и ФАД очень прочно, в отличие от коферментов НАД и НАДФ, присоединены к ферменту (точнее, к апоферменту) и не отщепляются от него ни на одной из стадий каталитического цикла.
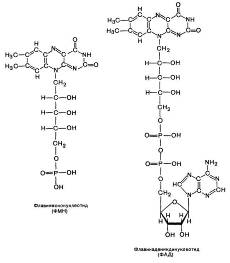
Рис. 4.
С точки зрения значимости катализируемых реакций особенно интересны два флавопротеина: НАДН2-дегидрогеназа и СДГ.
НАДН2-дегидрогеназа, или флавопротеин-1 (ФП1), содержит ФМН в качестве кофермента, который акцептирует водород, отщепляемый от НАДН2 или НАДФН2:
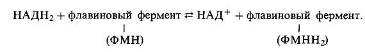
В некоторых случаях (например, при окислении сукцината или жирных кислот) флавиновые ферменты могут играть роль первичных дегидрогеназ, т. е. прямо, без участия НАД и НАДФ-зависимых дегидрогеназ, принимать электроны и протоны при окислении субстратов. Таким ферментом, в частности, является СДГ. Коферментом СДГ служит ФАД.
Впервые ФМН и ФАД были выделены Варбургом. Окисленные формы ФМН и ФАД обладают характерным спектром поглощения с максимумом при 450 нм; в окисленном состоянии флавиновые ферменты окрашены в красный, коричневый или зеленый цвет. При восстановлении ФАД и ФМН полоса 450 нм в спектре поглощения исчезает.
Активной частью молекулы ФАД или ФМН является изоаллоксазиновое кольцо рибофлавина, к атомам азота которого могут присоединяться два атома водорода, т. е. два электрона и два протона при соответствующей внутримолекулярной перегруппировке двойных связей (R — остальная часть молекулы соответствующего кофермента).

Рис. 5.
Многие из флавиновых дегидрогеназ являются сложными олигомерными образованиями. Установлено, что флавиновый фермент тесно связан с железосерным белком, участвующим в передаче электронов и протонов на кофермент Q. Железо-серные белки имеют небольшую молекулярную массу порядка 10 000 Да и содержат несколько атомов негемового железа. Эти атомы собраны в несколько групп, в которых они объединены с равным числом атомов серы.
Следующим компонентом дыхательной цепи является кофермент Q (KoQ), или убихинон. Этот кофермент впервые был описан Р. Мортоном в 1953 г., который показал, что данное соединение имеет повсеместное распространение в клетках, и назвал его убихиноном. Позже было установлено, что убихинон, подобно НАД и ФАД, может играть роль промежуточного переносчика водородных атомов, т. е. электронов и протонов.
KoQ является производным бензохинона с длинной боковой цепью, которая в большинстве тканей млекопитающих состоит из 10 изопреноидных единиц.
Восстановленная форма флавиновых ферментов в цепи дыхательных катализаторов передает атомы водорода (протоны и электроны) KoQ. Как всякий хинон, KoQ может существовать как в окисленной, так и восстановленной форме (R — изопреноидная боковая цепь).
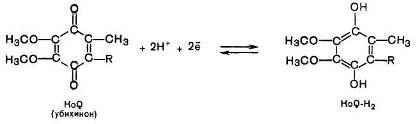
Рис. 6.
Дальнейший перенос электронов от K0QH2 на кислород осуществляет система цитохромов. Данная система состоит из ряда гемсодержащих белков (гемопротеи-нов), открытых в 1886 г. К. Мак-Мунном. Однако роль этих гемопротеинов в дыхании клеток была выяснена лишь в 1925 г. Д. Кейлином. В процессе тканевого дыхания наиболее важную роль играют цитохромы b, с1, с, aa3 Все они имеют простетическую геминовую группу, близкую к гему гемоглобина (простетическая группа цитохрома b, как считают, идентична гему).
В качестве примера можно привести структуру простетической группы цитохрома b.
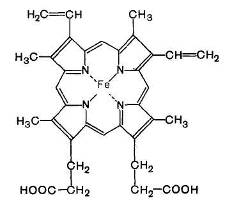
Рис. 7. Простетическая группа цитохрома Ь
Цитохромы отличаются друг от друга не только своими простетическими группами, но и белковыми компонентами. В ходе каталитического процесса валентность содержащегося в цитохромах железа обратимо изменяется (Fe2+Fe3+).
Все цитохромы, особенно в восстановленной форме, имеют характерные спектры поглощения. Величины окислительно-восстановительного потенциала у разных цитохромов также неодинаковы (табл. 2). Например, для цитохрома с окислительно-восстановительный потенциал составляет 0,25 В, а для цитохрома, а — 0,29 В. Система ½О2/Н2О имеет потенциал +0,82 В.
Таким образом, было выяснено, что звено цитохромов располагается в цепи окисления между убихиноном и кислородом; при этом цитохромы в цепь дыхательных катализаторов включаются в определенной последовательности:
Окислительно-восстановительные потенциалы (Щ) некоторых систем дыхательной цепи (концентрация всех компонентов 1 М, рН 7 и температура 25 °С).
Таблица 2.

Цитохромы b, с1 и с выполняют функцию промежуточных переносчиков электронов, а цитохром аа3 (цитохромоксидаза) является терминальным дыхательным ферментом, непосредственно взаимодействующим с кислородом. Окисленная форма цитохромоксидазы (Fe3+) принимает электроны от восстановленного цитохрома с, переходя в восстановленную форму (Fe2+), которая затем вновь окисляется в Fe3± форму молекулярным кислородом. Образовавшийся «активный» кислород присоединяет два протона из окружающей среды, в результате чего и образуется молекула воды.
В последнее время установлено, что цитохромоксидаза состоит из 6 субъединиц; каждая из них содержит геминовую группу и атом меди. По-видимому, две субъединицы из шести составляют цитохром а, а остальные четыре относятся к цитохрому а3.
Обычно считается, что на участке между НАД и KoQ осуществляется двухэлек-тронный перенос, а на участке между цитохромом b и кислородом — одноэлектронный (следовательно, на каждом этапе дыхательной цепи должны участвовать по два цитохрома); тем не менее нельзя исключить и другие возможности. Учитывая, что любой компонент дыхательной цепи может восстанавливать редокс-системы только с более высоким потенциалом, а окислять — с более низким (табл. 2), то в целом цепь дыхательных катализаторов может быть представлена следующим образом (рис. 2).
Как уже отмечалось, иногда цепь биологического окисления (дыхательная цепь) может быть укорочена. Имеются флавиновые ферменты, например СДГ, которые способны отнимать водород непосредственно от субстрата и передавать его сразу на KoQ.
В ряде случаев дыхательная цепь может иметь еще более простое строение. Так, например, оксидазы Lи D-аминокислот (за исключением глутаматдегидроге-назы), ксантиноксидаза и некоторые другие ферменты катализируют окисление соответствующих субстратов за счет кислорода без участия как НАД или НАДФ, так и цитохромов. Эти оксидазы по своей химической природе являются флавопротеинами.
Все ферменты тканевого дыхания — компоненты цепи дыхательных катализаторов, как установлено, связаны главным образом с митохондриями, точнее с их внутренними мембранами. Никотинамидадениндинуклеотидные коферменты и некоторые ферменты цикла трикарбоновых кислот находятся в матриксе митохондрий, тогда как металлофлавопротеины, убихинон и цитохромы связаны с липидными структурами внутренней мембраны.

Рис. 8. Организация компонентов дыхательной цепи митохондрий (схема)
Митохондрии содержатся в цитоплазме клетки и представляют собой микроскопические палочковидные или иной формы образования, количество которых в одной клетке составляет сотни или тысячи (например, в одной клетке печени крысы содержится около 1000 митохондрий) Для одного и того же типа клеток число митохондрий более или менее постоянно Однако следует помнить, что количество митохондрий может меняться в зависимости от стадии развития клетки и ее функциональной активности.
Что же представляют собой митохондрии? Внутреннее пространство митохондрий окружено двумя непрерывными мембранами (рис. 9), причем наружная мембрана гладкая, а внутренняя образует многочисленные складки, или кристы. Внутримитохондриальное пространство, ограниченное внутренней мембраной, заполнено так называемым матриксом, который примерно на 50% состоит из белка и имеет очень тонкую структуру. Размер митохондрий чаще равен 2 — 3 мкм в длину и около 1 мкм в ширину, однако удлиненную форму митохондрий не следует считать универсальной. В некоторых тканях, например в поперечнополосатых мышцах, митохондрии иногда принимают самые причудливые очертания.
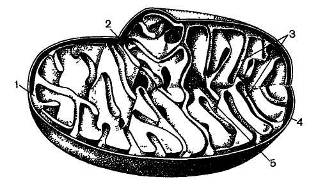
Рис. 9. Строение митохондрии (по Богену): 1 — внутренняя мембрана, 2 — пространство между двумя мембранами, 3 — кристы, 4 — наружная мембрана 5 — митохондриальный матрикс
В митохондриях сосредоточено большое количество ферментов Наружная мембрана не содержит ни одного из компонентов цепи дыхательных катализаторов С наружной мембраной связаны ферменты, участвующие в удлинении молекул насыщенных жирных кислот, имеющих от 12 до 16 атомов углерода Кроме того, в наружной мембране имеются кинуренингидроксилаза, моноаминоксидаза и некоторые другие ферменты Моноаминоксидаза может служить маркерным ферментом для обнаружения наружной мембраны митохондрий Следует заметить, что некоторые ферменты наружной мембраны митохондрий напоминают ферменты мембран эндоплазматической сети Исходя из ферментного набора наружной мембраны, пока трудно ответить на вопрос, в чем состоит ее назначение Возможно, что наружная мембрана играет роль перегородки, отделяющей внутреннюю, рабочую часть митохондрии от всего остального пространства клетки.
В межмембранном пространстве митохондрий обнаруживается активность аденилаткиназы (миокиназы) и нуклеозиддифосфаткиназы Как уже отмечалось, во внутренней мембране митохондрий находятся ферменты дыхательной цепи Там же находятся СДГ, (в-оксибутиратдегидрогеназа, карнитинацилтрансфераза и ряд других ферментов Важно отметить, что расположение СДГ в непосредственной близости от других компонентов дыхательной цепи объясняет тот факт, что сукцинат окисляется в митохондриях намного быстрее, чем другие субстраты цикла трикарбоновых кислот Маркерным ферментом для идентификации внутренней мембраны митохондрий служит цитохромоксидаза.
В матриксе митохондрий содержатся некоторые ферменты цикла Кребса (цитрат-синтаза, изоцитратдегидрогеназа, фумараза, малатдегидрогеназа, аконитаза), ферменты, участвующие в в-окислении жирных кислот и системе мочевины, АсАТ, глутаматдегидрогеназа, фосфоенот-пируваткарбоксикиназа и др Определение глутаматдегидрогеназы и малатдегидрогеназы часто используют для идентификации матрикса митохондрий.
Стрелками показаны субстраты — доноры водорода и участки (1, 2, 3), в которых перенос электронов блокируется специфическими ингибиторами, а также места, в которых предположительно происходит синтез АТФ.
Чрезвычайно важной функцией цепи дыхательных катализаторов, связанных с внутренней мембраной митохондрий, наряду с переносом электронов от субстратов дыхания на кислород, является аккумуляция части освобождающейся энергии (около 50%) в фосфатных связах высокоэргических (или макроэргических) соединений (главным образом АТФ).
Процесс сопряжения тканевого дыхания и фосфорилирования получил название окислительного фосфорилирования. Впервые в начале 30-х годов В. А. Энгельгардт высказал предположение о наличии сопряжения между фосфорилированием АДФ и аэробным дыханием. Позже, в 1940 г., В. А. Белицер и Е. Т. Цыбакова показали, что синтез АТФ из АДФ и Н3РО4 осуществляется в митохондриях при миграции электронов от субстрата к кислороду через цепь дыхательных катализаторов. При этом было обнаружено, что отношение Р/О, т. е. число молекул неорганического фосфата, перешедших в органическую форму (АТФ), в расчете на каждый поглощенный атом кислорода близко к 3.
Установлено, что уменьшение свободной энергии системы при переносе пары электронных эквивалентов от НАДН2 к молекулярному кислороду составляет 220 кДж (52,7 ккал). В свою очередь величина стандартной свободной энергии образования АТФ из АДФ и Н3РО4 (АДФ + Н3РО4 > АТФ + Н2О) находится в пределах 30,2 кДж, или 7,3 ккал (по-видимому, в условиях in vivo эта величина порядка 34,5 кДж). Следовательно, уменьшение свободной энергии при переносе одной пары электронов от НАДН2 к кислороду способно обеспечить синтез нескольких молекул АТФ из АДФ и фосфата.
На основании данных термодинамики была предсказана локализация трех пунктов фосфорилирования (образование 3 молекул АТФ) в дыхательной цепи (рис. 10). Опыты с применением ингибиторов (ротенон, амитал, анти-мицин А, цианид) ферментов дыхательной цепи подтвердили это предположение. При переносе электронов от ФАДН2 по укороченному пути образуются только 2 молекулы АТФ. Известно, что интенсивность дыхания управляется отношением АТФ/АДФ. Чем меньше это отношение, тем интенсивнее идет дыхание, обеспечивая выработку АТФ. Изменение скорости дыхания с изменением концентрации АДФ носит название дыхательного контроля.
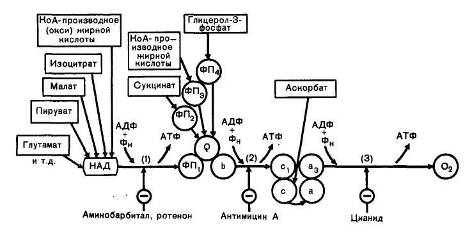
Рис. 10. Локализация трех пунктов фосфорилирования в дыхательной цепи
Окончательно детали механизма сопряжения важнейших биоэнергетических процессов в митохондриях — дыхания и фосфорилирования — до сих пор не выяснены. Однако за последние два десятилетия достигнут большой прогресс в понимании основных принципов биоэнергетики клетки, связанной с хемиосмотическим синтезом АТФ в биомембранах.
Хемиосмотическая теория разработана в 1961 — 1966 гг. Митчеллом. Следует отметить, что экспериментальное обоснование и дальнейшее развитие этой теории во многом обязаны исследованиям В. П. Скулачева и др. Суть этой теории состоит в предположении, что дыхание и фосфорилирование связаны между собой через электрохимический потенциал ионов водорода на митохондриальной мембране (ДµH+).
Принято считать, что компоненты дыхательной цепи, соответствующим образом расположенные в плоскости мембраны, присоединяя электрон, могут «захватывать» также ион Н+ из матрикса и соответственно, отдавая (передавая) электрон, способны освобождать ион Н+ в водное пространство, окружающее мембрану (в межмембранное пространство). На каждую пару электронов, переносимую вдоль дыхательной цепи от НАДН2 к кислороду, приходятся три пары ионов Н+, извлекаемых из матрикса и передаваемых в наружную среду (рис. 11). При этом наружная поверхность внутренней мембраны митохондрий приобретает положительный заряд, а внутренняя — отрицательный. Иными словами, между водными фазами, которые разделены внутренней мембраной, создается градиент концентрации ионов Н+ с более кислым значением рН снаружи.
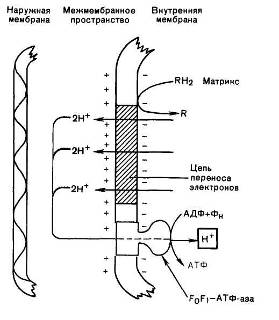
Рис. 11. Механизм образования АТФ согласно хемиосмотической гипотезе: R — субстраты — доноры водорода
Согласно хемиосмотической теории ионы Н+, выведенные наружу за счет энергии переноса электронов, снова устремляются внутрь, т. е. в митохондриальный матрикс, через каналы, или «поры», специального мембранного белка (F0), который соединен с F+.
— АТФ-синтетазой (или обратимой АТФазой). Этот переход ионов Н+ из зоны с более высокой в зону с более низкой их концентрацией сопровождается выделением свободной энергии, за счет которой образуется ДµH+ и синтезируется АТФ (см. рис. 11).
Таким образом, можно предполагать, что тканевое дыхание заряжает митохондриальную мембрану, а окислительное фосфорилирование разряжает ее, используя энергию мембранного потенциала для синтеза АТФ. Таким образом, при переносе одной пары электронов от НАДН2 к кислороду образуются 3 молекулы АТФ, а от ФАДН2 — 2 молекулы АТФ.
В современной теории биологического окисления и сопряженного с ним фосфорилирования имеется еще ряд пробелов и вопросов, требующих дальнейшего разрешения. В частности, недостаточно ясен механизм, с помощью которого цепь переноса электронов «откачивает» ионы Н+ из матрикса митохондрий наружу.
Биологическое окисление может быть не связано (разобщено) с фосфорилированием и соответственно накоплением макроэргов. Это так называемое свободное, или нефосфорилирующее, окисление; освобождающаяся при этом энергия рассеивается в виде теплоты. Следует помнить, что существует ряд соединений, способных разобщать дыхание и фосфорилирование, например динитрофенол, дикумарин, тироксин и др.
Микросомальное окисление осуществляется ферментными системами, локализованными преимущественно во фракциях микросом печени и надпочечников. В отличие от митохондриального окисления, где ведущую роль, как было показано выше, играют реакции дегидрирования, а кислород является конечным акцептором электронов и используется лишь для образования воды, в процессах микросомального окисления активированный кислород непосредственно внедряется в окисляемое вещество. При этом функциональная роль митохондриального и микросомального окисления в клетке различна. Митохондриальное окисление — механизм использования кислорода в биоэнергетических процессах. Микросомальное окисление — механизм использования кислорода с «пластическими» целями.
Ферментные системы, локализованные в микросомной фракции и способные использовать молекулярный кислород для окисления специфических органических соединений, делятся на две группы: диоксигеназы и монооксигеназы. Диоксигеназы катализируют реакции, в которых в молекулу органического субстрата включаются оба атома молекулы кислорода. А + О2 > АО2. Монооксигеназы (эту группу ферментов называют также гидроксилазами, их содержание в тканях относительно велико) присоединяют к субстрату только один из двух атомов кислорода. Обычно поставщиком атомов водорода для восстановления второго атома кислорода до воды служит НАДФН2 (реже НАДН2). Например:

Микросомальная цепь ферментов, осуществляющая гидроксилирование, в значительной мере изучена. Она содержит: цитохром Р-450, восстановленный СО-комплекс которого имеет максимум поглощения при длине волны 450 нм; флавопротеин, коферментом которого служит ФАД; белок (адренодоксин), содержащий негемовое железо.
Необходимо еще раз подчеркнуть, что основная роль этой цепи заключается в гидроксилировании. а не в окислительном фосфорилировании. Поэтому флавопротеины и цитохромы, которые функционируют в микросомальной цепи окисления, резко отличаются от ферментов митохондриальной дыхательной цепи. В общей форме цепь переноса электронов в микросомах, при участии которой осуществляется гидроксилирование, представлена на рис. 12. Электроны НАДФН2, обладающие высоким энергетическим потенциалом, переносятся на флавопротеин этой цепи; затем они передаются на адренодоксин (белок, содержащий негемовое железо); последний переносит электроны на окисленную форму цитохрома Р-450; после чего восстановленная форма Р-450 активирует кислород. Считается, что цитохром Р-450 выполняет двоякую функцию. Во-первых, он связывает субстрат гидроксилирования, во-вторых, на нем происходит активация молекулярного кислорода.

Рис. 12. Схематическое изображение монооксигеназной цепи микросом: ФЛП — флавопротеин, кофактором которого служит ФАД, Fe-белок — белок, содержащий негемовое железо, RH — субстрат окисления, Р450 — цитохром Р450
К числу эндогенных субстратов микросомального окисления следует отнести стероидные гормоны и холестерин, а также, по-видимому, ненасыщенные жирные кислоты. В последнее время появились указания на возможную роль реакций микросомального окисления в биосинтезе простагландинов. Велико значение микросомального окисления в метаболизме лекарственных средств и ряда токсичных соединений.
Иногда ошибочно считают, что монооксигеназная цепь микросом печени предназначена для окисления только ксенобиотиков. На самом же деле она служит универсальной биологической системой окисления неполярных соединений любого происхождения. Субстрат, окисляемый цитохромом Р-450, должен отвечать одному требованию — быть неполярным, т. е. в данном случае проявляется специфичность не к структуре, а к физико-химическим свойствам субстрата.
В настоящее время известно свыше 7000 соединений, способных окисляться при участии монооксигеназной цепи. При этом гидроксилирование делает вещество более полярным. В результате то или иное потенциально токсичное соединение легче растворяется в водной среде, подвергается дальнейшим превращениям и выводится из организма. К сожалению, иногда бывает наоборот, например, монооксигеназная цепь, окисляя нетоксичный бензпирен (содержащийся в табачном дыму, копченостях), приводит к образованию токсичного оксибензпирена, являющегося сильным канцерогеном.
- 2. Основные физиологические эффекты действия: а) простагландины; б) кортизола; в) адреналина; г) инсулина
- а) простагландины.
Термин «простагландины» был введен У. Эйлером, впервые показавшим, что в сперме человека и экстрактах из семенных пузырьков барана содержатся вещества, оказывающие выраженное вазопрессорное действие и вызывающие сокращение гладкой мускулатуры матки. Хотя предположение У. Эйлера о том, что эти вещества являются специфическим секретом предстательной железы (prostata) в дальнейшем не подтвердилось, поскольку, как теперь установлено, они обнаружены во всех органах и тканях, тем не менее этот термин в литературе сохранился (синоним — простатогландины).
В последнее десятилетие простагландины и родственные им биологически активные соединения (лейкотриены, простациклины, тромбоксаны) были предметом пристального внимания исследователей. Объясняется это тем, что, помимо широкого распространения в тканях, они оказывают сильное фармакологическое действие на множество физиологических функций организма, регулируя гемодинамику почек, сократительную функцию гладкой мускулатуры, секреторную функцию желудка, жировой, водно-солевой обмен и др. Имеются данные, свидетельствующие, что простагландины, вероятно, не являются «истинными» гормонами, но модулируют действие гормонов; биологические эффекты простагландинов, по-видимому, опосредованы через циклические нуклеотиды.
В последнее время были подтверждены представления С. Бергстрёма и сотр., что предшественником всех простагландинов являются полиненасыщенные жирные кислоты, в частности арахидоновая кислота (и ряд ее производных, дигомо-г-линоленовая и пентаноевая кислоты, в свою очередь образующиеся в организме из линолевой и линоленовой кислот). Арахидоновая кислота после освобождения из фосфоглицеридов (фосфолипидов) биомембран, в зависимости от ферментативного пути превращения, дает начало простагландинам и лейкотриенам по схеме:
Первый путь получил наименование циклооксигеназного пути превращения арахидоновой кислоты, поскольку первые стадии синтеза простагландинов катализируются циклооксигеназой, точнее простагландинсинтазой (КФ 1.14.99.1). Известные к настоящему времени данные о биосинтезе основных простаноидов обобщены в рис. 13. Видно, что центральным химическим процессом биосинтеза является включение молекулярного кислорода (двух молекул) в структуру арахидоновой кислоты, осуществляемое специфическими оксигеназами, которые, помимо окисления, катализируют и циклизацию с образованием промежуточных продуктов простагландинэндоперекисей PG2[H2], обозначаемых PGG2 и PGH2; последние под действием простагландин-изомераз превращаются в первичные простагландины. Видно также, что простациклины и тромбоксаны синтезируются из указанных промежуточных продуктов при участии отличных от изомераз ферментов. Детали механизма биосинтеза простаноидов пока до конца не выяснены, как и пути их окисления до конечных продуктов обмена.
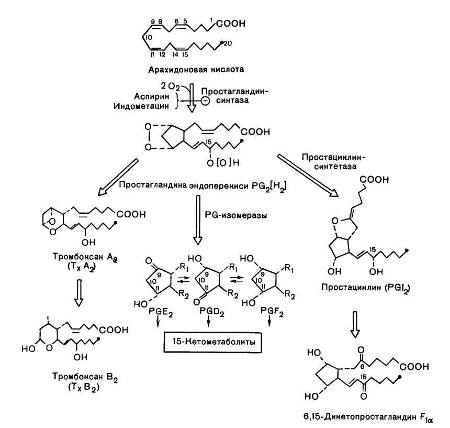
Рис. 13. Циклооксигеназный путь превращения арахидоновой кислоты. R1 и R2 — боковые цепи, идентичные для всех трех простагландинов. Знаком «—» обозначено блокирующее действие указанных веществ
катаболический митохондрия циклооксигеназный Первичные простагландины синтезируются во всех клетках (за исключением эритроцитов), действуют на гладкую мускулатуру желудочно-кишечного тракта, репродуктивной и респираторной тканей, а также сосудов, модулируют активность других гормонов, автономно регулируют нервное возбуждение, процессы воспаления (медиаторы), скорость почечного кровотока; действие их опосредовано через цАМФ и цГМФ.
Тромбоксан, А синтезируется преимущественно в ткани мозга, селезенки, легких, почек, а также в тромбоцитах и воспалительной гранулеме; он вызывает агрегацию тромбоцитов, способствуя, тем самым, тромбообразованию и, кроме того, оказывает самое мощное сосудосуживающее действие среди всех простагландинов.
Простациклин (PGI2) преимущественно синтезируется в эндотелии сосудов, сердечной мышце, ткани матки и слизистой оболочке желудка. Он расслабляет, в противоположность тромбоксану, гладкую мускулатуру сосудов и вызывает дезагрегацию тромбоцитов, способствуя фибринолизу.
Следует отметить особое значение соотношения тромбоксаны: простациклины, в частности ТхА2: PGI2 для физиологического статуса организма. Оказалось, что у больных, предрасположенных к тромбозам, имеется тенденция к смещению баланса в сторону агрегации; у больных, страдающих уремией, напротив, наблюдается дезагрегация тромбоцитов.
Выдвинуто предположение о важности соотношения ТхА2: PGI2 для регуляции функции тромбоцитов in vivo, сердечно-сосудистого гомеостаза и т. д.
На приведенном рис. 13 представлены также пути катаболизма простаноидов. Начальной стадией катаболизма «классических» простагландинов является стереоспе-цифическое окисление ОН-группы у 15-го углеродного атома с образованием соответствующего 15-кетопроизводного. Фермент, катализирующий эту реакцию, 15-оксипростагландиндегидрогеназа открыт в цитоплазме, требует наличия НАД или НАДФ. Тромбоксан инактивируется in vivo или путем химического расщепления до тромбоксана В2 или путем окисления дегидрогеназой или редуктазой. Аналогично PGI2 (простациклин) быстро распадается до 6-KeTO-PGF1б1 in vitro, a in vivo инактивируется окислением 15-оксипростагландиндегидрогеназой с образованием 6,15-дикето-PGFб1.
Второй путь превращения арахидоновой кислоты — липооксигеназный путь (рис. 8) — дает начало синтезу еще одного класса биологически активных веществ — лейкотриенов. Особенности структуры лейкотриенов заключаются в том, что хотя они и содержат 20 углеродных атомов (как и простаноиды), однако у них отсутствует циклическая структура, все они содержат по четыре двойных связи и, наконец, некоторые из них образуют пептидолипидные комплексы с глутатионом или с его составными частями (лейкотриен D может далее превращаться в лейкотриен Е, теряя остаток глицина). Основные биологические эффекты лейкотриенов связаны с воспалительными процессами, аллергическими и иммунными реакциями, анафилаксией и деятельностью гладких мышц. В частности, лейкотриены способствуют сокращению гладкой мускулатуры дыхательных путей, желудочно-кишечного тракта, регулируют тонус сосудов, обладая сосудосуживающим действием, и стимулируют сокращение коронарных артерий. Катаболические пути лейкотриенов окончательно не установлены.
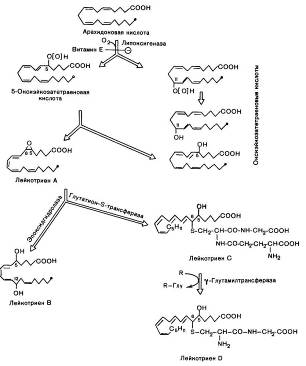
Рис. 14. Липооксигеназный путь превращения арахидоновой кислоты. R — акцептор остатка глутаминовой кислоты. Знаком «—» обозначено блокирующее действие витамина Е
Таким образом, благодаря своему широкому распространению и высокой и разносторонней биологической активности простагландины (и вообще простаноиды) и лейкотриены находят все возрастающее применение в качестве лекарственных препаратов в медицинской практике. Эти обстоятельства стимулируют проведение дальнейших исследований как по пути поиска новых простаноидов, так и по пути химического синтеза их аналогов с защищенными функциональными группами, более стабильных при введении в организм.
б) кортизол.
Кортизол (17-гидрокортизон, соединение F) — является наиболее биологически активным глюкокортикоидным гормоном.
Кортизол — гормон стероидной природы, то есть в своей структуре имеет стерановое ядро (циклопентанпергидрофенантреновое). Кортизол секретируется наружным слоем (корой) надпочечников под воздействием адренокортикотропного гормона (АКТГ). Секреция АКТГ, в свою очередь, стимулируется кортиколиберином — релизинг-фактором гипоталамуса. Кортизол является регулятором углеводного обмена организма, а также принимает участие в развитии стресс-реакций. Для кортизола характерен суточный ритм секреции: максимальная концентрация отмечается в утренние часы (6−8 часов утра), минимальная концентрация в вечерние часы (20−21 час).
Все стероидные гормоны имеют в своей основе одинаковую структуру, состоящую из 17 атомов углерода, объединенных в четыре кольца, которые обозначаются буквами A, B, C и D. К кольцам в качестве боковых цепей присоединены дополнительные атомы углерода. Чтобы различать атомы углерода, составляющие скелет молекулы, им присвоены порядковые номера начиная с 1 в кольце, А (см. рисунок 15).

Рис. 15. Стероидные гормоны
Выделившийся в кровь кортизол достигает клеток-мишеней (в частности, клеток печени). Благодаря своей липофильной природе легко проникает через клеточную мембрану в цитоплазму, где связывается со специфическими рецепторами. Гормон-рецепторный комплекс является транскрипционным фактором, то есть активирует транскрипцию определенных участков ДНК. В результате синтез глюкозы в гепатоцитах усиливается, тогда как в мышцах снижается распад глюкозы. В клетках печени глюкоза запасается в виде гликогена.
Таким образом, эффект кортизола состоит в сохранении энергетических ресурсов организма. По принципу негативной обратной регуляции повышение уровня кортизола в крови снижает секрецию кортиколиберина (а значит, и АКТГ).
в) адреналин.
Адреналин (L-1(3,4-Диоксифенил)-2-метиламиноэтанол) — основной гормон мозгового вещества надпочечников. По химическому строению адреналин является катехоламином. Адреналин содержится в разных органах и тканях, в значительных количествах образуется в хромаффинной ткани, особенно в мозговом веществе надпочечников. Синоним: эпинефрин.
Действие адреналина связано с влиянием на би в-адренорецепторы и во многом совпадает с эффектами возбуждения симпатических нервных волокон. Адреналин участвует в реализации реакций типа «бей или беги», его секреция резко повышается при стрессовых состояниях, пограничных ситуациях, ощущении опасности, при тревоге, страхе, при травмах, ожогах и шоковых состояниях. Он вызывает сужение сосудов органов брюшной полости, кожи и слизистых оболочек; в меньшей степени сужает сосуды скелетной мускулатуры. Артериальное давление под действием адреналина повышается. Однако прессорный эффект адреналина в связи с возбуждением в-адренорецепторов менее постоянен, чем эффект норадреналина. Изменения сердечной деятельности носят сложный характер: стимулируя адренорецепторы сердца, адреналин способствует значительному усилению и учащению сердечных сокращений; одновременно, однако, в связи с рефлекторными изменениями из-за повышения артериального давления происходит возбуждение центра блуждающих нервов, оказывающих на сердце тормозящее влияние; в результате этого сердечная деятельность может замедляться. Могут возникать аритмии сердца, особенно в условиях гипоксии.

Рис. 16. Структурная формула адреналина
Адреналин вызывает расслабление гладкой мускулатуры бронхов и кишечника, расширение зрачков (вследствие сокращения радиальных мышц радужной оболочки, имеющих адренергическую иннервацию).
Под влиянием адреналина происходит повышение содержания глюкозы в крови и усиление тканевого обмена. Адреналин усиливает глюконеогенез и гликогенолиз, тормозит синтез гликогена в печени и скелетных мышцах, усиливает захват и утилизацию глюкозы тканями, повышая активность гликолитических ферментов. Также адреналин усиливает липолиз (распад жиров) и тормозит синтез жиров. В высоких концентрациях адреналин усиливает катаболизм белков.
Имитируя эффекты стимуляции «трофических» симпатических нервных волокон, адреналин в умеренных концентрациях, не оказывающих чрезмерного катаболического воздействия, оказывает трофическое действие на миокард и скелетные мышцы. При продолжительном воздействии умеренных концентраций адреналина отмечается увеличение размеров (функциональная гипертрофия) миокарда и скелетных мышц. Предположительно этот эффект является одним из механизмов адаптации организма к длительному хроническому стрессу и повышенным физическим нагрузкам. Вместе с тем длительное воздействие высоких концентраций адреналина приводит к усиленному белковому катаболизму, уменьшению мышечной массы и силы, похуданию и истощению. Это объясняет исхудание и истощение при дистрессе (стрессе, превышающем адаптационные возможности организма).
Адреналин улучшает функциональную способность скелетных мышц (особенно при утомлении). Его действие сходно в этом отношении с эффектом возбуждения симпатических нервных волокон.
Адреналин оказывает стимулирующее воздействие на ЦНС, хотя и слабо проникает через гемато-энцефалический барьер. Он повышает уровень бодрствования, психическую энергию и активность, вызывает психическую мобилизацию, реакцию ориентировки и ощущение тревоги, беспокойства или напряжения, гегенируется при пограничных ситуациях.
Адреналин также оказывает выраженное противоаллергическое и противовоспалительное действие, тормозит высвобождение гистамина, серотонина, кининов и других медиаторов аллергии и воспаления из тучных клеток, понижает чувствительность тканей к этим веществам. Адреналин вызывает повышение числа лейкоцитов в крови, частично за счёт выхода лейкоцитов из депо в селезёнке, частично за счёт перераспределения форменных элементов крови при спазме сосудов, частично за счёт выхода не полностью зрелых лейкоцитов из костномозгового депо. Одним из физиологических механизмов ограничения воспалительных и аллергических реакций является повышение секреции адреналина мозговым слоем надпочечников, происходящее при многих острых инфекциях, воспалительных процессах, аллергических реакциях.
Также адреналин вызывает повышение числа и функциональной активности тромбоцитов, что, наряду со спазмом мелких капилляров, обуславливает гемостатическое (кровоостанавливающее) действие адреналина. Одним из физиологических механизмов, способствующих гемостазу, является повышение концентрации адреналина в крови при кровопотере.
г) инсулин.
Инсулин, получивший свое название от наименования панкреатических островков (лат. insula — остров), был первым белком, первичная структура которого была раскрыта в 1954 г. Ф. Сэнгером. В чистом виде инсулин был получен в 1922 г. после его обнаружения в экстрактах панкреатических островков Ф. Бантингом и Ч. Бестом. Молекула инсулина, содержащая 51 аминокислоту, состоит из двух полипептидных цепей, соединенных между собой в двух точках дисульфидными мостиками. В настоящее время принято обозначать цепью, А инсулина 21-членный пептид и цепью В — пептид, содержащий 30 остатков аминокислот. Во многих лабораториях осуществлен, кроме того, химический синтез инсулина. Наиболее близким по своей структуре к инсулину человека является инсулин свиньи, у которого в цепи В вместо треонина в положении 30 содержится аланин; существенных различий в аминокислотной последовательности в инсулине разных животных не имеется; различия между ними связаны с аминокислотным составом цепи, А в положениях — 8−10.
Согласно современным представлениям биосинтез инсулина осуществляется в Р-клетках панкреатических островков из своего предшественника — проинсулина, впервые выделенного Д. Стайнером в 1966 г. В настоящее время не только выяснена первичная структура проинсулина, но и осуществлен его химический синтез. Проинсулин представлен одной полипептидной цепью, содержащей 84 аминокислотных остатка; он лишен биологической, т. е. гормональной активности. Местом синтеза проинсулина считается фракция микросом Р-клеток панкреатических островков; превращение неактивного проинсулина в активный инсулин (наиболее существенная часть синтеза) происходит при перемещении проинсулина от рибосом к секреторным гранулам путем частичного протеолиза (отщепление с С-конца полипептидной цепи пептида, содержащего 33 аминокислотных остатка и получившего наименование соединяющего пептида, или С-пептида). Укажем также, что первичная структура С-пептида подвержена большим изменениям у разных видов животных, чем последовательность цепей, А и В инсулина. Установлено, что исходным предшественником инсулина является препроинсулин, содержащий, помимо проинсулина, его так называемую лидерную или сигнальную последовательность на N-конце, состоящую из 23 остатков аминокислот; при образовании молекулы проинсулина тот сигнальный пептид отщепляется специальной пептидазой. Однако природа фермента и тонкие механизмы этого важного биологического процесса — образование активной молекулы инсулина — окончательно не выяснены.
Синтезированный из проинсулина инсулин может существовать в нескольких формах, отличающихся по биологическим, иммунологическим и физико-химическим свойствам. Различают две формы инсулина: 1) свободную, вступающую во взаимодействие с антителами, полученными к кристаллическому инсулину, и стимулирующую усвоение глюкозы мышечной и жировой тканями, 2) связанную, не реагирующую с антителами и активную только в отношении жировой ткани. В настоящее время доказано существование связанной формы инсулина и установлена локализация ее в белковых фракциях сыворотки крови, в частности в области трансферринов и а-глобулинов. Молекулярная масса связанного инсулина варьирует от 60 000 до 100 000 Да. Различают, кроме того, так называемую форму, А инсулина, отличающуюся от двух предыдущих по ряду физико-химических и биологических свойств, занимающую промежуточное положение и появляющуюся в ответ на быструю, срочную потребность организма в инсулине.
В физиологической регуляции синтеза инсулина доминирующую роль играет концентрация глюкозы в крови. Так, повышение содержания глюкозы в крови вызывает увеличение секреции инсулина в панкреатических островках; снижение концентрации глюкозы в крови, наоборот, вызывает замедление секреции инсулина. Этот феномен контроля по типу обратной связи рассматривается как один из важнейших механизмов регуляции содержания глюкозы в крови. На секрецию инсулина оказывают влияние, кроме того, электролиты (особенно ионы кальция), аминокислоты, глюкагон и секретин. Приводятся доказательства роли циклазной системы в секреции инсулина; предполагается, что глюкоза действует в качестве сигнала для активирования аденилатциклазы, а образовавшийся в этой системе цАМФ — в качестве сигнала для секреции инсулина.
При недостаточной секреции (точнее недостаточном синтезе) инсулина развивается специфическое заболевание, известное под названием сахарный диабет Помимо клинически выявляемых симптомов (полиурия, полидипсия и полифагия), сахарный диабет характеризуется рядом специфических нарушений процессов обмена. Так, у больных развиваются гипергликемия (увеличение глюкозы в крови) и глюкозурия (выделение глюкозы с мочой, в которой в норме она отсутствует). К расстройствам обмена относят также усиленный распад гликогена в печени и мышцах, замедление биосинтеза белков и жиров, снижение скорости окисления глюкозы в тканях, развитие отрицательного азотистого баланса, увеличение содержания холестерина и других липидов в крови. При диабете усиливаются мобилизация жиров из депо, синтез углеводов из аминокислот (глюконеогенез) и избыточный синтез кетоновых тел (кетонурия). После введения больным инсулина все перечисленные нарушения, как правило, исчезают, однако действие гормона ограничено во времени, поэтому необходимо вводить его постоянно. Клинические симптомы и метаболические нарушения при сахарном диабете могут быть объяснены не только отсутствием синтеза инсулина; получены доказательства, что при сахарном диабете могут иметь место и молекулярные дефекты. В частности, нарушение структуры инсулина или нарушение ферментативного превращения проинсулина в инсулин В основе развития диабета часто лежит потеря рецепторами клеток-мишеней способности соединяться с молекулой инсулина, синтез которого не нарушен.
У экспериментальных животных введение инсулина вызывает гипогликемию (снижение уровня глюкозы в крови), увеличение запасов гликогена в мышцах, усиление анаболических процессов, повышение скорости утилизации глюкозы в тканях. Кроме того, инсулин оказывает опосредованное влияние на водный и минеральный обмены.
Механизм действия инсулина окончательно не расшифрован, несмотря на огромное количество фактических данных, свидетельствующих о зависимости между инсулином и процессами обмена веществ в организме. В соответствии с «унитарной» теорией все эффекты инсулина вызваны его влиянием на обмен глюкозы через фермент гексокиназу, однако новые экспериментальные данные свидетельствуют, что усиление и стимуляция инсулином таких процессов, как транспорт ионов и аминокислот, синтез белка и других, являются независимыми. Это послужило основанием для предположения о множественных механизмах действия инсулина. Наиболее вероятной в настоящее время представляется мембранная локализация первичного действия почти всех белковых i ормонов, включая инсулин. Получены доказательства существования специфического рецептора инсулина на внешней плазматической мембране жировых клеток, а также образование инсулин-рецепторного комплекса; в последнем процессе участвует сиаловая кислота. Показано, что рецептор инсулина является гликопротеином с молекулярной массой порядка 135 000 Да. Дальнейшие пути передачи информации от инсулин-рецепторного комплекса на внутриклеточные процессы окончательно не установлены. Предполагается, что в жировых клетках и частично клетках печени в передаче инсулинового сигнала принимают участие аденилат-циклаза и соответственно цАМФ, а в мышцах передача гормонального сигнала осуществляется без у частия цАМФ, поскольку инсулин легко проникает внутрь клеток мышечной ткани. Нельзя исключить, кроме того, возможности существования внутриклеточного посредника действия инсулина, особого внутриклеточного рецептора и действия подобного инсулин-рецепторного комплекса на уровне генома. В появлении эффектов инсулина и соответственно передаче его гормональных сигналов важную роль играет, кроме того, Na-K-зависимая АТФаза, активность которой также регулируется инсулином; в результате возникает конкуренция между АТФазой и аденилатциклазой за общий субстрат — АТФ и дополнительный канал регуляции концентрации цАМФ в клетке. Количество цАМФ контролируется, кроме того, фосфодиэстеразой, активность которой также определяется инсулином.