Химическая кинетика и равновесие

Если внешнее воздействие на систему проявляется в уменьшении концентрации одного из веществ, участвующих в реакции, то это смещает равновесие в сторону его образования. Наоборот, при увеличении концентрации одного из веществ равновесие смещается в сторону той реакции, которая ее уменьшает. Если концентрации реагирующих веществ равны единице, то, то есть константа скорости численно равна скорости… Читать ещё >
Химическая кинетика и равновесие (реферат, курсовая, диплом, контрольная)
I. Значение темы Знание и понятие законов химической кинетики необходимо для понимания механизмов реакций, протекающих в живом организме. Скорости биохимических реакций сбалансированы, за счет чего обеспечивается стационарное состояние организма. Изменение скорости какой-либо реакции под воздействием факторов окружающей среды или, обусловленное особенностями развития организма, может быть причиной развития патологии. Корректировка биохимических процессов связана, в большинстве случаев, с регуляцией скоростей биохимических реакций. Эффективность действия лекарственных веществ может быть связана со скоростью химических реакций, возникающих при этом в организме. Изучением кинетических закономерностей поступления, распределения и выведения из организма чужеродных химических соединений — ксенобиотиков — занимаются специальные науки: фармакои токсикокинетика.
II. Теоретические сведения Скорость химической реакции (V) определяется изменением концентрации (ДC) реагирующих веществ (или продуктов реакции) в единицу времени. Наиболее часто употребляемая единица изменения — моль/л•с:
.
где V — скорость химической реакции, моль/л•с;
ДС — изменение концентрации вещества, моль/л;
Дt — промежуток времени, с Вследствие изменения концентраций реагирующих веществ скорость реакции по мере ее течения непрерывно меняется. Поэтому о скорости химической реакции говорят как о скорости, определяемой в данный момент времени (истинная скорость), или рассматривают среднюю скорость за данный промежуток времени.
Скорость реакции зависит от температуры, концентрации реагирующих веществ, их природы и катализатора.
Зависимость скорости химической реакции от температуры выражается правилом Вант-Гоффа: При увеличении температуры на каждые 10о скорость химической реакции увеличивается в 2−4 раза:
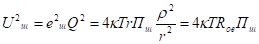
.
где — скорости химической реакции до и после нагрева соответственно;
— разность конечной и начальной температур;
г — температурный коэффициент скорости реакции Зависимость скорости реакции от концентрации реагирующих веществ выражает закон действия масс: Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях стехиометрических коэффициентов. В математической форме этот закон имеет выражение:
.
где [A] и [B] - концентрации реагирующих веществ;
m и n — коэффициенты при этих веществах в уравнении реакции;
k — коэффициент пропорциональности, называемый константой скорости
Если концентрации реагирующих веществ равны единице, то, то есть константа скорости численно равна скорости химической реакции при концентрациях реагирующих веществ, равных единице. Константа скорости зависит от температуры и природы реагирующих веществ, но не от их конценртраций.
Химическое равновесие. Константа химического равновесия. Уравнение изотермы
Химические реакции, в результате которых исходные вещества полностью превращаются в продукты реакции, называют необратимыми.
Степень превращения исходных веществ в продукты реакции в случае обратимых реакций определяется состоянием химического равновесия, характеристикой которого является константа равновесия (K).
Для любой системы, например:
скорости прямой и обратной реакции можно выразить согласно закону действующих масс:
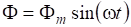
и.
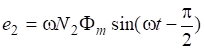
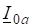
С наступлением равновесия V1 = V2 или, тогда :
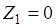
Отношение констант равновесия прямой и обратной реакций называют константой равновесия К, которая равна также произведению равновесных концентраций продуктов реакции, деленному на произведение равновесных концентраций исходных веществ. При K>>1 произведение концентраций продуктов реакции много больше произведения концентраций исходных веществ, поэтому обратимая реакция дает в данном случае дает большой выход продуктов реакции. При К<<1, наоборот, выход продуктов реакции очень мал. В первом случае равновесие системы сильно смещено в строну образования продуктов реакции, а во втором — в строну исходных веществ.
Уравнение изотермы связывает энергию Гиббса и константу равновесия (при T = const):
.
Уравнение изотермы позволяет прогнозировать изменение константы скорости реакции и соответственно смещение равновесия при изменении концентрации какого-либо вещества или температуры. Из уравнения изотермы можно сделать вывод: если К>1 (ДG<0) идет прямая реакция, K<1 (ДG>0) идет обратная реакция, в случае K=1 (ДG=0) имеет место равновесие.
Сдвиг химического равновесия. Принцип Ле-Шателье
Направление смещения равновесия определяется правилом Ле-Шателье, согласно которому если на систему, находящуюся в равновесии, оказать внешнее воздействие, то в системе возникнет противодействие. Это значит, что до установления нового равновесия получает большую скорость та реакция, которая уменьшает внешнее воздействие и, таким образом, равновесие смещается в сторону образования продуктов этой реакции.
- 1) Если внешнее воздействие на систему проявляется в уменьшении концентрации одного из веществ, участвующих в реакции, то это смещает равновесие в сторону его образования. Наоборот, при увеличении концентрации одного из веществ равновесие смещается в сторону той реакции, которая ее уменьшает.
- 2) Повышение температуры смещает равновесие в строну эндотермической реакции, а понижение — в сторону экзотермической.
- 3) Изменение давления оказывает влияние на равновесие в том случае, если в реакции участвует хотя бы одно газообразное вещество, и число молекул газообразных веществ или газообразных продуктов неодинаково. При увеличении или уменьшении давления равновесие смещается в сторону образования меньшего или большего числа молекул газа.
III. Вопросы для самоконтроля.
- 1. Что называется средней и истинной скоростью химической реакции?
- 2. От каких факторов зависит скорость химических реакций? Дайте определение закона действующих масс.
- 3. Что называют константой скорости? Каков физический смысл этой величины?
- 4. Какой формулой выражается правило Вант-Гоффа?
- 5. Что называют температурным коэффициентом скорости реакции? Какие он может иметь значения?
- 6. Что называют молекулярностью и порядком реакции?
- 7. Приведите уравнение, связывающее константу скорости химической реакции с температурой (уравнение Аррениуса).
- 8. Какие реакции называются простыми и сложными? Какие типы сложных реакций вам известны? Приведите примеры.
- 9. Что называют химическим равновесием? Почему оно является динамическим? Какие концентрации реагирующих веществ называют равновесными?
- 10. Что называют константой химического равновесия? От каких факторов она зависит?
- 11. Сформулируйте принцип Ле-Шателье.
- 12. Влияет ли изменение концентрации реагирующих веществ на:
- а) скорость реакции;
- б) константу скорости реакции;
- в) константу химического равновесия?
- 13. Влияет ли изменение температуры на:
- а) константу скорости реакции;
- б) константу химического равновесия?
- 14. Какие вещества называются катализаторами? Какие виды катализа вам известны?
- 15. Какие вещества называются биокатализаторами? Каковы характерные их особенности в сравнении с обычными катализаторами?
IV. Задачи с эталонами решения.
Пример 1:
Определить как изменится скорость реакции, если общее давление в системе уменьшить в 5 раз.
Решение:
Уменьшение давления в системе в 5 раз вызовет увеличение объема в 5 раз, а концентрация реагирующих веществ уменьшается в 5 раз. Начальная скорость реакции равна:
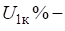
После уменьшения давления в 5 раз:
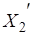
Скорость реакции уменьшится в 125 раз.
Пример 2:
Во сколько раз увеличится скорость реакции при повышении температуры от 40 до 60оС, принимая температурный коэффициент скорости равным 2.
Решение:
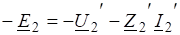
Скорость реакции увеличится в 4 раза.
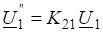
Пример 3:
При синтезе аммиака равновесие установилось при следующих концентрациях реагирующих веществ: =4 моль/л, =2 моль/л, =6 моль/л. Рассчитайте константу равновесия этой реакции и исходные концентрации азота и водорода.
Решение:
Константа равновесия этой реакции равна:
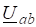
Исходные концентрации азота и водорода находим на основе уравнения реакции. На образование двух молей NH3 расходуется один моль N2, а на образование шести молей аммиака потребовалось: моль азота. Учитывая равновесную концентрацию азота, находим его первоначальную концентрацию:
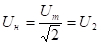
моль/л.
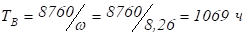
На образование двух молей NH3 необходимо израсходовать 3 моль водорода, а для получения шести молей NH3 требуется водорода: моль:
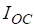
моль/л.
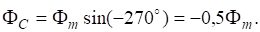
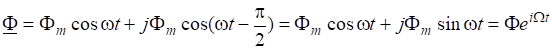
Таким образом, реакция начиналась при =7 моль/л; = 11 моль/л.
Пример 4:
Вычислить равновесные концентрации водорода и йода, если известно, что их начальные концентрации составляли по 0,02 моль/л, а равновесная концентрация HI — 0,03 моль/л. Вычислить константу равновесия.
Решение:
Из уравнения реакции:
видно, что на образование 0,03 моль HI расходуется по 0,015 моль водорода и йода, следовательно, их равновесные концентрации равны и составляют 0,02−0,015=0,005 моль/л, а константа равновесия:
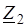
Пример 5:
Куда сместится равновесие в системах:
вследствие увеличения давления и температуры?
Решение:
В первой системе вследствие того, что реакция идет без изменения давления, увеличение давления не вызовет смещения равновесия, а увеличение температуры сместит равновесие в строну прямой реакции (эндотермическая реакция).
Во второй системе увеличение давления вызовет смещение равновесия с сторону прямой реакции, а увеличение температуры — в сторону обратной реакции.
V. Задачи для самостоятельного решения.
1. Напишите выражения для скорости следующих химических реакций:
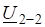
- 2. Реакция между оксидом азота (II) и хлором протекает по уравнению. Как изменится скорость реакции при увеличении:
- а) концентрация оксида азота в два раза;
- б) концентрации хлора в два раза;
- в) концентрации обоих веществ в два раза.
- 3. На сколько градусов следует повысить температуру системы, чтобы скорость протекающей в ней реакции возросла в 16 раз (г=2)?
- 4. Во сколько раз увеличится константа скорости химической реакции при повышении температуры на 40оС, если г=3,2.
- 5. Вычислить равновесные концентрации веществ, участвующих в реакции
при начальных концентрациях веществ [CO] = 0,10 моль/л;
[H2O] = 0,40 моль/л; Кр = 1.
- 6. Рассчитайте как изменятся скорости прямой и обратной реакции в равновесной системе:, если уменьшить объем, занимаемый газами в 3 раза. Сместиться ли при этом равновесие?
- 7. В каком направлении сместится равновесие системы :
.
если:
- а) увеличить концентрацию водорода;
- б) уменьшить концентрацию паров воды?
- 8. В каком направлении сместится равновесие системы при повышении температуры
- 9. В каком направлении сместится равновесие при повышении давления в системах:
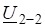
VI. Литература для самоподготовки.
- 1. Ю. А. Ершов, В. А. Попков и др. Общая химия. — М., 1993. — с. 32−42, 391−416
- 2. Н. А. Глинка. Общая химия. — Л., 1979 и др. — гл VI, с. 170−187
- 3. А. С. Ленский Введение в бионеорганическую и биофизическую химию. — М., 1993. — с. 55−67
- 4. Лекции.