Основные виды превращения взрывчатых систем

Все тепло подводимое к веществу можно представить в виде суммы двух составляющих: внешнего тепла, подводимого извне, и внутреннего тепла, выделяющегося в результате действий сил трения. Внешнее тепло подводится к системе либо отводится, в то время как внутреннее тепло может только выделятся, т. е. всегда положительно. Следовательно, энтропия изолированной системы может только возрастать и лишь… Читать ещё >
Основные виды превращения взрывчатых систем (реферат, курсовая, диплом, контрольная)
Химическое превращение взрывчатых систем в зависимости от условий возбуждения химической реакции, характера ВВ и других факторов может распространяться с различной скоростью и вследствие этого обладать существенными качественными различиями. По характеру и скорости распространения все взрывные процессы делятся на горение, взрыв и детонацию.
Горение представляет собой процесс химического превращения, протекающий в сравнительно узкой зоне. Он происходит медленно, с переменной скоростью — обычно от долей сантиметра до нескольких метров в секунду.
Выделяющаяся в зоне реакции энергия передается от горячих продуктов ближайшим слоем исходного ВВ путем теплопроводности и излучения тепла горячими газообразными продуктами горения. Температура вещества в этих слоях повышается, и в них возникает реакция.
Скорость горения существенно зависит от внешнего действия, сильно возрастая с повышением давления. Зависимость скорости горения от давления является причиной ускорения процесса горения в замкнутом объеме.
Скорость горения всегда меньше скорости звука в данном веществе. Горение является характерным видом взрывчатого превращения порохов.
Взрыв характеризуется резким скачком давления в узкой зоне переменной скоростью распространения процесса, измеряемой тысячами метров в секунду, и сравнительно малой зависимостью от внешних условий. Скорость взрыва больше скорости звука в массе взрывчатого вещества.
Детонация представляет собой взрыв, распространяющийся при данном состоянии ВВ и при определенных внешних условиях с постоянной сверхзвуковой скоростью. По характеру и сущности явления детонация не отличается от взрыва, но представляет собой его стационарную форму. Механизм распространения химического превращения при взрыве (детонации) состоит в передаче энергии от слоя к слою волной сжатия (ударной волной).
Принципиальное отличие в механизме распространения предопределяет различные скорости рассматриваемых процессов и различное воздействие взрыва и горения на окружающую среду.
Все исследования детонационных и взрывчатых характеристик взрывчатых систем сводятся, по существу к решению трех основных проблем:
определение теплоты взрыва, удельного объема и состава продуктов взрывчатого превращения;
расчет давлений Р1 и Р2 в плоскостях химического пика и Чемпена-Жуге соответствующих закономерностей их изменения в зоне химических реакций при последующем изоэнтропном расширении;
отыскания возможностей прогнозирования детонационных свойств вновь синтезируемых ВВ.
Строгое решение перечисленных вопросов должно базироваться на учете законов гидродинамики, газовой динамики, термохимии и химической кинетики.
Остановимся, прежде всего, на термодинамических и термохимических характеристиках ВВ.
Фундаментальными характеристиками любой термодинамической системы являются внутренняя энергия U, энтальпия i и энтропия S.
Внутренняя энергия характеризует запас энергии системы, включая энергию поступательного, колебательного и вращательного движения атомов и молекул. Важно отметить, что внутренняя энергия не учитывает кинетическую энергию движения системы в целом и потенциальную энергию ее положения. Другими словами, внутренняя энергия замкнутой термодинамической системы не изменяется, при сообщении ей той или иной скорости или перемещения ее в гравитационном поле.
При переходе системы из любого начального состояния (1) в любое конечное состояние (2) изменение внутренней энергии ДU=U2-U1 всегда одно и то же вне зависимости от пути и способа перехода. Это непосредственно вытекает из закона сохранения энергии.
Следовательно, внутренняя энергия есть однозначная функция состояния системы (параметр состояния), а ее бесконечно малое приращение dU является полным дифференциалом от переменных состояния (давления Р, удельного объема V и температуры Т).
Энтальпия (называется также теплосодержанием или тепловой функцией Гиббса) связана с U соотношением:
i=U+PV, (2).
энтальпия представляет собой совокупность внутренней энергии и потенциальной энергии давления (внешней энергии).
Энтропия определяется соотношением:
dS=dQ/T, [ккал/кг*град] (3).
Все тепло подводимое к веществу можно представить в виде суммы двух составляющих: внешнего тепла, подводимого извне, и внутреннего тепла, выделяющегося в результате действий сил трения. Внешнее тепло подводится к системе либо отводится, в то время как внутреннее тепло может только выделятся, т. е. всегда положительно. Следовательно, энтропия изолированной системы может только возрастать и лишь для идеальной системы она может оставаться постоянной.
Теплота взрыва является энергетической предпосылкой спонтанной взрывной реакции.
Теплота взрыва — важнейшая энергетическая характеристика ВВ. Она одновременно является определяющей характеристикой, т.к. от нее зависят скорость детонации, температура взрыва, работоспособность и общее действие взрыва.
Несмотря на столь большое значение теплоты взрыва, взрывчатники чаще всего изучали такие взрывчато-технические характеристики, как скорость детонации, бризантность или работоспособность, которые непосредственно определяют местное или общее действие взрыва.
Опытное определение теплоты взрыва трудоемко, требует специального и громоздкого оборудования. Кроме того, для одного опыта требуется 50−100 гр. ВВ, которое не всегда имеется в наличии, особенно когда идет речь об исследовании нового ВВ.
Раньше теплоты взрывчатого превращения, как правило, определяли в малых калориметрических или манометрических бомбах и применяли навески 1−2 г. Очевидно, что в этих случаях определялась не теплота детонации, (она нас главным образом и интересует), а теплота взрывчатого превращения, которая для большинства ВВ ниже первой. Вот почему в старой литературе часто можно встретить явно заниженные и разноречивые данные по теплотам взрыва таких ВВ, как тротил, тетрил, пикриновая кислота, и даже гексоген. Эти данные невозможно было применять для расчета других характеристик ВВ или зарядов, т.к. получались совершенно неудовлетворительные результаты. Поэтому, теоретические зависимости, в которых фигурирует величина теплоты взрыва не могут быть эффективно использованы для практических целей.
В последние годы нашли широкое применение большие калориметрические бомбы для непосредственного определения теплот взрыва сравнительно больших зарядов ВВ (50−100 г. диаметр заряда 40−50 мм.). При этом создаются благоприятные условия для протекания в заряде ВВ стационарного детонационного процесса и для закалки реакции. Это позволяет дублировать и контролировать данные калориметрирования с теплотами взрыва, подсчитанными на основании состава продуктов взрыва. Существуют различные конструкции установок, которые позволяют определять теплоты взрыва с точностью до 1−2%. Применение современной калориметрии позволило получить надежные данные по теплотам взрыва не только штатных ВВ, но и для новых взрывчатых веществ и композиций. Очевидно, что для получения надежных и достоверных данных по теплоте взрыва недостаточно одного или двух опытов, а это связано не только с длительными и трудоемкими экспериментами, но и с большим расходом ВВ.
На практике перед исследователями часто возникают вопросы, связанные с энергетическими характеристиками ВВ, и при этом нет возможности определить их опытным путем либо потому, что имеется малое количество ВВ, либо ВВ еще не синтезировано вовсе, т. е. имеется лишь формула ВВ.
Поэтому задача по теоретическому расчету теплот взрыва и других характеристик ВВ по его формуле имеет не только чисто теоретическое, но и практическое значение, т.к. позволяет оценить достоинства и недостатки не только известных и вновь синтезируемых ВВ, но предсказать характеристики новых, еще не синтезированных ВВ.
В первом случае расчет позволяет сэкономить средства и время, необходимые для опытного определения этих характеристик ВВ, а когда количество ВВ мало, опытное количество вообще невозможно.
Во втором случае оценка свойств ВВ до его синтеза позволяет решить вопрос о целесообразности синтеза того или иного вещества, что также позволяет сэкономить средства и творческие силы исследователей. Таким образом, широкое использование расчетных методов позволяет не только предсказывать ряд свойств ВВ, но ускоряет процесс исследования и тем самым как бы повышает производительность труда исследователя. Этими обстоятельствами можно объяснить многочисленные попытки разработки методов расчета ряда энергетических и взрывчатых характеристик ВВ, в частности теплот взрыва, сгорания и образования. Ближайшей целью этих расчетов является теплота взрыва ибо, как было указано выше, по ней можно вычислить ряд других характеристик.
Химическое превращение ВВ, происходящее при взрыве, сопровождается изменением энергии системы.
Согласно первому принципу термодинамики изменение внутренней энергии системы будет:
ДU=q-A, (4).
где ДU — изменение внутренней энергии,.
q — выделившееся или поглощенное системой тепло,.
A — работа, совершенная системой и равная:
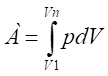
(5).
При изохорном процессе А=0, тогда ДU=q.
Таким образом, тепловой эффект реакции, происходящей при V=const, равен изменению внутренней энергии.
Используя обозначения тепловых эффектов, принятые в химии, можно написать, что:
— ДU=QV (6).
где QV — тепловой эффект при постоянном объеме.
Еще задолго до открытия первого принципа термодинамики в 1840 г. русским академиком Г. И. Гессом был открыт основной закон термохимии, который является частным случаем первого принципа термодинамики.
В соответствии с законом Гесса тепловой эффект реакции зависит только от начального и конечного состояния системы и равен алгебраической сумме теплот промежуточных реакций, т. е.:
Q1,n=Q1,2+Q2,3+Q3,4+…+Qn-1,n (7).
где индексы 1 и n соответственно начальное и конечное состояния, а индексы 2, 3, …, n-1 — промежуточные состояния системы.
Q1,3=Q1,2+Q2,3 (8).
Термохимия процессов сгорания и взрывчатого превращения ВВ полностью описывается этим уравнением.
В первом случае.
Qсг=Qпс-Qобр (9).
Во втором случае.
Qвзр=Qп.в.-Qобр. (10).
где Qсг — теплота сгорания, т. е. количество тепла, выделяющееся при полном окислении одного моля или килограмма ВВ в атмосфере кислорода;
Qпс — сумма теплот образования продуктов сгорания из простых веществ;
Qобр — теплота образования ВВ из простых веществ;
Qвзр — теплота взрывчатого превращения, т. е. количество тепловой энергии, выделяющееся при взрыве ВВ;
Qп.в — сумма теплот образования продуктов взрыва.
Из сказанного следует, что для расчета теплоты взрыва того или иного ВВ необходимо знать теплоту его образования (см. табл. 3) и уравнение реакции взрывчатого превращения.
Таблица 3. Теплота образования.
Взрывчатое вещество или взрывчатая смесь. | При постоянном давлении. | При постоянном объеме. | |
кДж/моль. | кДж/моль. | кДж/кг. | |
Аммония нитрат NH4NO3. | 365,7. | 354,3. | 4433,0. |
Аммиак NH3. | 81,01. | 71,18. | 4186,8. |
Вода (жидкая) H2O. | 286,2. | 282,5. | 15 717,6. |
Вода (пар) H2O. | 241,9. | 240,6. | 13 354,6. |
Гексоген C3H6O6N6. | — 71,6. | — 93,3. | — 420,3. |
Двуокись углерода CO2. | 395,6. | 395,6. | 8987,3. |
Динитронафталин C10H6O4N2. | — 15,2. | — 20,8. | — 138,0. |
Древесная мука C15H22O10. | ; | 479,0. | 1323,2. |
Коллоидный хлопок (12,2% N). | 2762,8. | 2700,0. | 10 310,1. |
Метан CH4. | 76,62. | 74,11. | 4631,64. |
Нитрогликоль C2H4O6N2. | 244,0. | 228,4. | 1508,6. |
Нитроглицерин C3H5O9N3. | 365,0. | 344,5. | 1516,6. |
Нитрид алюминия NAl. | 334,94. | 330,76. | 8067,25. |
Окись азота NO. | — 90,4. | — 90,4. | — 3014,0. |
Окись алюминия Al2O3. | 1670,2. | 1666,4. | 16 346,3. |
Окись углерода CO. | 112,5. | 113,7. | 4060,4. |
Стеарат кальция C36H70O4Ca. | 2774,17. | 2684,16. | 4422,0. |
Тетрил C7H5O6N5. | — 33,49. | — 55,68. | — 193,43. |
Тротил C7H5O6N3. | 59,4. | 42,3. | 186,7. |
Тэн C5H6O12N4. | 531,6. | 407,3. | 1588,6. |
Хлористый калий KCl. | 438,8. | 435,6. | 5843,6. |
Хлористый натрий NaCl. | 411,6. | 410,4. | 7019,9. |
Теплота взрыва может быть вычислена и теоретически, если известен состав продуктов взрыва, который определяется не только свойствами ВВ, но и характеристиками заряда и условиями опыта.