Водородная связь.
Водородная связь

По современным представлениям, такая структура в значительной мере определяется водородными связями, которые, объединяя каждую молекулу с ее четырьмя соседями, образуют весьма ажурную «тридимитоподобную» структуру с пустотами, превосходящими по размерам сами молекулы. Основное отличие структуры жидкой воды от льда — это более размытое расположение атомов в решетке, нарушение дальнего порядка… Читать ещё >
Водородная связь. Водородная связь (реферат, курсовая, диплом, контрольная)
Понятие и термин «водородная связь» ввели В. Латимер и Р. Родебуш в 1920, для того, чтобы объяснить высокие температуры кипения воды, спиртов, жидкого HF и некоторых других соединений. Сопоставляя температуры кипения родственных соединений Н2O, Н2S, Н2Se, и Н2Te, они обратили внимание на то, что первый член этого ряда — вода — кипит намного выше, чем это следовало из той закономерности, которую образовали остальные члены ряда. Из этой закономерности следовало, что вода должна кипеть на 200° С ниже, чем наблюдаемое истинное значение.
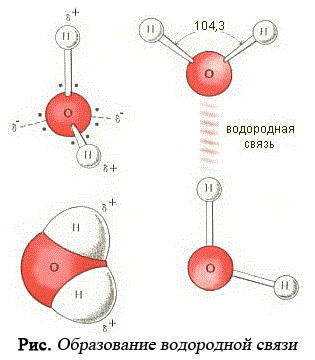
Точно такое же отклонение наблюдается для аммиака в ряду родственных соединений: NН3, Н3P, Н3As, Н3Sb. Его истинная температура кипения (-33° С) на 80° С выше ожидаемого значения.
При кипении жидкости разрушаются только Ван-дер-Ваальсовы взаимодействия, те, что удерживают молекулы в жидкой фазе. Если температуры кипения неожиданно высокие, то, следовательно, молекулы связаны дополнительно еще какими-то силами. В данном случае это и есть водородные связи. водородный валентный термохимический Водородная связь — это взаимодействие между двумя электроотрицательными атомами одной или разных молекул посредством атома водорода: А? Н … В (чертой обозначена ковалентная связь, тремя точками — водородная связь).
Водородная связь обусловлена электростатическим притяжением атома водорода (несущим положительный заряд д+) к атому электроотрицательного элемента, имеющего отрицательный заряд д?. В большинстве случаев она слабее ковалентной, но существенно сильнее обычного притяжения молекул друг к другу в твердых и жидких веществах. В отличие от межмолекулярных взаимодействий водородная связь обладает свойствами направленности и насыщаемости, поэтому ее нередко считают одной из разновидностей ковалентной химической связи. Она может быть описана с помощью метода молекулярных орбиталей как трехцентровая двухэлектронная связь.
Одним из признаков водородной связи может служить расстояние между атомом водорода и другим атомом, ее образующим. Оно должно быть меньше, чем сумма радиусов этих атомов. Чаще встречаются несимметричные водородные связи, в которых расстояние Н … В больше, чем А? В. Однако в редких случаях (фтороводород, некоторые карбоновые кислоты) водородная связь является симметричной. Угол между атомами во фрагменте А? Н … В обычно близок к 180o. Наиболее сильные водородные связи образуются с участием атомов фтора. В симметричном ионе [F?H?F]? энергия водородная связи равна 155 кДж/моль и сопоставима с энергией ковалентной связи. Энергия водородная связи между молекулами воды уже заметно меньше (25 кДж/моль).
Точно также повышенная температура кипения спиртов (в сравнении с соединениями, не содержащими группуОН) — результат образования водородных связей.
Экспериментальные факты, сопровождающие процесс образования водородной связи:
- 1. При образовании водородных связей выделяется теплота — термохимическая мера энергии Н-связи. Эту характеристику используют для калибровки спектральных методов изучения водородных связей.
- 2. Расстояние между соседними атомами, участвующими в образовании водородной связи, значительно меньше суммы их ванн-дер-ваальсрвых радиусов. Последнее обстоятельство является одним из критериев, указывающих на образование между молекулами водородных связей.
- 3. Водородная связь увеличивает длину связи Х-Н, что приводит к смещению соответствующей полосы валентных колебаний в ИК-спектре в сторону более низких частот. Метод ИК-спектроскопии является главным методом изучения водородной связи.
Современная ИК-спектроскопия представляет собой экспресс-метод установления структурных особенностей органических соединений. С помощью ИК-спектроскопии быстро и надёжно идентифицируются разнообразные функциональные группы: карбонильная, гидроксильная, карбоксильная, амидная, амино, циано и др.; а также различные непредельные фрагменты: двойные и тройные углерод-углеродные связи, ароматические или гетероароматические системы. Методами ИК-спектроскопии изучают внутрии межмолекулярные взаимодействия, например, образование водородных связей. В химии древесины и химии природных соединений с помощью ИК-спектроскопии исследуют структуры углеводов, лигнинов, аминокислот, терпенов, стероидов и многих других веществ.
- 4. При образовании водородной связи полярность связи Х-Н возрастает, что приводит кс повышению дипольного момента молекулярного комплекса в сравнении с расчетными данными, полученными путем векторного сложения диполей молекул R-X-H и B-Y.
- 5. Протоны, участвующие в водородной связи, характеризуются более низкой электронной плотностью, поэтому они деэкранируются.
- 6. Для межмолекулярных водородных связей обнпружено смещение кислотно-основного равновесия молекулярный комплекс-ионная пара вправо при повышении полярности растворителя.
Водородные связи обнаружены во многих химических соединениях. Они возникают, как правило, между атомами фтора, азота и кислорода (наиболее электроотрицательные элементы), реже — при участии атомов хлора, серы и других неметаллов. Прочные водородные связи образуются в таких жидких веществах, как вода, фтороводород, кислородсодержащие неорганические кислоты, карбоновые кислоты, фенолы, спирты, аммиак, амины. При кристаллизации водородные связи в этих веществах обычно сохраняются. Поэтому их кристаллические структуры имеют вид цепей (метанол), плоских двухмерных слоев (борная кислота), пространственных трехмерных сеток (лед).
Если водородная связь объединяет части одной молекулы, то говорят о внутримолекулярной водородной связи. Это особенно характерно для многих органических соединений .Если же водородная связь образуется между атомом водорода одной молекулы и атомом неметалла другой молекулымежмолекулярная водородная связь, то молекулы образуют довольно прочные пары, цепочки, кольца. Так, муравьиная кислота и в жидком и в газообразном состоянии существует в виде димеров:
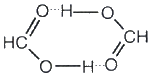
а газообразный фтороводород содержат полимерные молекулы, включающие до четырех частиц HF. Прочные связи между молекулами можно найти в воде, жидком аммиаке, спиртах. Необходимые для образования водородных связей атомы кислорода и азота содержат все углеводы, белки, нуклеиновые кислоты. Известно, например, что глюкоза, фруктоза и сахароза прекрасно растворимы в воде. Не последнюю роль в этом играют водородные связи, образующиеся в растворе между молекулами воды и многочисленными OH-группами углеводов.
Наличие водородных связей влияет и на кислотные свойства многих веществ. Фтороводородная кислота, в отличие от других галогеноводородных кислот является слабой так как атомы водорода связаны сразу с двумя атомами фтора, что препятствует их отщеплению (по той же причине большинство карбоновых кислот являются слабыми). Благодаря особо прочным водородным связям фтороводородная кислота — единственная одноосновная кислота, способная образовывать кислые соли, например NaHF2.
В настоящее время надежный способ обнаружить Н-связи дают спектральные методы (чаще всего инфракрасная спектроскопия). Спектральные характеристики групп АН, связанных водородными связями, заметно отличаются от тех случаев, когда такая связь отсутствует. Кроме того, если структурные исследования показывают, что расстояние между атомами Б — Н меньше суммы Ван-дер-Ваальсовых радиусов, то считают, что присутствие Н-связи установлено.
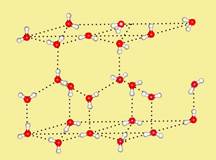
Помимо повышенной температуры кипения водородные связи проявляются себя также при формировании кристаллической структуры вещества, повышая его температуру плавления. В кристаллической структуре льда Н-связи образуют объемную сетку, при этом молекулы воды располагаются таким образом, чтобы атомы водорода одной молекулы были направлены к атомам кислорода соседних молекул:
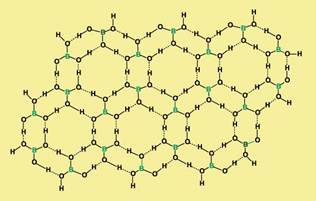
Борная кислота В (ОН)3 имеет слоистую кристаллическую структуру, каждая молекула связана водородными связями с тремя другими молекулами. Упаковка молекул в слое образует паркетный узор, собранный из шестиугольников:
Кислород и азот — основные доноры протонов, они берут на себя функцию атома, А в рассмотренной ранее триаде Б· ··Н?±А??. Они же, чаще всего, выступают в роли акцепторов (атом Б). Благодаря этому некоторые органические вещества, содержащие O и N в роли атома Б, могут растворяться в воде (роль атома, А исполняет кислород воды).
Однако наличие водородной связи у воды — это всего лишь необходимое, но не достаточное условие для объяснения не-обычных свойств воды. Самым важным обстоятельством, объясняющим основные свойства воды, является структура жидкой воды как целостной системы.
Еще в 1916 г. были разработаны принципиально новые представления о строении жидкости. Впервые с помощью рентгеноструктурного анализа показано, что в жидкостях наблюдается определенная регулярность расположения молекул или иначе — наблюдается ближний порядок расположения молекул. Первые ренгеноструктурные исследования воды провели нидерландские ученые в 1922 году В. Кеез и Дж. де Смедт. Ими было показано, что для жидкой воды характерна упорядоченное размещение молекул воды, т. е. вода имеет определённую регулярную структуру.
Действительно, структура воды в живом организме во многом напоминает структуру кристаллической решетки льда. И именно этим объясняются сейчас уникальные свойства талой воды, долгое время сохраняющей структуру льда. Талая вода гораздо легче обычной вступает в реакцию с различными веществами, и организму не надо тратить добавочную энергию на перестройку ее структуры.
Каждая молекула воды в кристаллической структуре льда участвует в 4 водородных связях, направленных к вершинам тетраэдра. В центре этого тетраэдра находится атом кислорода, в двух вершинах — по атому водорода, электроны которых задействованы в образовании ковалентной связи с кислородом. Две оставшиеся вершины занимают пары валентных электронов кислорода, которые не участвуют в образовании внутримолекулярных связей. При взаимодействии протона одной молекулы с парой неподеленных электронов кислорода другой молекулы возникает водородная связь, менее сильная, чем связь внутримолекулярная, но достаточно могущественная, чтобы удерживать рядом соседние молекулы воды. Каждая молекула может одновременно образовывать четыре водородные связи с другими молекулами под строго определенными углами, равными 109°28', направленных к вершинам тетраэдра, которые не позволяют при замерзании создавать плотную структуру (при этом в структурах льда I, Ic, VII и VIII этот тетраэдр правильный).
Известно, что биологические ткани на 70−90% состоят из воды. Это позволяет предполагать, что многие физиологические явления могут отображать молекулярные особенности не только растворенного вещества, но в равной степени и растворителя — воды. Подобного рода соображения, высказываемые такими крупными современными учеными, как Сент-Дьерди, Поллинг, Клотц и другие, вызвали новую волну повышенного интереса к вопросам структуры и состояния воды в различных системах.
Первую теорию о структуре воды выдвинули английские исследователи Дж. Бернал и Фаулер. Они создали концепцию о тетраэдрической структуре воды.
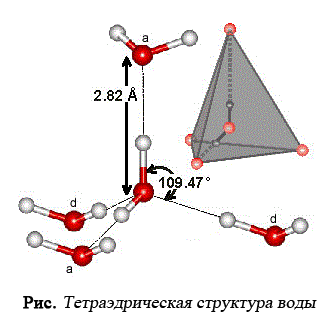
В августовском номере 1933 г. только что созданного международного журнала по химической физике «Journal of Chemical Physics» была опубликована их классическая работа о структуре молекулы воды и ее взаимодействии с себе подобными молекулами и ионами разных сортов.
В своей научной интуиции Дж. Бернал и Р. Фаулер опирались на обширный материал накопленных экспериментальных и теоретических данных в области изучения строения молекулы воды, структуры льда, строения простых жидкостей, на данные ренгеноструктурного анализа воды и водных растворов. Прежде всего, они определили роль водородных связей в воде.
Было известно, что в воде есть ковалентные и водородные связи. Ковалентные связи не рвутся при фазовых переходах воды: вода-пар-лед. Лишь электролиз, нагревание воды на железе и т. п. разрывает ковалентные связи воды. Водородные связи в 24 раза слабее ковалентных. При таянии льда, снега, водородные связи в образующейся воде частично сохраняются, в паре воды они все разорваны.
Попытки представить воду как ассоциированную жидкость с плотной упаковкой молекул воды, подобно шарикам какой-либо емкости, не соответствовали элементарным фактическим данным. В этом случае удельная плотность воды должна была бы быть не 1 г/см3, а более 1,8 г/см3.
Второе важное доказательство в пользу особой структуры молекулы воды состояла в том, что в отличие от других жидкостей вода — это было уже известно — обладает сильным электрическим моментом, составляющим ее дипольную структуру. Поэтому нельзя было представить наличие весьма сильного электрического момента молекулы воды в симметрической конструкции двух атомов водорода относительно атома кислорода, расположив все входящие в нее атомы по прямой линии, т. е. Н-О-Н.
Экспериментальные данные, а также математические расчеты окончательно убедили английских ученых в том, что молекула воды «однобока» и имеет «угловую» конструкцию, а оба атома водорода должны быть смещены в одну сторону относительно атома кислорода на угол 104,50.
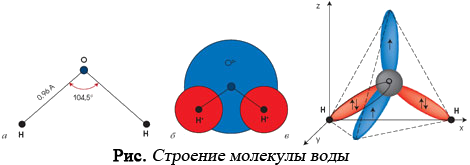
Именно поэтому модель воды Бернала-Фаулера — трехструктурная, с наличием нескольких раздельных типов структур. Согласно этой модели, структура воды определяется структурой ее отдельных молекул.
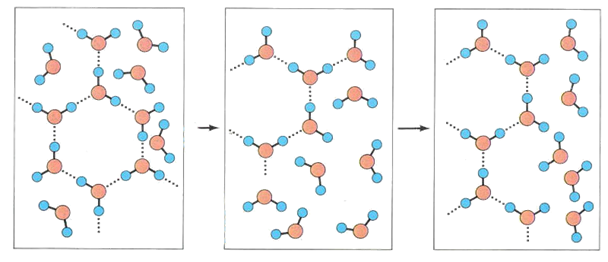
В дальнейшем была развита идея считать жидкую воду псевдокристаллом, согласно которой вода в жидком состоянии представляет собой как бы смесь трех компонент с различными структурами (структура льда, кристаллического кварца и плотно упакованная структура обычной воды).
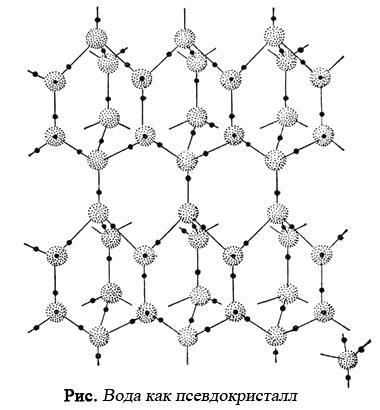
Вода — это ажурный псевдокристалл, в котором отдельные тетраэдрические молекулы H2О связаны друг с другом направленными водородными связями, образуя гексагональные структуры как в структуре льда.
В дальнейшем модель воды Бернала-Фаулера была уточнена и пересмотрена. На ее основе возникли более 20 моделей структуры воды, которые можно разделить на 5 групп; 1) непрерывные, 2) смешанные модели структуры воды (двухи трехструктурные), 3) модели с заполнением пустот, 4) кластерные и 5) модели ассоциатов.
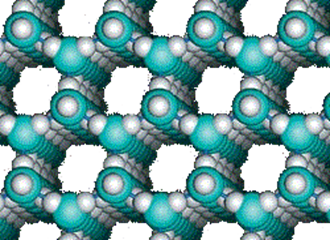
Непрерывные модели структуры воды постулируют, что вода — это единая тетраэдрическая сеть водо-родных связей между отдельными молекулами воды, которые искривляются при плавлении льда.
Смешанные модели: вода — это смесь двух или трех структур, например, одиночных молекул, их ассоциатов различной сложности — кластеров.
Дальнейшее усовершенствование этой модели привело к созданию модели с заполнением пустот (включая клатратные модели) и к кластерным моделям. Причём кластеры могут содержать более несколько сот молекул Н2О и подобно мерцающим скоплениям непрерырвно возникают и разрушаются вследствие местных флуктуаций плотности.
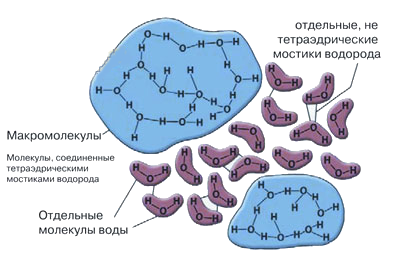
Широко известна кластерная модель структуры воды А. Фрэнка и В. Вена, усовершенствованная Г. Немети-Г. Шерагой (1962). По этой модели, в жидкой воде, наряду с мономерными молекулами имеются кластеры, рои молекул Н2О, объединенных водородными связями со временем жизни 10−10 — 10−11 сек. Они разрушаются и создаются вновь.
Практически все кластерные гипотезы воды осно-вываются на том, что жидкая вода состоит из сети из 4-кратно связанных молекул Н2О и мономеров, которые заполняют пространство между кластерами. На граничных поверхностях кластеров имеются 1, 2- или 3-х кратно связанные молекулы. Еще данную модель называют моделью «мерцающих скоплений». По С. Зенину, кластеры и ассоциаты являются основой структурной памяти воды — долговременной (стабильные) и кратковременной (лабильные, неустойчивые ассоциаты).
В настоящее время известно большое число гипотез и моделей структуры воды. Некоторые исследователи говорят о наличии в воде 10 различных структур воды с неодинаковыми кристаллическими решетками, различной плотностью и температурой плавления.
Профессор И. З. Фишер в 1961 г. ввел понятие о том, что структура воды зависит от времен-ного интервала, в течение которого ее определяют. Он различал три вида структуры воды:
- · Мгновенная структура (время измерения t)
- · Структура воды средних отрезков времени, когда tд > t > to. 1 и 2 структуры общие со структурой льда. Эта структура существует больше времени осциляции, но меньше времени диффузии tд.
- · Структура, характерная для более длительных отрезков времени (>tд), когда молекула H2О передвигается на большие расстояния.
Д. Эзенберг и В. Каутсман связали названия этих трех структур воды с видами движения ее молекул, 1-ю структуру они назвали І-структурой (от английского instantenous — мгновенный), 2-ю — V-структурой (от английского vibrational — вибрационный), 3-ю — D-структурой (от английского diffusion — диффузионный).
Рентгеноструктурное исследование кристаллов воды, проведенное Морганом и Уорреном, показало, что воде свойственна структура, подобная структуре льда. В воде, также как и во льду, каждый атом кислорода окружен как в тетраэдре другими атомами кислорода. Расстояние между соседними молекулами неодинаково. При 25 °C каждая молекула воды в каркасе имеет одного соседа на расстоянии 2,77 A и трех — на расстоянии 2,94 A, в среднем — 2,90 A. Среднее между ближайшими соседями молекулы воды примерно на 5,5% больше, чем между молекулами льда. Остальные молекулы находятся на расстояниях, промежуточ-ных между первыми и вторыми соседними дистанциями. Расстояние 4,1 A — это расстояние между атомами О-Н в молекуле Н2О.
По современным представлениям, такая структура в значительной мере определяется водородными связями, которые, объединяя каждую молекулу с ее четырьмя соседями, образуют весьма ажурную «тридимитоподобную» структуру с пустотами, превосходящими по размерам сами молекулы. Основное отличие структуры жидкой воды от льда — это более размытое расположение атомов в решетке, нарушение дальнего порядка. Тепловые колебания приводят к изгибу и разрыву водородных связей. Сошедшие с равновесных положений молекулы воды попадают в соседние пустоты структуры и на некоторое время задерживаются там, так как пустотам соответствуют относительные минимумы потенциальной энергии. Это ведет к увеличению координационного числа и к образованию дефектов решетки, наличие которых обусловливает аномальные свойства воды. Координационное число молекул (число ближайших соседей) меняется от 4,4 при 1,5 °С до 4,9 при 83 °C.

Согласно гипотезе нашего учёного соотечественника С. В. Зенина, вода представляет собой иерархию правильных объемных структур «ассоциатов» (clathrates), в основе которых лежит кристаллоподобный «квант воды», состоящий из 57 ее молекул, которые взаимодействуют друг с другом за счет свободных водородных связей. При этом 57 молекул воды (квантов), образуют структуру, напоминающую тетраэдр. Тетраэдр в свою очередь состоит из 4 додекаэдров (правильных 12-гранников). 16 квантов образуют структурный элемент, состоящий из 912 молекул воды. Вода на 80% состоит из таких элементов, 15% - кванты-тетраэдры и 3% - классические молекулы Н2О. Таким образом, структура воды связана с так называемыми платоновыми телами (тетраэдр, додекаэдр), форма которых связана с золотой пропорцией. Ядро кислорода также имеет форму платонова тела (тетраэдра).
Элементарной ячейкой воды являются тетраэдры, содержащие связанные между собой водородными связями четыре (простой тетраэдр) или пять молекул Н2О (объемно-центрированный тетраэдр).
При этом у каждой из молекул воды в простых тетраэдрах сохраняется способность образовывать водородные связи. За счет их простые тетраэдры могут объединяться между собой вершинами, ребрами или гранями, образуя различные кластеры со сложной структурой, например, в форме додекаэдра.
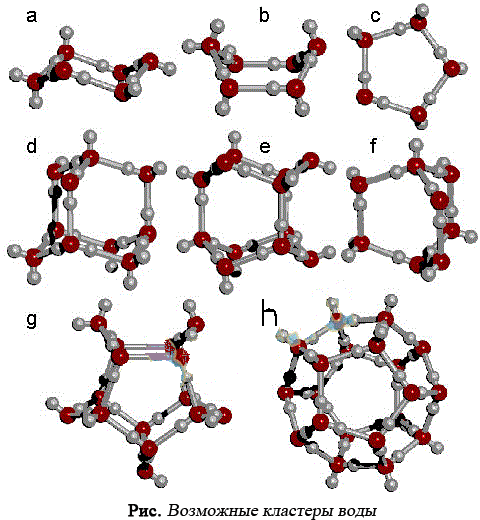
Объединяясь друг с другом, кластеры могут образовывать более сложные структуры.
Кластеры, содержащие в своём составе 20 молекул, оказались более стабильными.
Профессор Мартин Чаплин рассчитал и предположил иную модель воды, в основе которой лежит икосаэдр.
Согласно этой модели вода состоит из 1820 молекул воды — это в два раза больше, чем в модели Зенина. Гигантский икосаэдр в свою очередь состоит из 13 более мелких структурных элементов. Причем, так же как и у Зенина, структура гигантского ассоциата базируется на более мелких образованиях.
Таким образом, сейчас это является очевидным фактом, что в воде возникают ассоциаты воды, которые несут в себе очень большую энергию и информацию крайне высокой плотности.
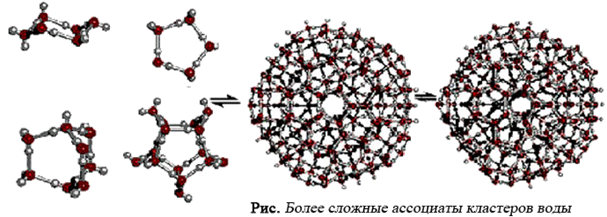
Порядковое число таких структур воды так же высоко, как и порядковое число кристаллов (структура с максимально высоким упорядочением, которую мы только знаем), потому их также называют «жидкими кристаллами» или «кристаллической водой». Такая структура энергетически выгодна и разрушается с освобождением свободных молекул воды лишь при высоких концентрациях спиртов и подобных им растворителей [Зенин, 1994].
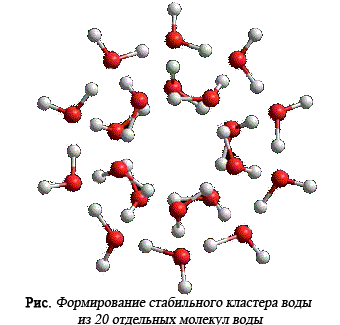

" Кванты воды" могут взаимодействовать друг с другом за счет свободных водородных связей, торчащих наружу из вершин «кванта» своими гранями. При этом возможно образование уже двух типов структур второго порядка. Их взаимодействие друг с другом приводит к появлению структур высшего порядка. Последние состоят из 912 молекул воды, которые по модели Зенина практически не способны к взаимодействию за счет образования водородных связей.

Этим и объясняется, например, высокая текучесть жидкости, состоящей из громадных полимеров. Таким образом, водная среда представляет собой как бы иерархически организованный жидкий кристалл.
Изменение положения одного структурного элемента в этом кристалле под действием любого внешнего фактора или изменение ориентации окружающих элементов под влиянием добавляемых веществ обеспечивает, согласно гипотезе Зенина, высокую чувствительность информационной системы воды. Если степень возмущения структурных элементов недостаточна для перестройки всей структуры воды в данном объеме, то после снятия возмущения система через 30−40 мин возвращается в исходное состояние. Если же перекодирование, т. е. переход к другому взаимному расположению структурных элементов воды оказывается энергетически выгодным, то в новом состоянии отражается кодирующее действие вызвавшего эту перестройку вещества [Зенин, 1994]. Такая модель позволяет Зенину объяснить «память воды» и ее информационные свойства [Зенин, 1997].
Кроме того, структурированное состояние воды оказалось чувствительным датчиком различных полей. С. Зенин считает, что мозг, сам состоящий на 90% из воды, может, тем не менее, изменять её структуру.
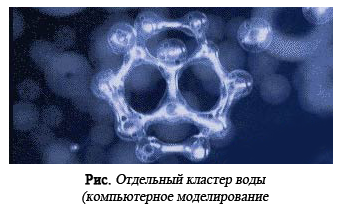
Кластерная модель воды объясняет её многие аномальные свойства.
Первое аномальное свойство воды — аномалия точек кипения и замерзания: Если бы вода — гидрид кислорода — Н2О была бы нормальным мономолекулярным соединением, таким, например, как ее аналоги по шестой группе Периодической системы элементов Д. И. Менделеева гидрид серы Н2S, гидрид селена Н2Se, гидрид теллура Н2Те, то в жидком состоянии вода существовала бы в диапазоне от минус 90 °C до минус 70 °C.

При таких свойствах воды жизни на Земле не существовало бы. Но к счастью для нас, и для всего живого на свете, вода аномальна. Она не признает периодических закономерностей, характерных для бесчисленного множества соединений на Земле и в космосе, а следует своим, еще не вполне понятным для науки законам, подарившим нам удивительный мир жизни.
" Ненормальные" температуры плавления и кипения воды — далеко не единственная анормальность воды. Для всей биосферы исключительно важной особенностью воды является ее способность при замерзании увеличивать, а не уменьшать свой объем, т. е. уменьшать плотность.

Это вторая аномалия воды, которая именуется аномалией плотности. На это особое свойство воды впервые обратил внимание еще Г. Галилей. При переходе любой жидкости (кроме галлия и висмута) в твердое состояние молекулы располагаются теснее, а само вещество, уменьшаясь в объеме, становится плотнее. Любой жидкости, но не воды. Вода и здесь представляет собой исключение. При охлаждении вода сначала ведет себя, как и другие жидкости: постепенно уплотняясь, она уменьшает свой объем. Такое явление можно наблюдать до +4°С (точнее до +3,98°С).
Именно при температуре +3,98°С вода имеет наибольшую плотность и наименьший объем. Дальнейшее охлаждение воды постепенно приводит уже не к уменьшению, а к увеличению объема. Плавность этого процесса вдруг прерывается и при 0 °C происходит резкий скачок увеличения объема почти на 10%! В это мгновение вода превращается в лед.
Уникальная особенность поведения воды при охлаждении и образовании льда играет исключительно важную роль в природе и жизни. Именно эта особенность воды предохраняет от сплошного промерзания в зимний период все водоемы земли — реки, озера, моря и тем самым спасает жизнь.
В отличие от пресной воды морская вода при охлаждении ведет себя иначе. Замерзает она не при 0 °C, а при минус 1,8−2,1°С — в зависимости от концентрации растворенных в ней солей. Имеет максимальную плотность не при + 4 °C, а при -3,5°С. Таким образом она превращается в лед, не достигая наибольшей плотности. Если вертикальное перемешивание в пресных водоемах прекращается при охлаждении всей массы воды до +4°С, то в морской воде вертикальная циркуляция происходит даже при температуре ниже 0 °C. Процесс обмена между верхними и нижними слоями идет непрерывно, создавая благоприятные условия для развития животных и растительных организмов.
Особенно благоприятной средой для обитателей морей и океанов являются талые воды, образующиеся при таянии ледников и айсбергов. В безбрежных просторах океанов плавающие горы-айсберги в основном скрыты под водой, однако могут представлять серьезную опасность для судоходства. Трагедией века была названа гибель «Титаника», которая произошла в результате столкновения суперлайнера с огромным айсбергом 14 апреля 1912 года.
Все термодинамические свойства воды заметно или резко отличаются от других веществ.
Наиболее важная из них — аномалия удельной теплоемкости. Аномально высокая теплоемкость воды делает моря и океаны гигантским регулятором температуры нашей планеты, в результате чего не происходит резкого перепада температур зимой и летом, днем и ночью. Континенты, расположенные вблизи морей и океанов, обладают мягким климатом, где перепады температуры в различные времена года бывают незначительными.
Мощные атмосферные потоки, содержащие огромное количество теплоты, поглощенное в процессе парообразования, гигантские океанические течения играют исключительную роль в создании погоды на нашей планете.
Аномалия теплоёмкости заключается в следующем: При нагревании любого вещества теплоемкость неизменно повышается. Да, любого вещества, но не воды. Вода — исключение, она и здесь не упускает возможности быть оригинальной: с повышением температуры изменение теплоемкости воды аномально; от 0 до 37 °C она понижается и только от 37 до 100 °C теплоемкость все время растет.
В пределах температур, близких к 37 °C, теплоемкость воды минимальна. Именно эти температуры — область температур человеческого тела, область нашей жизни. Физика воды в области температур 35−41°С (пределы возможных, нормально протекающих физиологических процессов в организме человека) констатирует вероятность достиже-ния уникального состояния воды, когда массы квазикристаллической и объемной воды равны друг другу и способность одной структуры переходить в другую — вариабельность — максимальная. Это замечательное свойство воды предопределяет равную вероятность течения обратимых и необратимых биохимических реакций в организме человека и обеспечивает «легкое управление» ими.
Другим общеизвестна исключительная способность воды растворять любые вещества. И здесь вода демонстрирует необычные для жидкости аномалии, и в первую очередь аномалии диэлектрической постоянной воды. Это связано с тем, что ее диэлектрическая постоянная (или диэлектрическая проницаемость) очень велика и составляет 81, в то время как для других жидкостей она не превышает 10. В соответствии с законом Кулона сила взаимодействия двух заряженных частиц в воде будет в 81 раз меньше, чем, например, в воздухе, где эта характеристика равна единице. В этом случае прочность внутримолекуляр-ных связей уменьшается в 81 раз и под действием теплового движения молекулы диссоциируют с образованием ионов. Необходимо отметить, что из-за исключительной способности растворять другие вещества вода никогда не бывает идеально чистой.
Следует упомянуть еще об одном удивительной аномалии воды — исключительно высоком поверхностном натяжении. Из всех известных жидкостей только ртуть имеет более высокое поверхностное натяжение. Это свойство проявляется в том, что вода всегда стремится сократить свою поверхность.
Нескомпенсированные межмолекулярные силы наружного (поверхностного) слоя воды, вызванные квантовомеханическими причинами, создают внешнюю упругую пленку. Благодаря пленке многие предметы, будучи тяжелее воды, не погружаются в воду. Если, например, стальную иголку осторожно положить на поверхность воды, то иголка не тонет. А ведь удельный вес стали почти в восемь раз больше удельного веса воды. Всем известна форма капли воды. Высокое поверхностное натяжение позволяет воде иметь шарообразную форму при свободном падении.
Поверхностное натяжение и смачивание являются основой особого свойств воды и водных растворов, названного капиллярностью. Капиллярность имеет огромное значение для жизни растительного, животного мира, формирования структур природных минералов и плодородия земли. В каналах, которые во много раз уже человеческого волоса, вода приобретает удивительные свойства. Она становится более вязкой, уплотняется в 1,5 раза, а замерзает при минус 80−70°С.
Причиной сверханомальности капиллярной воды являются межмолекулярные взаимодействия, тайны которых еще далеко не раскрыты.
Ученым и специалистам известна так называемая поровая вода. В виде тончайшей пленки она устилает поверхность пор и микрополостей пород и минералов земной коры и других объектов живой и неживой природы.
Связанная межмолекулярными силами с поверхностью других тел, эта вода, как и капиллярная вода, обладает особой структурой.
Таким образом, аномальные и специфические свойства воды играют ключевую роль в ее многообразном взаимодействии с живой и неживой природой. Все эти необычные особенности свойств воды настолько «удачны» для всего живого, что делает воду незаменимой основой существования жизни на Земле.