Общие положения.
Лекарственные препараты: антигипоксанты и антиоксиданты

Повреждение клетки — это типический патологический процесс, основу которого составляют нарушения внутриклеточного гомеостаза, приводящие к нарушению структурной целостности клетки и ее функциональных способностей. В зависимости от скорости развития и выраженности основных проявлений повреждение клетки может быть острым и хроническим, в зависимости от степени нарушения внутриклеточного… Читать ещё >
Общие положения. Лекарственные препараты: антигипоксанты и антиоксиданты (реферат, курсовая, диплом, контрольная)
Липиды — один из важнейших классов сложных молекул, присутствующих в клетках и тканях животных [3]. В состав этих малорастворимых в воде соединений, разнообразных по структуре, как правило, входят жирные кислоты или их производные. В организме животных липиды выполняют ряд важных функций.
Триацилглицериды (триацилглицеролы) служат энергетическим депо клетки. Фосфолипиды и гликолипиды входят в состав мембран, причем гликолипиды особенно важны при образовании миелиновой оболочки нервных клеток.
Производные жирных кислот — простаноиды (простагландины, простациклины, тромбоксаны) и лейкотриены, опосредуют межклеточные взаимодействия. Разнообразны функции стероидов: так холестерин (холестерол), ключевой промежуточный продукт синтеза стероидов, является также компонентом клеточной мембраны. Желчные кислоты синтезируются в печени из холестерина и способствуют эмульгированию липидов при переваривании пищи. В форме желчных кислот холестерин выводится из организма. Стероидные гормоны (глюкокортикоиды, минералокортикоиды, половые гормоны) являются важнейшими регуляторами процессов жизнедеятельности организма. Витамин Д (кальциферол) регулирует всасывание кальция в пищеварительном тракте. Разнообразие и уровень липидов в клетках, тканях и органах определяются, включающими их транспорт, поглощение, использование клетками, синтез de novo, разрушение и выведение.
Один из источников липидов в организме — их потребление с пищей с последующим всасыванием через стенки тонкого кишечника. кроме того, эндогенные липиды синтезируются из более простых соединений — продуктов метаболизма белков и углеводов. благодаря транспортным белкам липиды перемещаются по лимфои кровотоку и перераспределяются между органами и тканями. процесс транспорта включает в себя:
- 1) транспорт экзогенных липидов, поступающих с пищей, в печень;
- 2) транспорт эндогенных липидов, секретируемых печенью, в другие органы и ткани;
- 3) обратный транспортлипидов (в том числе холестерина) из периферических тканей в печень.
важную роль в транспорте липидов играют аполипопротеины и сывороточные амилоидные белки. при связывании липидов с аполипопротеинами образуются липопротеины высокой (лвп), низкой (лнп), очень низкой плотности (лонп), а также хиломикроны. в такой форме малорастворимые липиды переносятся по лимфои кровотоку разнообразны. участвуя в формировании липопротеинов, они способствуют переносу липидов от одних органов и тканей к другим.
Аполипопротеины влияют на активность ферментов липидного обмена — липазы и лецитин-холестерол-ацилтрансферазы (лхат), повышая или понижая ее. Они также являются лигандами для рецепторов клеточной поверхности, опосредующих поступление липидов в клетку. связывание аполипопротеинов в и е с этими рецепторами запускает перенос липидов внутрь клетки. сывороточные амилоидные белки (saa) также участвуют в транспорте липидов. При острофазном ответе содержание многих saa в плазме повышается и они замещают аполипопротеин, а. в свою очередь, это влияет на процессы обратного транспорта липидов из периферических тканей в печень.
Существенную роль в системе липидного метаболизма играют следующие наиболее значимые процессы:
- 1)липогенез — образование жирных кислот (жк) изболее простых предшественников с участием ацетил-коа;
- 2) эстерификацияжирных кислот, приводящая к образованию липидов;
- 3) мевалонатный путьсинтеза стероидов, использующий в качестве исходных соединений ацетил-коа и ацетоацетил-коа;
- 4) модификация жирных кислот, приводящая к образованию простагландинов, простациклинов и тромбоксанов.
К числу ключевых реакций относятся:
1) липолиз — расщепление липидов с образованием жирных кислот;
- 2) бета-окисление жирных кислот, одним изпродуктов которого является ацетил;
- 3) кетогенез — распад ацетил-коа собразованием кетоновых тел;
- 4) катаболизм холестерина, происходящий в печени, и приводящий к образованию желчных кислот.
Окончательные продукты распада липидов выводятся из организма в форме солей желчных кислот, нейтральных стероидов и кетоновых тел. В значительной степени эта связь осуществляется — через ацетил-коа, который является структурной единицей при построении углеводного скелета жирных кислот и стероидов, а кроме того — одним из продуктов распада как самих липидов, так углеводов и аминокислот. Синтез и разрушение липидов происходят практически во всех тканях организма. Вместе с тем, ряд тканей выполняют специализированные функции: так, поглощение экзогенных липидов происходит в стенках тонкого кишечника; запасание — в жировой ткани; выведение продуктов распада липидов — в кишечнике, почках, легких.
Центральное место в лм занимает печень, в которой происходит пересечение путей метаболизма липидов, углеводов и белков. здесь же синтезируется основная масса белков транспорта липидов, а также продукты деградации липидов, выводящиеся из организма.
Процессы липидного метаболизма происходят при участии множества белков с различными функциями, которые, как и, также являются компонентами системы липидного метаболизма.
Пероксидное окисление липидов играет важную роль в патогенезе повреждения клеток.
Повреждение клетки — это типический патологический процесс, основу которого составляют нарушения внутриклеточного гомеостаза, приводящие к нарушению структурной целостности клетки и ее функциональных способностей[1] . В зависимости от скорости развития и выраженности основных проявлений повреждение клетки может быть острым и хроническим, в зависимости от степени нарушения внутриклеточного гомеостаза — обратимым и необратимым, в зависимости от периода жизненного цикла, на который приходится действие повреждающего агента, — митотическим и интерфазным, в зависимости от инициирующих повреждение патогенетических механизмов — насильственным и цитопати-ческим. Насильственное повреждение развивается при действии на исходно здоровую клетку физических, химических и биологических факторов, интенсивность которых превышает обычные возмущающие воздействия, к которым клетка адаптирована. Цитопатический вариант возникает в результате первичного нарушения защитно-компенсаторных гомеостатических механизмов клетки. в этом случае факторами, запускающими патогенетические механизмы повреждения, являются естественные для данной клетки возмущающие стимулы, которые в этих условиях становятся повреждающими. к цитопатическому варианту относятся все виды повреждения клетки, вызываемые отсутствием каких-либо необходимых ей компонентов (при гипоксии, голодании, гипои авитаминозах, антиоксидантной недостаточности), и особенно сильно влияет пероксидное окисление липидов.
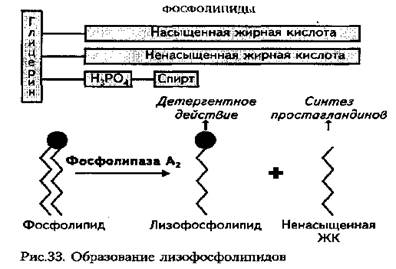
Пероксидным окислением липидов (пол) называется свободнорадикальное окисление ненасыщенных жирных кислот, входящих в состав фосфолипидов клеточных мембран. Инициаторами пол являются свободные радикалы, среди которых наибольшее значение имеют:'о2- (но'2) — супероксидный радикал; он' — гидроксильный радикал; н' — водородный радикал; `о2 — синглетный (возбужденный) кислород.
Появившийся в клетке первичный свободный радикал (а') взаимодействует с молекулой ненасыщенной жирной кислоты (i?h), в результате чего образуется свободный радикал этой кислоты (r') и молекулярный продукт реакции (на):
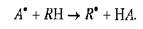
Образовавшийся свободный радикал жирной кислоты взаимодействует с молекулярным кислородом, всегда содержащимся в клетке, в результате чего появляется пероксидный радикал этой кислоты (roo'):

Пероксидный радикал, в свою очередь, вступает во взаимодействие с находящейся рядом новой молекулой ненасыщенной жирной кислоты. В ходе этой реакции образуется гидропероксид (жюн) и новый свободный радикал:
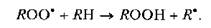
Следует отметить две важные особенности пол. Первая состоит в том, что реакции пол имеют цепной характер. Это означает, что в ходе реакций пол не происходит уничтожение свободных радикалов и в процесс вовлекаются все новые и новые молекулы ненасыщенных жирных кислот.
Вторая особенность — это разветвленный характер пол. Другими словами, в реакциях пол в возрастающем количестве появляются свободные радикалы, источником которых являются сами промежуточные продукты пол. Примером может служить образование свободных радикалов из гидропероксидов липидов при их взаимодействии с имеющимися в клетке металлами переменной валентности:
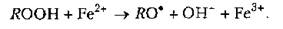
В виду того, что в ходе многих нормально протекающих биохимических реакций образуется небольшое количество свободных радикалов, в клетке существует постоянная опасность активации пол. Однако в естественных условиях этого не происходит, поскольку клетка располагает механизмами антиоксидантной защиты, благодаря которым достигается инактивация свободных радикалов, ограничение и торможение пол.
Активация пол происходит:
при избыточном образовании первичных свободных радикалов (ультрафиолетовое и ионизирующее излучение, гипероксия, отравление четыреххлористым углеродом, гипервитаминоз d и др.);
при нарушении функционирования антиоксидантных систем (недостаточность ферментов — супероксиддисмутазы, каталазы, глу-татионпероксидазы, глутатионредуктазы; дефицит меди, железа, селена; гиповитаминозы е, с; нарушения пентозного цикла).
При активации пол происходит нарушение барьерных функций клеточных мембран, в основе которого лежат следующие механизмы:
- 1. Ионофорный механизм обусловлен появлением в клетке веществ, обладающих свойствами ионофоров, т. е. соединений, способных облегчать диффузию ионов через мембрану благодаря образованию комплексов иона и ионофора, проходящих через ее слои. В процессе активации пол среди промежуточных продуктов его реакций появляются вещества-ионофоры по отношению к ионам кальция и водорода. В результате этого повышается проницаемость клеточных мембран к этим ионам.
- 2. Механизм электрического пробоя связан с существованием на многих мембранах (плазматической, внутренней митохондриальной) разности потенциалов. В результате появления гидрофильных продуктов пол нарушаются электроизолирующие свойства гидрофобного слоя клеточных мембран, что приводит к электрическому пробою мембраны, т. е. к электромеханическому ее разрыву с образованием новых трансмембранных каналов ионной проводимости.
В процессе активации пол нарушается матричная функция мембран. сущность матричной функции липидного бислоя мембран состоит в том, что в нем вмонтированы мембранные ферменты и некоторые специализированные белки.
В процессе пол нарушается активность мембранных ферментов, поскольку изменяется их липидное микроокружение, которое во многом определяет свойства белковых молекул. Кроме того, в ходе реакций пол происходит образование «сшивок» между молекулами белков и фосфолипидов, а также окисление сульфгидрильных групп активных центров, что приводит к необратимой инактивации ферментов.
В процессе пероксидного окисления липидов клеткой поглощается большое количество кислорода. В норме интенсивность этого процесса незначительна. он существенно активизируется при повреждении клеток. В дальнейшем это приводит к гипоксии. Гипоксия (кислородное голодание) — это типический патологический процесс, возникающий вследствие недостаточного снабжения тканей кислородом или в результате нарушения его использования клетками. нередко гипоксия не только осложняет течение заболевания, но и определяет его исход.
Оксидативный стресс, развивающийся в результате дисбаланса между оксидантной и антиоксидантной системами, играет важную роль в патогенезе хронического бронхита. При этом в крови и тканях достигают высоких концентраций продукты переокисного окисления липидов, в частности — малоновый альдегид, дестабилизирующий клеточные мембраны. Одной из причин дефицита «неферментативных» антиоксидантов — токоферола и аскорбата — у больных хроническим бронхитом является их повышенный расход. Кроме того, при тяжелом течении заболевания, осложненного хроническим легочным сердцем с недостаточностью кровообращения, наблюдается и выраженное снижение активности в крови ферментативных антиоксидантов (супероксиддисмутазы, каталазы).
Так же процесс свободно радикального окисления липидов биологических мембран имеет большое влияние на развитие многих патологий организма, в том числе и развитие атеросклероза, сердечно-сосудистых заболеваний и канцерогенеза.
В последние 10−15 лет проблема патогенеза заболеваний сердца, а также ряда других органов обогатилась раскрытием механизма повреждения клеточных структур. 4] Основным фактором повреждения оказался кислород — тот самый кислород, из-за недостатка которого возникает гибель клеток. Выяснилось, что так называемые активные формы кислорода (АФК), имеющие неспаренный электрон, обладают биологическим эффектом, который в зависимости от концентрации АФК может быть регуляторным или токсическим. Соответственно пробудился интерес и к соединениям, которые в обычных условиях предотвращают токсическое действие АФК — антиоксидантам. Окислительный стресс играет важную, если не ключевую роль в патогенезе старения и широкого спектра сердечно-сосудистых заболеваний, в том числе кардиомиопатии, атеросклероза, ИБС, клапанных поражений и застойной сердечной недостаточности Поэтому использование антиоксидантов для терапии и профилактике процесса старения и сердечных заболеваний выглядит вполне оправданным. В данном обзоре приведены краткие сведения о роли антиоксидантов в предупреждении окислительного стресса и профилактике сердечных заболеваний, причем число источников заведомо ограничено.
Главным источником АФК в клетках являются митохондрии. Обычно примерно 98% всего кислорода, поступающего в клетки, используется для окисления субстратов с образованием АТФ и выделением тепла, и лишь 2% используется в реакциях образования АФК [которое может значительно возрастать при усиленном поступлении кислорода в клетки или нарушении работы электронно-транспортной цепи митохондрий.
Ю.А. Владимиров выделяет три категории АФК: первичные, вторичные и третичные. Первичные АФК образуются при окислении некоторых молекул и обладают регуляторным или умеренным антимикробным действием. К ним относятся оксид азота NO, обладающий сосудорасширяющим действием, и супероксид ОО-, судьба которого может быть весьма разнообразной. Обычно при помощи специализированного фермента супероксиддисмутазы он превращается в перекись водорода Н2О2 и в дальнейшем — в гипохлорит ClO-. Оба эти соединения используются макрофагами для борьбы с бактериями. При недостаточной нейтрализации супероксида его избыток, взаимодействуя с NO, образует пероксинитрит или переводит трехвалентное железо Fe3+ в двухвалентное Fe2+, которое при взаимодействии с Н2О2, НClО и липоперекисями образует гидроксильный радикал ОН* или липоксильный радикал LO*. Эти радикалы, как и пероксинитрит, представляют категорию вторичных радикалов, именно эта категория обладает сильным токсическим действием вследствие своей способности необратимо повреждать мембранные липиды, а также молекулы ДНК, углеводов и белков. При соединении вторичных радикалов с молекулами антиоксидантов и других легко окисляющихся соединений образуются третичные радикалы. Их роль может быть различной.
Для определения концентрации АФК используют электронный парамагнитный резонанс (ЭПР) и метод хемилюминесценции, однако измерение оказывается весьма затруднительным из-за крайне низких концентраций, поэтому на практике используют соединения, позволяющие многократно усиливать сигналы. Для ЭПР это спиновые ловушки, образующие стабильные нитроксильные радикалы, а для хемилюминесценции — так называемые усилители типа люцигенина или люминола Повреждающее действие АФК на клетки прослеживается в условиях, способствующих их избыточному образованию. Классическим примером может служить реперфузия миокарда после периода ишемии, сопровождающаяся развитием повреждений, сопоставимых по степени с возникшими в результате самой ишемии. Механизм образования АФК при реперфузии, вероятно, обусловлен созданием условий, благоприятствующих образованию вторичных радикалов Во время ишемии парциальное давление кислорода в кардиомиоцитах резко снижается, и это сопровождается переходом окисленных атомов железа Fe3+ в восстановленные Fe2+, а также повышением активности ксантиноксидазы. Оба эти компонента при появлении в цитоплазме больших количеств кислорода в начале реперфузии резко активируют образование ОН*, и возникающее под действием этого радикала повреждение клеточных структур может приобретать необратимый характер, что вызывает развитие апоптоза. Хорошо известно, что повреждающее миокард действие токсических доз изопротеренола или адриамицина также реализуется посредством усиленного образования АФК.
Повреждающее действие могут оказывать все АФК, но наиболее токсичными оказываются вторичные радикалы. Повреждающее действие смеси ксантиноксидазы и пурина на изолированное сердце крысы не проявлялось в условиях, когда на миокард действовал только супероксид, но было сильно выражено в условиях, способствующих образованию вторичных радикалов из Н2О2. Оно выражалось в 4-кратном снижении скорости развития давления, 3-кратном снижении содержания АТФ, гликогена, набухании митохондрий и дезинтеграции сарколеммы. В наших опытах на том же объекте введение перекиси водорода Н2О2 в постепенно возрастающих концентрациях оказывало обычный отрицательный инотропный эффект на изоволюмическое сердце — снижение развиваемого давления и повышение конечнодиастолического давления Такой эффект характерен для многих факторов, действие которых сопряжено с нарушением энергообразования в кардиомиоцитах. Однако в отличие от этого спонтанная частота сокращений не снижалась, как можно было ожидать, а напротив, повышалась при введении Н2О2 в умеренных дозах. Принимая во внимание, что активация синусного узла происходит при открытии медленных Са2+ каналов сарколеммы, полученный результат может указывать на повышение кальциевой проницаемости мембран.

Рис. Кривые «доза-эффект» при введении Н2О2 в перфузат изоволюмического сердца крыс (n=9) для ЧСС (кружочки), РД (квадраты) и КДД (ромбы). Сердце перфузировали через аорту с постоянной скоростью 14 мл/мин., давление в латексном баллончике постоянного объема характеризовало силу сокращения миокардиальных волокон при постоянной степени их растяжения. Изменения показателей взяты через 10 мин. от начала действия каждой концентрации Н2О2 (M+m).
Возникшая в процессе эволюции «побочная» ветвь использования кислорода в силу своей потенциальной опасности для клеточных структур, естественно, нуждалась в достаточном развитии защитных механизмов. Действительно, сейчас известен целый ряд соединений, обладающих антиоксидантными свойствами. Они представлены ферментами и низкомолекулярными соединениями. Последние в зависимости от своей локализации подразделяются на гидрофильные и липофильные Возникшая в процессе эволюции «побочная» ветвь использования кислорода в силу своей потенциальной опасности для клеточных структур, естественно, нуждалась в достаточном развитии защитных механизмов. Действительно, сейчас известен целый ряд соединений, обладающих антиоксидантными свойствами. Они представлены ферментами и низкомолекулярными соединениями. Последние в зависимости от своей локализации подразделяются на гидрофильные и липофильные (рис. 2).

Рис. Схема антиоксидантной защиты клеток.
Среди гидрофильных соединений в первую очередь следует выделить супероксиддисмутазу (СОД), представляющую первое звено защиты. Этот фермент переводит супероксидный радикал в электронейтральную форму Н2О2. Судьба последней зависит от активности двух ферментов, разрушающих молекулу, — каталазы, образующей Н2О и О2, и глутатионпероксидазы, образующей глутатион. Кроме того, Н2О2 в качестве нейтральной молекулы может покинуть клетку. Помимо ферментных систем, в цитоплазме присутствуют различные низкомолекулярные вещества, также обладающие антиоксидантными свойствами, хотя механизм их действия может быть различным. Так, например, аскорбиновая кислота способна перехватывать электроны и тем самым служить ловушкой радикалов. В отличие от этого дипептид карнозин, присутствующий в мышечных клетках в довольно высокой концентрации, способен связывать катионы железа, снижая тем самым его возможную роль в образовании ОН* [4].
Особенностью перекисного окисления в мембранах следует считать его цепную реакцию с разрушением ненасыщенных жирных кислот, входящих в состав фосфолипидов мембран. Поэтому в мембранах присутствуют собственные липофильные антиоксиданты, среди которых основными являются убихинон и a-токоферол.