Методы УФ-спектрофотометрии, основанные на собственном поглощении

Спектрально неактивные в этой области Д5(10)-3-кетоны спектрофотометрически можно определять, измеряя поглощение соответствующего Д4−3-кетона, поскольку первые можно легко перевести в последний путем кислотного или щелочного катализа. Определение норэтинодрела обычно проводят после выдерживания реакционной смеси в течение 1 ч или кипячения в течение 5 мин с 0,5 М соляной кислотой. Каталитическое… Читать ещё >
Методы УФ-спектрофотометрии, основанные на собственном поглощении (реферат, курсовая, диплом, контрольная)
Наиболее характерными стероидными гормонами, которые обладают собственным поглощением, используемым в количественном анализе, являются б, в-ненасыщенные кетоны, сопряженные диены и соединения, содержащие фенольное кольцо А.
б, в-Ненасыщенные кетоны Наиболее часто встречающиеся сопряженные кетогруппы — это Д4-3-кетои Д1,4-3-кетогруппы с максимумом поглощения в этанольной среде соответственно при 240 и 244 нм и молярным коэффициентом поглощения примерно 17 000. На рис. 1 представлены два характерных спектра поглощения, а также спектр менее важного Д4'6-3-кетопроизводного.
Как показано на рис. 1, спектры Д4-3-кетои Д1,4-3-кетостероидов имеют большое сходство; единственное существенное их отличие состоит в наличии плеча в спектре последнего в области 266 нм. Это позволяет проводить их одновременное определение в соизмеримых количествах в бинарных смесях методом отношений оптических плотностей. Менее сложный случай представляет одновременное определение Д4,6-3-кето-и Д4,6-3-кетостероидов по их поглощению при 238 и 280 нм. При больших длинах волн можно определять следовые количества продуктов разложения типа Д4,6-3-кетосоединений в спиронолактонах.
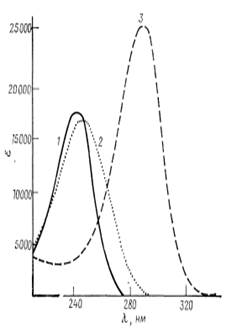

Рис. 1. УФ — Спектры ненасыщенных 3 — кетостероидов в метаноле
Помимо простых случаев анализа промышленных кетостероидов в массе продукта непосредственное спектрофотометрическое измерение возможно только при анализе некоторых не слишком сложных лекарственных дозированных форм (см. различные фармакопеи), проб воздуха и т. п. Однако, как правило, спектрофотометрическое определение осложняется мешающим влиянием сопутствующих компонентов или основы образца. В таких случаях следует пользоваться методами измерения при разных длинах волн, избирательной экстракцией, хроматографическими методами разделения или, возможно, методом с применением борогидрида натрия.
Спектрофотометрические методы имеют еще большее значение после проведения предварительного хроматографического разделения. Спектрофотометрия в УФ-области — идеальный способ контроля за выходом конъюгатов кетостероидов при элюировании и для их определения после разделения на хроматографической колонке. Реже спектрофотометрические методы определения применяются после разделения методом тонкослойной хроматографии и элюирования пятна; в этих случаях обычно проводят колориметрическое измерение.
Для определения Д4— и Д1,4-З-кетостероидов в растворах при ферментации, масляных препаратах для инъекций, мазях [1] и низкодозированных таблетках [2] Гёрёг предложил дифференциальный спектрофотометрический метод, основанный на восстановлении этих производных борогидридами щелочных металлов до соответствующих спектрально неактивных 3-оксипроизводных.
Рис. 2.
Если в кювету сравнения поместить раствор восстановленного Д4-3-кетостероида (1 мг кетостероида и 0,1 г борогидрида натрия растворяют в 10 мл метанола и через 15 мин разбавляют метанолом до 100 мл), а в рабочую кювету — раствор не восстановленного соединения с той же концентрацией, то разность оптических плотностей при 240 нм отвечает содержанию ненасыщенного кетона. Конечно, этот метод дает приемлемые результаты, только если сопутствующие компоненты и неизвестные примеси, дающие фоновое излучение, не реагируют с борогидридом натрия и, следовательно, дифференциальный спектр смеси при длинах волн выше 230 нм идентичен истинному спектру чистого кетостероида. Это иллюстрируется рис. 1, на котором представлены спектры метанольного экстракта масляного препарата для инъекций, содержащего прогестерон и бензоат эстрадиола; кривая 1 — это суммарный спектр двух стероидов, бензилового спирта (в качестве стабилизирующего агента) и небольшого количества масла, соэкстрагирующего с исследуемыми компонентами. Кривая 2 представляет дифференциальный спектр, почти идентичный спектру прогестерона, что указывает на устранение влияния поглощения всех других компонентов.
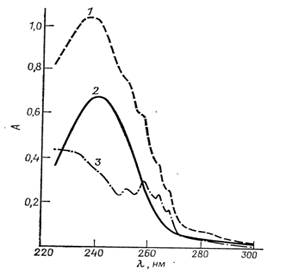
Спектрально неактивные в этой области Д5(10)-3-кетоны спектрофотометрически можно определять, измеряя поглощение соответствующего Д4-3-кетона, поскольку первые можно легко перевести в последний путем кислотного или щелочного катализа [реакция (4)]. Определение норэтинодрела обычно проводят после выдерживания реакционной смеси в течение 1 ч или кипячения в течение 5 мин с 0,5 М соляной кислотой. Каталитическое действие гидроксид-иона в этой реакции примерно в 300 раз эффективнее, чем иона водорода. Поэтому при комнатной температуре даже при 0,01 М концентрации гидроксида натрия в течение 1 ч происходит количественное превращение, что позволяет проводить избирательное определение норэтинодрела в отдельных противозачаточных таблетках методом дифференциальной спектрофотометрии.
Рис. 4.
3,5-Диены Как видно из рис. 4, незамещенные 3-алкоксипроизводные (енольная форма простых эфиров) и 3-ацилоксипроизводные (енольная форма сложных эфиров) обладают высоким светопоглощением.
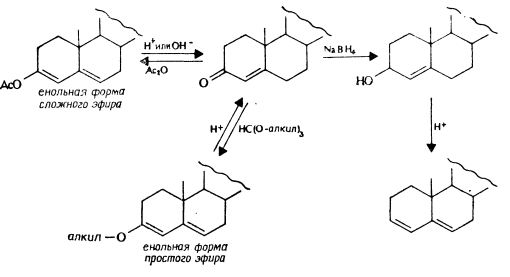
Рис. 5.
Поскольку все они являются производными Д4-3-кетонов [реакция (5)], а последние в свою очередь — продуктами разложения енольных простых и сложных эфиров, Д4-3-кетоны могут оказаться потенциальными примесями. Это осложняет определение енольных форм эфиров, потому что все эти соединения имеют весьма схожие спектры (см. рис. 2 и 3).

Рис. 6. УФ — Спектры 3,5 — диенов в метаноле
Как видно из реакции (5), Д4-3-окси-, а также ацилоксипроизводные можно превратить в 3,5-диены путем катализируемого кислотами удаления воды или карбоновых кислот, и, следовательно, по поглощению образующихся 3,5-диенов можно определить эти спектрально-неактивные производные. Используя соляную кислоту в качестве катализатора, можно определить диацетат этинодиола даже в отдельных таблетках [2].
Из 3-б-эпимеров вода удаляется примерно в пять раз быстрее, чем из Зв-эпимеров.
Фенольное кольцо А
На рис. 7 представлены четыре характеристических спектра эстрогенов, содержащих фенольное кольцо А (в форме свободного фенола, фенолят-иона, простого эфира и сложного эфира). Эти спектры очень характеристичны, но из-за несколько низкой интенсивности поглощения к использованию УФ-спектрофотометрии для количественных определений нужно подходить с большой осторожностью, поскольку возможности непосредственного измерения без предварительного разделения или введения поправки на поглощение фона очень ограниченны.
![УФ-Спектры стероидов, содержащих фенольное кольцо А [(растворитель - смесь метанола с водой (4:1)].](/img/s/9/80/2198580_9.jpg)
![Рис. 7. УФ-Спектры стероидов, содержащих фенольное кольцо А [(растворитель - смесь метанола с водой (4:1)].](/img/s/9/80/2198580_10.png)
Рис. 7. УФ-Спектры стероидов, содержащих фенольное кольцо, А [(растворитель — смесь метанола с водой (4:1)]
Приведем один из многочисленных примеров, когда УФ-спектрофотометрию использовали для количественного определения после хроматографического разделения. Так, Шрёдер и др. проводили разделение эстрона, эстрадиола, эквилина и эквиленина на пластинке, покрытой силикагелем, после кислотного гидролиза их сульфатов и экстракции свободного фенола хлороформом. Первые три соединения экстрагируют 1%-ным водным раствором гидроксида натрия и измеряют поглощение их ионных форм при 296 нм, а присутствующий в низких концентрациях эквиленин экстрагируют метанолом и измеряют его поглощение при 231 нм, когда чувствительность измерения намного выше.
В некоторых методиках, предложенных для определения эстрогенов, проблемы, связанные с поглощением фона, были решены с привлечением химических или математических методов. В большинстве из них описывается определение малых количеств эстрогенов в присутствии больших количеств кетостероидов, когда малоинтенсивные полосы кетостероидов, обусловленные п—р-переходами, мешают определению. Для анализа противозачаточных таблеток, в которых соотношение кетостероидов и эстрогенов не очень велико, достаточно использовать один из вариантов метода базисной линии, как это сделали Кий и Шрофф и Гродски. В последней работе авторы повысили избирательность измерения, применив селективную экстракцию эстрогенов метилциклогексаном. Бруннер и Кунц [3] описали метод определения местранола в различных смесях, сочетающий разделение колоночной хроматографией и УФ-спектрофотометрическое измерение с поправкой на поглощение холостого раствора.
При определении примесей эстрогенов в 19-норстероидах отношение кетостероид/эстроген обычно составляет от 100 до 10 000. Столь малые количества эстрогенов нельзя определить даже с помощью метода базисной линии, поскольку поглощение фона больше поглощения определяемых компонентов. Для решения этой проблемы Легран и др. восстанавливали кето-группу кетостероидов борогидридом калия в щелочном растворе метанола, что привело к почти полному устранению поглощения фона. Остаточное поглощение фона можно легко учесть, используя метод базисной линии. Этот метод позволяет определить до 0,01% эстрогенов в 19-норстероидах. По сути дела тот же метод использован в работе Бестоу и рекомендован Британской фармакопеей [4] для определения местранола в противозачаточных таблетках Гёрёг и Чизер упростили этот метод, заменив борогидрид калия борогидридом натрия и исключив гидроксид натрия, что позволило сократить время реакции с 6,5—18 ч до 15 мин.
Наличие батохромных и гиперхромных сдвигов в спектрах чистых эстрогенов в щелочной среде (около 0,2 М гидроксида натрия; см. рис. 7) открывает новые возможности для их селективного определения.
Селективность и чувствительность измерения поглощения щелочных растворов эстрогенов относительно раствора холостого опыта увеличиваются по сравнению с селективностью и чувствительностью измерения поглощения нейтрального раствора, на чем в фармакологии основано несколько методик определения стероидов.
Избирательность измерения можно увеличить еще больше, поместив в кювету сравнения раствор исследуемого материала в недиссоциированной форме с такой же концентрацией. В этом варианте дифференциального спектрофотометрического метода устраняется мешающее влияние поглощающих неионизированных веществ. Метод, рекомендуемый фармакопеей XX США для определения валерата эстрадиола в масляных препаратах для инъекций в отсутствие кетостероидов, можно использовать для анализа препаратов для инъекций с высоким содержанием стероида (выше 10 мг/мл), если в кювету сравнения помещать кислый (0,02 М), а в рабочую кювету — сильнощелочной (0,6 М) раствор. Гёрёг повысил избирательность этого метода, используя раствор с рН 9 (боратный буфер) в качестве раствора сравнения (фенольная оксигруппа еще не ионизирована), создавая в растворе пробы 0,2 М концентрацию щелочи и предварительно восстанавливая кетостероиды борогидридом натрия. В этом варианте удалось полностью устранить мешающее влияние примесей, поглощение которых изменяется как в интервалах рН 2—9, так и при концентрации щелочи 0,2—0,6 М; окисление Д4-3-кетонов кислородом воздуха в щелочной среде также не оказывает мешающего влияния. Измерение разности оптических плотностей при 300 нм позволяет проводить количественный анализ низкодозированных препаратов для инъекций даже в присутствии больших количеств кетостероидов.
При помощи дифференциального спектрофотометрического метода, проводимого в щелочной среде, можно определять свободные эстрогены и их сложные эфиры (последние в щелочной среде быстро гидролизуются). Простые эфиры, конечно, не вступают в реакцию, но их фенольные производные реакционноспособны, что позволяет селективно определять их примеси.
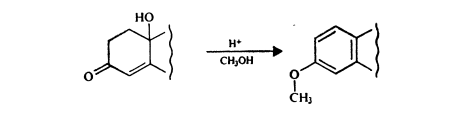
(8).
Как видно из уравнения (8), в метанольной среде в присутствии соляной кислоты 10в-окси-4-ен-3-кетоны (примеси 19-нор-4-ен-3-кетонов) можно количественно перевести в соответствующее фенольное производное простого эфира. С помощью этой реакции и вышеупомянутого спектрофотометрического метода определения стероидов фенольного типа Гёрёг определил следовые количества таких веществ.