Извлечение церия сорбционным методом

В работе изучена сорбция церия в виде анионных сульфатных комплексов на слабоосновном полистирольном хелатном анионите D-403 в сульфатной форме. Активной функциональной группой является третичный атом азота с оксигидрильными группами, которые снижаю снижают подвижность неподеленной электронной пары атома азота за счет индуктивного эффекта. Значения константы ионного обмена, определенное… Читать ещё >
Извлечение церия сорбционным методом (реферат, курсовая, диплом, контрольная)
Извлечение церия сорбционным методом
В работе изучен сорбционный метод извлечения церия в виде анионных сульфатных комплексов на селективной ионообменной смоле D-403. Рассчитаны термодинамические характеристики сорбции дисульфатоцеррат-ионов: константы ионообменного равновесия, значения емкости анионита, предельной сорбции комплексных ионов и значения энергии Гиббса ионного обмена.
Уникальные физико-химические свойства РЗЭ определяют возможность их широкого использования в различных областях промышленности как в виде неразделенных РЗЭ, так и в виде индивидуальных. Наиболее устойчивый спрос прогнозируется на индивидуальные лантаноиды средней группы.
Несмотря на сравнительно отчетливую химическую специфичность группы РЗЭ, выделение лантаноидов из растворов сложносолевого состава представляет далеко не простую задачу. Актуальность работы обусловлена необходимостью получения новых термодинамических данных по сорбции лантаноидов на ионообменных смолах, позволяющих выбрать селективные аниониты для извлечения и концентрирования РЗЭ из разбавленных растворов с целью увеличения эффективности использования анионообменных смол при переработке низконцентрированного редкоземельного сырья.
Целью работы являлось определение термодинамических характеристик сорбции комплексных ионов церия на ионообменной смоле D-403 из растворов сложносолевого состава путем изучения ионообменных процессов.
В работе изучена сорбция церия в виде анионных сульфатных комплексов на слабоосновном полистирольном хелатном анионите D-403 в сульфатной форме. Активной функциональной группой является третичный атом азота с оксигидрильными группами, которые снижаю снижают подвижность неподеленной электронной пары атома азота за счет индуктивного эффекта.
Сорбцию проводили из модельных растворов нитрата церия с добавление в качестве комплексообразующего агента сульфат магния. Эксперимент проводился в статических условиях методом переменных концентраций в интервале рН от 2 до 4, концентрации сульфата магния 2 моль/кг при температуре 298 К.
Величину сорбции Г (моль/кг) анионитом D-403 дисульфатоцеррат-ионов определяли по формуле (1):

где С0 и С? — исходные и равновесные концентрации ионов церия в исследуемом растворе, моль/кг; V, r -объем и плотность раствора; m -масса сухого анионита.
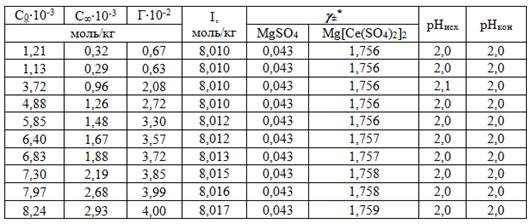
В таблице 1 представлены значения исходных и равновесных концентраций ионов церия С0 и С?, моль/кг; величины сорбции Г, моль/кг; ионная сила раствора I, моль/кг, среднеионные коэффициенты активности g± MgSO4 и g± Mg[Ce (SO4)2]2, взятые из табличных данных среднеионных коэффициентов активностей [1].
сорбционный церий селективный ионообменный.
Таблица 1. Результаты эксперимента по сорбции дисульфатоцеррат-ионов на анионите D-403 при значениях рН=2, 3, 4.

![*Среднеионные коэффициенты активности для Mg[Ce(SO4)2]2 принимали равными для MgCl2 при данной ионной силе.](/img/s/9/21/2308221_4.jpg)
*Среднеионные коэффициенты активности для Mg[Ce (SO4)2]2 принимали равными для MgCl2 при данной ионной силе.
На рисунке 1 приведены изотермы сорбции сульфатных комплексов церия, построенные на основании данных таблицы 1.
Рисунок 1. Изотермы сорбции анионных сульфатных комплексов церия на анионите D-403 в сульфатной форме при значении рН 2,3,4.
Термодинамическое описание изотермы сорбции сульфатных комплексов церия проведено методом [2, 3], основанным на линеаризации уравнения закона действующих масс, модифицированного для реакций ионного обмена при допущениях, что коэффициенты активности в твердой фазе равны единице, т. е. твердая фаза является идеальной [4,5] и зависимости среднеионных коэффициентов активностей электролитов от зарядов ионов и ионной силы раствора и их слабой зависимости от индивидуальной природы аниона [1, 6].
Выбор вида аппроксимирующего уравнения при определении среднеионных коэффициентов активности электролитов определялся исходя из наиболее достоверного математического описания справочных данных.
С целью определения значений константы ионообменного равновесия и предельной сорбции ионов [Ce (SO4)2-] и SO42- на анионите D-403 предположили два возможных варианта ионного обмена по реакциям (2) и (3):
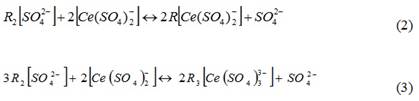
Для реакций ионного обмена (2) и (3) сульфатных комплексов церия выразили значение константы ионообменного равновесия по формулам (4) и (5):
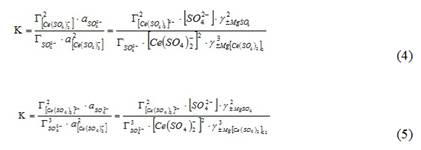
где К — кажущаяся константа обмена; и — значения концентраций аниона в фазе ионита, моль/кг (сухого ионита); - равновесное количество cульфат-ионов в фазе ионита, моль/кг; - активности ионов в растворе; г± — среднеионные коэффициенты активности соответствующих электролитов.
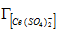
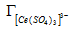
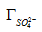
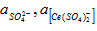
Линейные формы уравнений закона действующих масс учетом математического преобразования имеют вид:

По значению линейного члена представленных зависимостей обратных величин концентрации дисульфатоцеррат-ионов в фазе ионита и от аргумента f (c) с учетом доли сульфатных комплексов церия в растворе, равной 0,94 от общего содержания ионов церия:
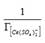
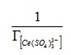

оценили величину предельной сорбции анионита D-403, значение которой совпало со значением по сертификату (1,22 экв/кг) только из уравнения (3).
Рассчитанное значение по уравнению (7) составило 0,14±0,03 экв/кг при низкой величине достоверности аппроксимации R2 < 0,70, на основании чего можно сделать вывод о протекании ионного обмена по уравнению (3).
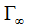
В таблице 2 представлены значения обратных концентраций дисульфатоцеррат-ионов в фазе анионита от аргумента (9), на основании которых построены линейные зависимости, приведенные на рисунке 2.
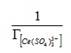
Таблица 2. Значения обратных концентраций дисульфатоцеррат-ионов в фазе анионитаот аргумента f©, рассчитанного по формуле (51).
рН=2. | рН=3. | рН=4. | ||||
1/Г. | f©. | 1/Г. | f©. | 1/Г. | f©. | |
148,95. | 209,61. | 260,48. | 367,71. | 283,37. | 389,36. | |
158,73. | 227,26. | 110,97. | 151,77. | 135,05. | 184,87. | |
48,16. | 65,23. | 81,35. | 112,07. | 127,80. | 170,89. | |
36,72. | 51,37. | 61,11. | 85,86. | 59,25. | 96,94. | |
30,34. | 43,52. | 31,85. | 46,83. | 28,69. | 40,58. | |
28,01. | 40,85. | 26,94. | 35,30. | 25,91. | 30,35. | |
26,85. | 37,13. | 26,92. | 34,48. | 24,94. | 27,32. | |
25,97. | 33,20. | 25,78. | 32,43. | 24,88. | 26,58. | |
25,07. | 28,67. | 25,58. | 31,14. | 24,78. | 25,34. | |
25,00. | 27,60. | 24,89. | 29,25. | 283,37. | 389,36. | |
![Линейная форма изотерм сорбции ионов [Ce(SO4)2-] на анионите D-403 при рН=2ч4.](/img/s/9/21/2308221_17.jpg)
Рисунок 2. Линейная форма изотерм сорбции ионов [Ce (SO4)2-] на анионите D-403 при рН=2ч4.
Обработка методом наименьших квадратов позволила получить следующие аппроксимирующие уравнения для сорбции ионов [Ce (SO4)2-] по реакции (3):

Значение предельной концентрации ионов в фазе ионита составило при значении рН=2 экв/кг, при рН=3 экв/кг, при рН=4 экв/кг.
Таким образом, величина суммарной сорбции дисульфатоцеррати сульфат-ионов в пределах погрешности совпала с указанной емкостью по сертификату анионита D-403, равной 1,22±0,02 экв/кг, и не зависит от величины рН раствора. Низкое значение предельной сорбции сульфатных комплексов церия, равное 0,040±0,001 моль/кг (рисунок 4) объясняется конкуренцией в ионном обмене сульфат-ионов.
Совпадение величины предельной сорбции ионов из сульфатных растворов с емкостью анионита D-403 по сертификату, равной 1,22±0,02 экв/кг, подтверждает протекание процесса ионного обмена по предложенной реакции.

Значения константы ионного обмена, определенное по угловому коэффициенту в уравнениях (10)-(12): и дифференциальной энергии Гиббса для рассмотренной формы дисульфатоцеррат-иона составляют К=1,69±0,08 и DrG298= _1,30±0,06 кДж/моль при рН=2; К=1,69±0,08 и DrG298= _1,30±0,06 кДж/моль — рН=3; К=1,66±0,08 и DrG298= _1,26±0,06 кДж/моль — рН=4.
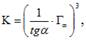
Таким образом, в пределах погрешности значения константы ионообменного равновесия и предельной сорбции ионов [Ce (SO4)2-] не зависят от значения рН исследуемого раствора. Средние значения составили: К=1,68±0,08 и DrG298= _1,27±0,06 кДж/моль.
По полученным экспериментальным данным можно сделать вывод о возможности использования анионита D-403 для извлечения церия в виде анионных сульфатных комплексов из сложносолевых растворов.
- 1. Краткий справочник физико-химических величин. Изд. 10-е / Под ред. А. А. Равделя и А. М. Пономаревой. — СПб.: «Иван Федоров», 2003 — 240 с.
- 2. Чиркст Д. Э., Черемисина О. В., Чистяков А. А. и др. Сорбция германия на анионите из щелочных растворов// ЖПХ. — 2008. — Т. 81, Вып.1. — С. 41−45.
- 3. Чистяков А. А., Чиркст Д. Э., Черемисина О. В. Сорбция алюмината из щелочных растворов на анионите В-403// ЖФХ. — 2011. — Т.85. Вып.11. — С. 2137−2142.
- 4. Стромберг А. Г. Физическая химия: учебное пособие для вузов. / А. Г. Стромберг, Д. П. Семченко. — М.: Высшая школа, 1973. — 480 с.
- 5. Кокотов Ю. А. Равновесие и кинетика ионного обмена // Ю. А. Кокотов, В. А. Пасечник. — Л.: Химия, 1970. — 336 с.
- 6. Справочник химика / Под ред. Никольского Б. П. — Спб., Москва: «Химия», 1965. — Т. 3. — 1008 с.