Оптимизация условий постановки ПЦР-РВ для диагностики pasteurella multocida

Поиск полных нуклеотидных последовательностей штаммов возбудителя Pasteurella multocida, подбор и конструирование специфических праймеров. Сбор имеющихся нуклеотидных последовательностей, как полных геномов, так и отдельных генов возбудителя Pasteurella проводили из различных международных баз данных. Поиск проводился в трех широко известных базах данных по ДНК последовательностям: Ген банк… Читать ещё >
Оптимизация условий постановки ПЦР-РВ для диагностики pasteurella multocida (реферат, курсовая, диплом, контрольная)
Pasteurella multocida широко распространены в природе и вызывают заболевание у многих видов животных, нанося большой экономический ущерб. Заболевание наблюдается почти во всех странах мира. В Казахстане заболевание P. multocida чаще встречается среди диких животных (сайгаки). Например, массовая гибель сайгаков от пастереллеза в Казахстане наблюдалась в 1981, 1984, 1988, 2010, 2011 и 2012 гг. На территории бывшей Тургайской области в мае 1981 г. от пастереллеза погибло около 100 тыс., в мае 1988 г. — около 270 тыс., в Волго-Уральском междуречье в феврале-марте 1984 г. — более 100 тыс. сайгаков. В 2010 году от заболевания пало 11 920 голов, 26−27 мая 2011 года в период окота в Жанибекском районе Западно-Казахстанской области произошел падеж сайгаков в количестве 441 особи, в т. ч. 364 самки и 77 ягнят, 2012 году в Костанайской области найдены туши 290 животных. Ущерб природе от массовой гибели сайгаков в 2010 году составил более 2 миллиардов тенге [1, 2, 3].
В связи с этим для своевременной локализации и ликвидации инфекционных болезней сайгаков, необходимо точно идентифицировать то или иное заболевание, которое вызывает гибель животных. Для этого необходимы современные средства диагностики. В настоящее время наиболее перспективными методами идентификации возбудителей болезней людей, животных и птиц в мире часто используются молекулярные методы, такие как полимеразная цепная реакция (ПЦР) и полимеразная цепная реакция в реальном времени (ПЦР-РВ). ПЦРтесты отличаются простотой постановки, экспрессностью, высокой чувствительностью и специфичностью.
ПЦР-РВ — лабораторный метод, основанный на полимеразной цепной реакции, используемый для одновременной амплификации и измерения количества данной молекулы ДНК. Метод ПЦР-РВ включает в себя одновременно детекцию и количественное определение (измерение непосредственно количества копий, либо измерение копий относительно внесенной ДНК или дополнительных калибровочных генов) специфической последовательности ДНК в образце [4].
ПЦР-РВ сочетает в себе достоинства классической ПЦР (высокую чувствительность, специфичность, быстроту получения результатов) и одновременно обладает рядом преимуществ. Регистрация результатов реакции в режиме реального времени позволяет отказаться от электрофореза продуктов ПЦР, что сокращает продолжительность анализа и в два раза уменьшает вероятность ложноположительных результатов из-за контаминации исследуемых проб продуктами амплификации [5, 6].
В связи с этим, целью нашего исследования являлось — оптимизация условий постановки ПЦР-РВ для диагностики возбудителя Pasteurella multocida, который ежегодно вызывает заболевание и гибель сайгаков на территории Республики Казахстан.
1. Материалы и методы
Возбудитель: В эксперименте использовали агаровую культуру штаммов:
Saigas/2011/ZKO/KZ Pasteurella multocida, B. abortus- 19S, E. coli: BL16.
Мутанты возбудителя Pasteurella multocida: Р. м (S) Ste mytaut, Р. м кл 05.04.13 AroA mytaut.
- 20% суспензия, приготовленная из легких, печени, сердца здорового мышонка;
- 20% суспензия, приготовленная из легких, печени, сердца павшего от Pasteurella multocida мышонка.
Выделение ДНК возбудителей Выделение ДНК проводили с использованием набора «QIAamp® Viral DNA Miniand Blood Mini Hand book» в соответствии с наставлением по применению данного набора.
Поиск полных нуклеотидных последовательностей штаммов возбудителя Pasteurella multocida, подбор и конструирование специфических праймеров. Сбор имеющихся нуклеотидных последовательностей, как полных геномов, так и отдельных генов возбудителя Pasteurella проводили из различных международных баз данных. Поиск проводился в трех широко известных базах данных по ДНК последовательностям: Ген банк (GenBank, USA), Европейская лаборатория Молекулярной биологии (EMBL Nucleotide Sequence Database, Europe) и Японская база данных ДНК (DNA Database Bank of Japan), доступная на сайте National Centre for Biotechnology Information (NCBI). Были отобраны последовательности генов наиболее комплементарных между видами рода Pasteurella.
Конструирование праймеров проводили с использованием программы Oligo 7.
Полученные с помощью программы праймеры, проверяли на специфичность с использованием программы BLAST.
Результаты и обсуждение На начальном этапе, при подборе праймеров и зондов, первостепенной задачей является поиск нуклеотидных последовательностей в международных базах данных по последовательностям нуклеотидов интересующих геномов бактерий.
С целью подбора праймеров для постановки ПЦР в реальном времени, были выбраны 4 гена Pasteurella multocida subsp. multocida str. Pm70 (AE004439) — InfB, sodA, rpoB, atpD.
Ген InfB — является фактором инициации трансляции IF-2, это один из наиболее важных компонентов для запуска синтеза белков. Сравнительный анализ нуклеотидной последовательности данного гена с международной базой данных показал, что данный ген является высококонсервативным (99−100%) для бактерий рода Pasteurella multocida.
Ген sodA — ген кодирующий супероксид дисмутазу, также показал большое сходство для бактерий рода Pasteurella multocida.
Ген rpoB — является бета-субъединицей ДНК-зависимой РНК полимеразы, которая катализирует транскрипцию ДНК в РНК. При сравнительном анализе нуклеотидной последовательности данного гена, было показано, что данная последовательность является специфичной для бактерий рода Pasteurella multocida subsp. multocida.
Ген atpD — является бета-субъединицей АТФ-синтазы, участвует в получении АТФ из АДФ. Сравнительный анализ его нуклеотидной последовательности также показал высокую консервативность данного гена для бактерий рода Pasteurella multocida.
После анализа нуклеотидных последовательностей возбудителя Pasteurella на следующем этапе исследований проводили подбор праймеров и зондов для постановки ПЦР в реальном времени. Конструирование праймеров проводили с использованием программы Oligo 7.
Полученные с помощью программы праймеры, проверяли на специфичность с использованием программы BLAST. По результатам проверки были выбраны 3 набора праймеров, которые показали наибольшую специфичность к Pasteurella multocida subsp. multocida. Характеристика праймеров и зондов представлена в таблице 1.
Характеристика праймеров и проб

Вышеуказанные пары праймеров и зондов (табл. 1) в дальнейших экспериментах испытывались непосредственно в классическом варианте ПЦР и ПЦР-РВ с пробами ДНК возбудителя Pasteurella multocida.
Эффективность метода ПЦР и его специфичность зависит от многих параметров, включающих буферный состав реакционной смеси, температурно-временной режим амплификации, концентрацию фермента в реакционной смеси, концентрацию праймеров.
Первоначально определяли специфичность и чувствительность выбранных пар праймеров классическим методом ПЦР и ПЦР-РВ, используя градиент температур (550С ± 10 0С). Результаты проведенных исследований представлены на рисунках 1, 2.
Проведенные исследования по апробации трех специфических праймеров в ПЦР на возбудитель Pasteurella multocida показали, что первая пара праймеров на ген SodA амплифицировала фрагмент ДНК размером 92 п.н., третья пара праймеров на ген rpoB амплифицировала фрагмент ДНК размером 144 п.н. при этом электрофоретический анализ продукта амплификации показывал четкую линию ДНК, а вторая пара праймеров на ген InfB амплифицировала фрагмент ДНК размером 93 п.н., однако электрофоретический анализ продукта амплификации показывал слабую линию ДНК.

Ммаркер; 1- отрицательный контроль; 2- Е. coli 16; 3- B. aborts; 4- Pasteurella multosida Рисунок 1 — Специфичность и чувствительность праймеров в ПЦР На рисунке 1 видно, что гетерогенные пробы (ДНК Е. coli 16 и B. aborts) и вода показали отрицательные результаты, что подтверждает специфичность подобранных праймеров. В ходе опыта праймер гена SodA в классическом ПЦР, при исследовании биоматериалов приготовленных из нормальных органов животных (незараженных возбудителем пастереллеза) показал неспецифический результат, то есть дал полосу продукции амплификации в агаровом геле. В связи с этим для дальнейшего опыта по оптимизации постановки ПЦР-РВ испытана одна пара праймера и зонда — прямой 5'- TTGTTGTTTGATCATCGCATT-3' и обратный 5'-GATGAAAACGGTCAACCAGT-3', 6FAMTATCGTGTTGAACCCGCTAGGTG-BHQ1 на ген RpoB.
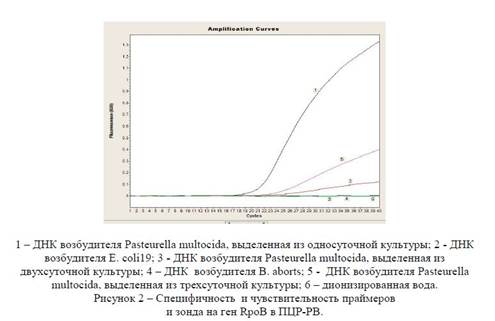
Специфичность и чувствительность праймеров и зонда на ген RpoB в ПЦР-РВ.
На рисунке 2 видно, что пробы, содержащие ДНК возбудителя Pasteurella multocida, дают специфический рост флуоресценции. Данная кинетическая кривая, представленная в координатах «Уровень репортерной флуоресценции — цикл амплификации», имеет правильную сигмоидную форму. При этом отсутствует какой-либо флуоресцирующий сигнал в гетерологичных пробах и в отрицательном контроле. В связи с этим можно говорить, что пара синтезированных праймера и зонда на ген RpoB специфичны в отношении ДНК возбудителя Pasteurella multocida в ПЦР-РВ.
Следующим этапом работы было подбор температуры отжига при постановке ПЦР. Когда цепи расходятся, температура понижается, чтобы праймеры могли связаться с одноцепочечной матрицей. Эта стадия называется отжигом. Температура отжига зависит от состава праймеров и обычно выбирается равной температуре плавления праймеров. Неправильный выбор температуры отжига приводит либо к плохому связыванию праймеров с матрицей (при завышенной температуре), либо к связыванию в неверном месте и появлению неспецифических продуктов (при заниженной температуре). Результаты подбора температуры отжига при постановке ПЦР (праймера на ген RpoB), представлены на рисунке 3.

Электрофореграмма ПЦР-продуктов возбудителя Pasteurella multocida при различных температурах отжига праймеров.
Из рисунка 3 видно, что ПЦР-продукт в достаточном количестве нарабатывается при 51,30С, 52,90С и 54,80С. Таким образом, дальнейшие эксперименты по ПЦР-РВ проводили при температуре отжига 550С.
Известно, что концентрация соли магния (Mg2+) в реакционной смеси может влиять на качество и количество образующегося ПЦР-продукта. При проведении ПЦР в реальном времени рекомендуют использовать концентрацию ионов Mg в области 2−6 мМ, но бывают случаи, когда концентрация Mg2+ была ниже 2 мМ.
В наших экспериментах мы изучили влияние концентрации хлорида магния, начиная с 1,0 мМ, и постепенно повышали концентрацию до предельного значения 5 мМ.
Результаты этих исследований представлены на рисунке 4.
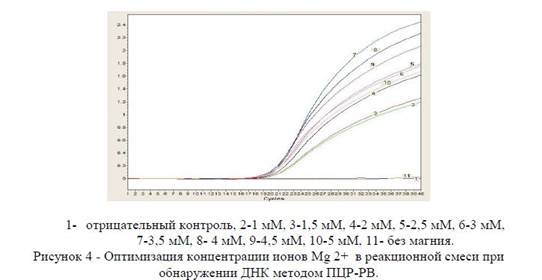
Оптимизация концентрации ионов Mg 2+ в реакционной смеси при обнаружении ДНК методом ПЦР-РВ.
Результаты проведенных экспериментов (рисунок 3) показали, что концентрация ионов Mg2+ влияла на процесс амплификации во всех случаях. Наилучшей концентрацией хлорида магния считали ту, при использовании которой наблюдалось наименьшее значение C (Т) (пороговый цикл) и наибольшее значение флуоресценции. Как видно из рисунка 4, наиболее оптимальной концентрацией Mg 2+ является 2,5 мМ.
Таким образом, в ходе исследовании нами были подобран следующий температурновременной режим для постановки ПЦР в реальном времени при идентификации возбудителя Pasteurella multocida:

После оптимизации условий постановки ПЦР-РВ необходимо было проверить чувствительность и специфичность ПЦР-РВ. При определении чувствительности ПЦР в реальном времени для выявления возбудителя Pasteurella multocida. Изначально перед постановкой опыта готовили десятикратные разведения ДНК начиная с 26,2 нг/мкл до 0,2 фг/мкл, результаты на рисунке 5.
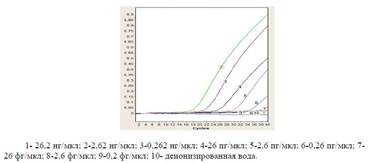
Проверка чувствительности ПЦР-РВ Из рисунка 5 видно, что разработанная тест-система ПЦР-РВ позволяет обнаружить ДНК возбудителя Pasteurellamultocida в концентрации 26 фг/мкл.
В дальнейшем были проведены исследования по определению специфичности ПЦР-РВ при Pasteurella multosida. Специфичность ПЦР в реальном времени определяли, используя гетерологичные и гомологические пробы. Результаты исследования представлены в рисунке 6.
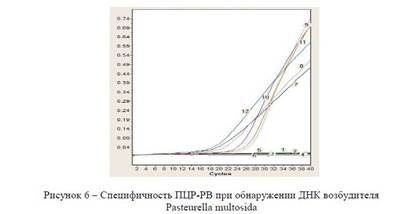
Специфичность ПЦР-РВ при обнаружении ДНК возбудителя Pasteurella multosida деионизированная вода; 2) штамм B. abortus- 19S; 3) штамм E. coli: BL21; 4) 20% суспензия, приготовленная из легких здорового мышонка; 5) 20% суспензия, приготовленная из печени здорового мышонка; 6) 20% суспензия, приготовленная из сердца здорового мышонка; 7) 20% суспензия, приготовленная из легких павшего от Pasteurella multocida мышонка; 8) 20% суспензия, приготовленная из печени павшего от Pasteurella multocida мышонка; 9) 20% суспензия, приготовленная из сердца павшего от Pasteurella multocida мышонка; 10) Мутант Pasteurella multocida (S) Ste mytaut; 11) Мутант Pasteurella multocida кл 05.04.13 AroA mytaut; 12) штамм Pasteurella multocida: Saigas/2011/ZKO/KZ.
Из рисунка 6 видно, что специфический рост флуоресценции наблюдался в пробах содержащих ДНК возбудителя Pasteurella multosida. Отсутствие флуоресцирующего сигнала наблюдали в пробах содержащих ДНК, гетерогенных пробах и отрицательного контроля (деионизированная вода).
Такие же работы проводились зарубежными учеными, так например, Montserrat Bosch и др. авторы [7] изучали гены Pasteurella multocida, и получили праймеры на гены exbB exbD TonB. С применением комплекса полученных праймеров они смогли определить вирулентные формы возбудителя.
Есть работа отличающаяся от нашей (8), в которой при постановке ПЦР используется реакционная смесь следующего состава: конечный объем 25 мкл, содержащий 67 мМ трис.-HCl (рН 8,9), 16 мМ сульфат аммония; 2,4 мМ MgCl2; 0,01% Твин 20; 0,2 mM дНТФ; 0,3 mкM растворов олигонуклеотидных праймеров, и 1ед. Taq-полимеразы. Для детекции геномной ДНК микроорганизмов рода Pasterella были найдены следующие последовательности специфичные для гена 16s рибосомальной РНК: прямой 5'-TGCCATAAGATGAGCCCAAGT-3' и обратный 5'-CCCTTTACGCCCAGTTA-3'.
Авторы реакцию проводили на амплификаторе типа «Терцик» (НПФ ДНК-Технология, Россия) или с использованием его аналога, с начальной денатурацией при 95 °C 3 мин., далее в течение 36 циклов с денатурацией при 95° С 10 сек, отжигом при температуре 62 -64°C в течение 10 сек и синтезом при 72° С 15 сек. Финальная элонгация проводили при 72 °C 3 мин. Для детекции геномной ДНК микроорганизмов рода Pasterella длинна ампликона составила 360 пн.
Заключение
Для оптимизации постановки ЦПР-РВ выбраны 4 гена Pasteurella multocida — InfB, sodA, rpoB, atpD, и на эти гены были подобраны праймеры и зонды для постановки ПЦР в реальном времени. Конструирование праймеров проводили с использованием программы Oligo 7. С использованием программы BLAST была проверена специфичность подобранных праймеров. В результате были отобраны три пары праймеров на гены — InfB, sodA, rpoB, atpD.
В ходе исследовании с помощью ПЦР тест-системы подобрана одна пара праймеров и зонда — прямой 5'-TTGTTGTTTGATCATCGCATT-3' и обратный 5'- GATGAAAACGGTCAACCAGT-3', 6FAM-TATCGTGTTGAACCCGCTAGGTG-BHQ1 на ген RpoB. Другие две пары праймеров и зондов оказались не пригодными для оптимизации условий постановки ПЦР-РВ. На основе данных праймеров и зонда оптимизированы условия постановки ПЦР-РВ. Оптимизированный вариант ПЦР-РВ оказался специфичным при выявлении ДНК возбудителя Pasteurella multocida из биологических проб. Чувствительность ПЦР-РВ — может обнаружить ДНК Pasteurella multocida в концентрации 26 фг/мкл.
- 1. Айкимбаев М. А. О случаях выделения возбудителя пастереллеза от сайгаков в феврале-марте 1984 года в Уральской области // Айкимбаев М. А., Мартиневский И. Л., Алтухов А. А., Иванов С. И., Суров В.Ф.// Изв. АН КазССР. Сер. биол. -Алматы, 1985, № 4. С. 39-
- 2. Мартиневский И. Л. О причинах массового падежа сайгаков // Мартиневский И. Л., Айкимбаев А.М.// Вторая Межгосударст. науч.-практ. конф. по взаимодействию государствучастников СНГ в области санитарной охраны территорий. -Алматы, 2001. С. 143-
- 3. Раскрыта тайна массовой гибели сайгаков в Казахстане//vesti.kz/fragment/ 93 645/.
- 4. Nolan T. «Quantification of mRNA using real-time RT-PCR». // Nolan T, Hands RE, Bustin SA //Nat. Protoc. 1: 1559- DOI:10.1038/nprot. 2006. 236. PMID 17 406 449
- 5. Лемиш А. П. Генотипирование штаммов серовариантов Pasteurella multocida методом полимеразной цепной реакции // Эпизоотология, иммунология, фармакология и санитария. — Минск. — - № 3. — стр.14−19.
- 6. Чемерис А. В. Улучшенный способ ПЦР-РВ, ЛЦР-РВ, ГЦР-РВ // Чемерис А. В., Никоноров Ю. М., Чемерис Д. А., Гарафутдинов Р. Р., Романенкова М. Л., Матниязов Р. Т., Гималов Ф. Р., Малеев Г. В., Вахитов В. А. //Вестник биотехнологии, 2005, том 1, № 2, С. 5−12.
- 7. Montserrat Bosch. Pasteurella multocida exbB, exbD and tonB genes are physically linked but independently // Montserrat Bosch, Elena Garrido, Montserrat Llagostera, Ana M. Pйrez de Rozas, Ignacio Badiola, Jordi Barbй.// FEMS Microbiology Letters Volume 210, Issue 2, pages 201−208, May 2002.
- 8. 8 Hall W.J. Studies on Pastererellosis: A new species of Pasterella encountered in chronic fowl cholerae. // Hall W.J., Heddleston K.L., Legenhausen D.H.//Am. J. 1955.Vet. Res. 16:598−604.