Больной с обструктивным апноэ сна в амбулаторной кардиологической практике: тактика диагностики, лечение, прогноз

Негативные последствия СОАС у больных с ССЗ должны были бы изменить проводимые в амбулаторных условиях адекватные состоянию больных современные методы лечения. Однако, признающаяся основным методом воздействия на ночные нарушения дыхания СРАР-терапия, используется крайне недостаточно, прежде всего из-за нежелания самих больных. Так, из 304 пациентов, которым мы рекомендовали его проведение… Читать ещё >
Больной с обструктивным апноэ сна в амбулаторной кардиологической практике: тактика диагностики, лечение, прогноз (реферат, курсовая, диплом, контрольная)
Работа выполнена в Государственном бюджетном образовательном учреждении высшего профессионального образования «Тверская государственная медицинская академия» Минздрава Российской Федерации на кафедре внутренних болезней ФПДО.
Научный консультант: Александр Петрович Иванов, доктор медицинских наук, доцент кафедры внутренних болезней Тверской медицинской академии, научный руководитель Тверского клинического кардиологического диспансера.
Официальные оппоненты:
Александр Георгиевич Автандилов, доктор медицинских наук, профессор, заслуженный врач РФ, заведующий кафедрой терапии и подростковой медицины Российской академии последипломного образования;
Сергей Васильевич Колбасников, доктор медицинских наук, профессор, заведующий кафедрой семейной медицины Тверской медицинской академии.
Валерий Владимирович Кухарчук, доктор медицинских наук, профессор, член-корреспондент РАМН, руководитель отдела атеросклероза института клинической кардиологии им А. Л. Мясникова Российского кардиологического научно-производственного комплекса.
Ведущая организация: Государственный научно-исследовательский центр профилактической медицина (ГНИЦ ПМ) С диссертацией можно ознакомиться в библиотеке Тверской государственной медицинской академии Ученый секретарь диссертационного совета кандидат медицинских наук доцент В.В. Мурга
Общая характеристика работы
Актуальность темы
. В последние годы в клинической кардиологии большую актуальность приобрела проблема синдрома обструктивного апноэ сна (СОАС) в связи с тем, что накапливается все больше данных о его роли в развитии сердечно-сосудистой патологии, в том числе в риске развития фатальных осложнений [Болотова М.Н. и соавт. 2009, Kapur V.K. 2010, Jennum P. et al. 2011]. Выявлены факты его наличия при большинстве сердечно-сосудистых заболеваний (ССЗ). При этом наиболее часто внимание исследователей привлекают пациенты с артериальной гипертензией (АГ) и ишемической болезнью сердца (ИБС), в том числе и имеющие постинфарктный кардиосклероз (ПИКС) [Torzsa P. et al. 2011, Glassel G.F. et al. 2011, Henzel T. et al. 2011].
Наличие СОАС может быть как причиной возникновения АГ, так и фактором, усугубляющим ее течение. В настоящее время СОАС рассматривается как независимый фактор риска ССЗ. У больных с СОАС циркадный ритм АД, как правило, нарушен, что считается неблагоприятным прогностическим фактором в плане развития сердечно-сосудистых осложнений при АГ. Повышенные цифры АД обнаруживаются у 40−70% больных страдающих нарушениями дыхания во время сна, отмечается и обратная зависимость — у 22−30% больных с АГ наблюдались признаки СОАС [Заподовников С.К. и соавт. 2010, Лямина Н. П. и соавт. 2011, Heusser K. et al. 2009, Chami H.A. et al. 2011]. При частых эпизодах апноэ может отмечаться практически постоянная ночная АГ. У некоторых больных показатели АД в ночной период могут даже превышать дневные цифры АД [Любшина О.В. и соавт. 2010, Zanobetti A. et al. 2010]. Результаты исследования Sleep Heart Health Study, в котором принимало участие более 5500 пациентов, продемонстрировали, что нарушения дыхания во сне независимо ассоциировались с более высоким уровнем АД, даже у молодых пациентов с нормальной массой тела [Бабак С.Л. и соавт. 2011, Gopalakrishnan P. et al. 2011]. Более того, распространенность АГ увеличивается пропорционально повышению тяжести СОАС. Этот феномен расценивается как фактор, способствующий прогрессированию системной АГ и возникновению сердечно-сосудистых осложнений, а так же как фактор риска повышенной смертности от них [Сукмарова З.Н. и соавт. 2011, Goff E.A. et al. 2010, Li C. et al. 2010].
В некоторых исследованиях отмечена большая частота встречаемости ИБС, инфаркта миокарда (ИМ), инсульта и сахарного диабета 2 типа у больных с нарушениями дыхания во время сна, а адекватное лечение СОАС сопровождалось снижением заболеваемости и смертности от сердечно-сосудистых заболеваний, и оказывало положительное влияние на течение АГ (Hla K.M. 1994, Hoffstein V. 1994, Fletcher E.C. 1999).
Считается, что СОАС присутствует примерно у 40% пациентов с избыточной массой тела и у 70% при наличии ожирения [Бузунов Р.В. и соавт. 2011, Фадеева М. И. и соавт. 2010]. Более того, при проспективном наблюдении 690 жителей Висконсина повышение массы тела на10% приводило к увеличению риска возникновения СОАС в 6 раз.
Несмотря на достаточно широкую распространенность этого синдрома в популяции, заболевание остается малодиагностируемым. Более 80% случаев апноэ во время сна средней и тяжелой степеней остаются нераспознанными и, соответственно, не проводится адекватное лечение, что приводит к ухудшению качества жизни таких пациентов, повышению риска развития у них инсулинорезистентности и ССЗ [Subramanian S. et al. 2010, Lloberes P. et al. 2011]. По данным масштабного проспективного исследования (Wisconsin Sleep Cohort Study, 2009), охватившего 6441 пациента, синдром ночного апноэ является независимым фактором риска как общей летальности, так и летальности от сердечно-сосудистых заболеваний. Наиболее сильное влияние СОАС отмечается в группе пациентов с сердечно-сосудистой патологией в возрасте от 40 до 70 лет [Rabec C. et al. 2011, Rajagopalan N. 2011]. Связь ишемической болезни сердца и синдрома ночного апноэ подтверждают популяционные и клинические исследования. По данным первых, ИБС встречается у пациентов, страдающих СОАС в 1,27 раз чаще, чем у пациентов без расстройств дыхания во время сна [Каллистов Д.Ю. и соавт. 2010, Ерошина Е. В. и соавт. 2011, Bansil P. et al. 2011, Ludka O. et al. 2011]. Клинические исследования характеризуют синдром ночного апноэ как значимый и независимый фактор, увеличивающий риск развития ИБС в 4,6 раз (Carlson J.T. 1996, Zhao Q. et al. 2011).
Еще одним значимым аспектом в современной кардиологии считается проблема ПИКС, являющегося ведущей причиной сердечной недостаточности (СН). Распространённость этого заболевания растёт, увеличивая инвалидизацию населения и играя одну из основных ролей в смертности от сердечно-сосудистых причин. Глобальные действия по профилактике и лечению многих заболеваний привели к существенному росту средней продолжительности жизни, а значит, к большей распространённости сердечно-сосудистой патологии [Gaziano M.J. et al. 2008, Zipes D. 2008, Mihaere K.M. et al. 2009, Sorianoa J.B. et al. 2010].
Внутрибольничная летальность от острого ИМ снизилась более чем в два раза по сравнению с серединой XX века. Соответственно, растёт количество больных с ПИКС, поступающих на амбулаторный этап лечения. От системы здравоохранения потребуется больше усилий по исследованию течения этой патологии, поиску методов улучшения состояния пациентов и увеличения продолжительности и качества жизни [Оганов Р.Г. и соавт. 2011].
Частым коморбидным состоянием при ПИКС, как и при хронической ИБС, является СОАС. Исследование прогностического значения СОАС представляется интересным, тем более что проведенные ранее работы продемонстрировали снижение выживаемости у больных с ПИКС, хронической ИБС и СОАС [Шайдюк О.Ю. и соавт. 2011, Angelico F. et al. 2010, Qercioli A. et a. 2010]. В то же время, по мнению P. Lavie и соавторов (2007), высокий риск смерти у этих пациентов обусловлен в основном коморбидной патологией.
Несмотря на высокие темпы развития современной медицины, ишемическая болезнь сердца остается лидером среди причин смертности населения как в России, так и в мире: по данным отчета Всемирной Организации Здравоохранения за 2009 г., смертность от заболеваний сердечно-сосудистой системы в России составляет 645 на 100 тыс. населения [Белявский Е.А. и соавт. 2010, Сопко О. Н. и соавт. 2010]. При этом существенный процент могут составлять лица, имеющие СОАС [Celen Y.T. et al. 2010, Cintra F. et al. 2011, Khazaie Y. et al. 2011, Ozeke O. et al. 2011]. К сожалению, в России имеется проблема с низкой информированностью врачей о существовании проблемы СОАС, ее влиянии на прогноз жизни пациента [Фадеева М.И. и соавт. 2010, Сукмарова З. Н. и соавт. 2011].
Современная терапия ССЗ, отказ от курения, здоровое питание, физическая активность позволяют добиться значительных успехов в лечении этих пациентов, однако приверженность к лечению остается недостаточной и внимание врачей сосредоточено на выявлении новых форм активного вовлечения больных в лечебные и профилактические мероприятия. Одной из них считается создание в РФ «Центров Здоровья», однако их роль в профилактических воздействиях на основные сердечно-сосудистые факторы риска у пациентов с ССЗ и СОАС не изучены. Внедрение новых организационных технологий в амбулаторную практику практического здравоохранения важно и с учетом того, что большинство лиц с ССЗ наблюдаются именно в поликлинических условиях. Для больных с ССЗ немаловажным фактором является и то, что, СРАР-терапия, признающаяся «золотым стандартом» лечения СОАС, используется крайне редко. Наши пациенты имеют очень низкую приверженность к аппаратному способу лечения этого состояния. Именно поэтому так остро стоит вопрос об эффективности именно медикаментозной комбинированной терапии и общих методах лечения при ССЗ и СОАС.
Учитывая важность и распространённость ССЗ и нарушений дыхания во время сна, взаимосвязь этих патологических состояний, становится актуальной и важной проблемой их дальнейшее изучение в современной клинической кардиологии, совершенствования способов диагностики, лечения и профилактики сочетания нарушений дыхания в структуре сердечно-сосудистой патологии.
Цель исследования. Изучить клинико-функциональные особенности у больных хронической ИБС, ПИКС и АГ сочетающихся с эпизодами СОАС, длительно наблюдающихся в амбулаторных условиях, определить тактику диагностики, контроля за их состоянием, факторы риска, определяющие возможность развития осложнений ССЗ и стратегии их коррекции с целью улучшения качества лечения и прогноза.
Задачи исследования.
- 1. Оценить роль анкетных опросников и возможности объективизации эпизодов остановок дыхания во время сна и их место в клинико-инструментальном обследовании больных с ССЗ и СОАС.
- 2. Изучить особенности клинико-функциональных показателей и возможные патофизиологические механизмы развития осложнений ССЗ у больных с СОАС.
- 3. Определить наиболее значимые факторы риска, ухудшающие состояние больных с АГ, хронической ИБС и ПИКС, в связи с наличием у них СОАС.
- 4. Изучить динамику состояния пациентов, включенных в исследование в течение 1 года наблюдения и определить возможные механизмы развития у них сердечно-сосудистых осложнений.
- 5. Проследить эффективность проводимого амбулаторного лечения с использованием стандартных подходов, согласно современным рекомендациям с включением СРАР-терапии и некоторых фармакологических препаратов и оценить возможность его улучшения.
- 6. Разработать пути коррекции наиболее значимых для развития осложнений ССЗ модифицируемых факторов риска у пациентов с СОАС.
- 7. Изучить возможности улучшения приверженности к лечению и его эффективности путем использования новых медицинских технологий с привлечением ресурсов «Центров здоровья» и элементов телемедицинского наблюдения за амбулаторной реабилитацией больных с ССЗ и СОАС.
Положения выносимые на защиту:
- 1. В качестве скринирующего метода выявления СОАС у амбулаторных больных предпочтительнее использовать Берлинский анкетный опросник с последующей верификацией остановок дыхания во время сна с помощью кардио-респираторного мониторирования.
- 2. Включение СОАС в патогенез АГ, хронической ИБС и постинфарктного кардиосклероза связано с дисфункцией эндотелия и вегетативной нервной системы с увеличением маркеров системного воспаления и фиброза, по-разному проявляющиеся при отдельных сердечно-сосудистых заболеваниях, на что следует обращать внимание при проведении амбулаторной реабилитации.
- 3. Развитие осложнений ССЗ при СОАС связано с увеличением окружности талии, повышением в крови концентрации триглицеридов, курением, отягощенным семейным анамнезом и их развитием в молодом возрасте.
- 4. У пациентов с ССЗ и СОАС необходимо тщательно выявлять и контролировать модифицируемые факторы риска, воздействие на которые предпочтительнее с помощью регулярных физических нагрузок и оптимизации питания.
- 5. Необходимо внедрять активный метод диспансерного контроля за состоянием больных с ССЗ и СОАС на амбулаторном этапе лечения с использованием элементов телемедицины и потенциалов «Центров Здоровья».
Научная новизна исследования и полученных результатов
При оценке состояния здоровья представительной группы больных, включавшихся в исследование при их первичном обращении за амбулаторной кардиологической помощью, выявлена большая распространенность эпизодов нарушений дыхания во время сна. Показано, что диагностический поиск в этом случае целесообразно начинать с использования Берлинского анкетного опросника с последующей верификацией получаемых с его помощью данных проведением кардиопульмонального мониторирования. Изучение гендерных и возрастных особенностей сочетания ССЗ с СОАС выявило значимость изменений АД у мужчин и женщин в развитии нарушений дыхания во время сна при утяжелении симптоматики, что наиболее значимо проявляется у женщин по мере старения, даже при нормальном уровне массы тела.
Сопоставление клинико-функциональных показателей при обследовании больных с АГ, хронической ИБС и ПИКС при наличии у них СОАС, впервые продемонстрировала определенные особенности в виде нарушений прессорных механизмов при АГ с развитием неблагоприятного структурного ремоделирования ЛЖ и эндотелиальной дисфункции, чему способствует увеличение жесткости его стенок с преобладанием синтеза коллагена перед его распадом. Все это ухудшает переносимость физических нагрузок и «экономичность» функционирования сердечно-сосудистой системы. В свою очередь, у больных ИБС, наряду с выявлением хронотропной недостаточности, новым моментом можно признать существенное увеличение утренних ишемических событий с преобладанием эпизодов безболевой ишемии, сочетающихся с нарушением липидного профиля крови, наличием вегетативной и эндотелиальной дисфункций с увеличением маркеров системного воспаления и фиброза миокарда. В отличии от хронической ИБС, при ПИКС впервые выявлена связь нарушений дыхания во время сна со снижением систолической и дистолической функции ЛЖ, что способствует активации процессов аритмогенеза, как в форме брадикардий, так и патологической желудочковой эктопии. Новым моментом в патогенезе неблагоприятных проявлений СОАС следует признать изменения функциональных характеристик синусового узла, что еще более значимо в случаях ранее перенесенного ИМ, тогда как имевшаяся до ИМ стабильная стенокардия способствует существенному нивелированию неблагоприятного влияния СОАС на клинико-функциональный статус больных с ССЗ.
При оценке длительного амбулаторного наблюдения больных с ССЗ и СОАС впервые показана возможность достижения ими комбинированной конечной точки. При этом риски, связанные с СОАС предпочтительнее изучать по методике PROCAM. Впервые у этой категории наблюдавшихся пациентов определены наиболее значимые факторы, влияющие на возможность развития у них осложнений ССЗ, из которых наиболее существенными следует считать увеличение окружности талии, повышение в крови уровня триглицеридов, фактор курения, отягощенный семейный анамнез по ССЗ и развитие заболевания в молодом возрасте. Одновременно с этим при назначении лечения у больных с АГ обосновано включение в стандартную схему спиролактона, а при хронической ИБС и ПИКС — розувастатина.
В работе впервые детально изучена роль традиционных ФР в неблагоприятных последствиях сочетания ССЗ с СОАС и выработана тактика их немедикаментозной коррекции с учетом возможности модификации образа жизни в виде рекомендаций по рациональному питанию и увеличению физической активности. При этом показана необходимость включения в образовательные программы рекомендаций по использованию велотренировок. Использование указанного подхода показало, что наиболее значимый отклик на немедикаментозные воздействия следует ожидать у пациентов с ССЗ и легкой степени СОАС.
В процессе наблюдения за больными с ССЗ и СОАС впервые использован потенциал «Центров здоровья», а так же внедрены элементы телемедицинского контроля. Отмечена роль активных программ наблюдения, позволяющих не только уменьшить выраженность нарушений дыхания во время сна, но и благоприятно влиять на гемодинамические показатели. Все это способствует значительному увеличению у больных приверженности к проводимому амбулаторному лечению.
Практическое значение результатов исследования. Полученные в исследовании результаты позволяют четко сформулировать тактику обследования больных с эпизодами ночных остановок дыхания с использованием Берлинского анкетного опросника и кардиопульмонального мониторирования. Последнее, наряду с использованием СМАД целесообразно осуществлять в динамике для объективного контроля за состоянием больных и качеством проводимого им амбулаторного лечения. Изложенный в работе методический подход возможно применять в любых учреждениях первичного звена здравоохранения, не прибегая к дорогостоящему использованию сомнологических стационаров с использованием полисомнографии. Выявленные факторы, влияющие на риски осложнений ССЗ в присутствии СОАС, позволяют выявить группу больных высокого риска, что наиболее целесообразно проводить по методике PROCAM. Одновременно с этим необходимо активно выявлять и учитывать традиционные сердечно-сосудистые ФР, из которых следует обращать особое внимание на абдоминальное ожирение, увеличение уровня триглицеридов, фактор курения, недостаточную физическую активность и несбалансированное питание. Для улучшения приверженности к лечению больных с ССЗ и СОАС, активному выявлению у них ФР и их коррекции, целесообразно привлекать имеющийся потенциал «Центров здоровья» с более активным внедрением в образовательные программы рекомендаций по велотренировкам и модификации диетических привычек.
Реализация и апробация работы. Апробация диссертации состоялась 16 октября 2012 г. на расширенном заседании кафедры семейной медицины ФПДО при участии 9 докторов наук и 21 кандидата наук по специальности «кардиология». Результаты исследований были представлены в виде стендовых докладов на образовательном форуме «Кардиология 2011», национальном конгрессе кардиологов (2011), московском международном форуме кардиологов (2012). Доложены на 14 Всемирном конгрессе холтеровского мониторирования и неинвазивной электрокардиологии (2011), конференции «Функциональная диагностика-2012». По материалам диссертации опубликовано 32 работы, из них — 15 в изданиях, рекомендованных ВАК для докторских диссертаций.
Практические рекомендации внедрены в работу больницы скорой медицинской помощи (г Тверь), Тверского областного клинического кардиологического диспансера.
Основные положения диссертации используются в учебном процессе на кафедре внутренних болезней ФПДО Тверской медицинской академии.
Объем и структура диссертации. Работа изложена на 214 страницах печатного текста и включает введение, обзор литературы, описание материала и методов исследовании, 4 главы с изложением результатов собственных исследований с обсуждением полученных данных, заключение, выводы, практические рекомендации и список литературы с приложением использованной сомнологической анкеты. Работа содержит 61 таблицу и 20 рисунков. Библиографический указатель включает 359 источников, в том числе 49 отечественных и 310 зарубежных авторов.
Общее содержание работы
Материал и методы исследования
Проведенный анализ баз данных ГУЗ «Областной клинический кардиологический диспансер», (г. Тверь) и Медицинского центра «Спецстроя РФ» (г. Москва) позволил выявить 1724 больных, обращавшихся в 2007;2010 г г за медицинской помощью по поводу основных сердечно-сосудистых заболеваний (АГ, хроническая ИБС, ПИКС, нарушения сердечного ритма и проводимости). Из них отобрано 973 мужчин и женщин (средний возраст 58,4 ± 6,8 лет) согласившихся участвовать в настоящем исследовании и подписавши информационное согласие на его проведение.
Из исследования исключались больные с сопутствующим хроническим обструктивным заболеванием легких, клапанными пороками сердца, имевшие клинические проявления сердечной недостаточности со сниженной фракцией выброса левого желудочка ниже 50%, артериальной гипертензией (при наличии цереброваскулярных осложнений и диабета в анамнезе), а так же лица с аномалиями челюстно-лицевого скелета и заболеваниями ЛОР — органов. Обследования проводились в отсутствии антиаритмической терапии с отменой сердечнососудистых препаратов как минимум за сутки до исследования.
Общая характеристика включенных в исследование больных представлена в таблице 1.
При проведении клинико-инструментального обследования все пациенты, включенные в данную работу, согласно Хельсинской декларации дали информированное согласие на использование конкретных методов обследования.
Наличие ХСН определяли согласно III пересмотру Рекомендаций ВНОК (2010) по наличию характерных жалоб больных, подтверждавшихся выявлением при ЭхоКГ дисфункции миокарда (систолической, диастолической, смешанной). Степень выраженности ХКН оценивали согласно критериям NYHA (1973). У 207 пациентов в соответствии с Рекомендациями рабочей группы ESH/ESC (2007) диагностировали АГ I — II степени. На основании данных трансторакальной ЭхоКГ среди них выделили пациентов с концентрической гипертрофией левого желудочка (КГЛЖ); концентрическим ремоделированием (КР) ЛЖ; эксцентрической гипертрофией (ЭГ) ЛЖ; дилатацией (Д) ЛЖ; дилатацией левого предсердия (ЛП). У 262 больных ранее диагностирована хроническая ИБС с приступами стабильной стенокардии, которая верифицирована согласно Рекомендациям ВНОК (2010). У 308 пациентов ранее имелся ИМ, при этом большинство из них (262; 85,1%) проходили амбулаторную реабилитацию спустя 1−1,5 месяца от его начала и имели полную документацию по его течению в стационаре. Диагноз ИМ верифицирован клинико-инструментальными показателями, включавшими ЭКГ в динамике и определение биомаркеров некроза миокарда (тропонин-I). Для анализа характера нарушений ритма и проводимости в исследование включено 117 больных, аритмии у которых (преимущественно предсердные — у 99; 84,6%) протекали в отсутствии органической сердечно-сосудистой патологии и признавались идиопатическими.
Таблица 1.
Этиологическая характеристика пациентов, включенных в исследование (абс/%%).
Этиология. | Всего. | М/Ж. | Возраст (годы). | ||||
< 40. | 41−50. | 51−60. | >60. | ||||
АГ всего В т.ч. I степень В т.ч. II степень В т.ч. III степень из них: АГ и СН АГ и аритмии АГ, СН и аритмии. |
|
|
|
|
|
| |
ХИБС всего В т.ч. I ФК В т.ч. II ФК В т.ч. III ФК В т.ч. IV ФК из них: ХИБС и СН ХИБС и аритмии ХИБС, СН и аритмии. |
|
|
|
|
|
| |
ПИКС всего в т. ч. ПИКС и СН в т. ч.ПИКС и аритмии в т. ч. ПИКС, СН и аритмии. |
|
|
|
|
|
| |
аритмии пароксизмальные идиопатические всего в т. ч. предсердные в т. ч. желудочковые. |
|
|
|
|
|
| |
НЦД (Соматоформная дисфункция). | 79/ 8,2. |
|
|
|
| ; | |
Ито о. | 973/100. |
|
|
|
|
| |
Для сопоставления данных, получаемых у больных с органическими или функциональными заболеваниями, в исследование включена группа пациентов включавшая 79 лиц, у которых не найдено структурных изменений в сердце и отнесенных к нозологической форме — нейроциркуляторной дистонии (НЦД).
Всем пациентам исходно и проспективно проводилось клинико-инструментальное обследование, включающее в себя выявление характерных жалоб с уточнением характеристик ангинозного и «аритмического» синдрома, особенностей течения заболевания (время первого приступа стенокардии и аритмии, их частота в течение суток, сезонность ухудшения самочувствия и метеочувствительность, особенностей течения АГ, эффективности контроля АД, проводимой противоишемической и антигипертензивной профилактической терапии, отягощенной наследственности, наличие кардиоваскулярных осложнений в анамнезе.
Субъективные характеристики сна изучали по данным ответов на Берлинский анкетный опросник и опросник дневной сонливости Epworth, рекомендованные сомнологическим центром МЗСР РФ.
При первичном обследовании больных измерялись антропометрические показатели — вес (кг), рост (м), окружность талии и бедра (см). На основании этих параметров рассчитывали индекс массы тела (ИМТ) по формуле Кетле: масса тела (кг)/рост (м2). На основании полученных данных по классификации ВОЗ [1997] выделяли больных с: нормальной массой тела (ИМТ 18,5−24,9); избыточной массой тела (ИМТ 25,0−29,9); ожирением I степени (ИМТ 30,0 — 34,9).
ЭКГ выполняли на аппарате «FUKUDA DENSHI» (Япония) с компьютерным анализом общепринятых параметров зубцов и интервалов в 12 стандартных отведениях на фоне синусового ритма, критерием которого считали: — наличие зубца P одинаковой морфологии, постоянно предшествующего комплексу QRS и положительного в I-II стандартных отведениях. Анализ ЭКГ проводился традиционно с оценкой положения электрической оси сердца, характера процессов деи реполяризации миокарда желудочков и нарушений проводимости. Исходно и проспективно (через 24 месяца) дополнительно изучались показатели зубца P: — максимальная и минимальная длительность волны P (Pmax и Pmin) в миллисекундах (мс), измеренной во всех отведениях c визуализируемым зубцом P; дисперсия зубца Р (Pdis), рассчитываемая по формуле:
Pdis = Pmax — Pmin (мс);
нормированная дисперсия зубца Р (Pdisнорм), рассчитываемое как.
Pdis/Vn,.
где Vn — количество отведений с визуализируемым и измеренным зубцом P [Amasyali B. et al. 2006].
Аналогично анализу зубца Р изучался и интервал PQ: — максимальная длительность интервала от начала зубца P до начала зубца Q® (PQ®max), измеренного во всех 12 отведениях ЭКГ (за норму принимали 180мс), минимальная длительность интервала от начала зубца P до начала зубца Q® (PQ®min) (за норму принимали 120мс) Одновременно рассчитывали дисперсию интервала PQ (PQ®dis) как разницу между PQ®max и PQ®min (за норму принимали ее значение 60мс), а так же нормированную дисперсию интервала PQ (PQ®норм), которую определяли по формуле.
PQ®норм = PQ ®dis/Vn,.
где Vn — количество отведений с визуализируемым и измеренным зубцом P.
При оценке интервала QT определяли его длительность: от самой ранней точки комплекса QRS — место перехода изоэлектрической линии сегмента P — Q® в зубец Q® — до максимально поздней точки зубца T в месте его перехода в изоэлектрическую линию T — P. Находили максимальное (QTmax) и минимальное (QTmin) значения длительности интервала в мс. Дисперсию интервала Q — T (QTdis) в мс рассчитывали по формуле:
QTdis = QTmax — QTmin [Breidthardt T. et al 2007].
Дополнительно по формуле Базетта рассчитывали его корригированное значение, соотнося QT к ЧСС — QTкорр [Antzelevitch C. et al. 2007].
При проведении холтероского мониторирования (ХМ) анализировались эпизоды ишемии миокарда по критериям Gottlib (2003), параметры интервала Q — T, суточная ВРС, а так же характеристики суправентрикулярной и желудочковой экстрасистолии. С помощью кардио-респираторного мониторирования с регистрацией ночной пульсоксиметрии, изучалась сатурация гемоглобина и оценивались эпизоды ночного апноэ. Исследование выполняли на аппаратно — программном комплексе «Кардиотехника — 06» (фирма ИНКАРТ г. Санкт-Петербург). При регистрации эпизодов ФП оценивали время их появления в течении суток, их количество и продолжительность за время мониторного наблюдения. Выявленная экстрасистолия группировалась с выделением отдельно суправентрикулярной и желудочковой эктопической активности в виде единичных, парных и групповых экстрасистол. Наряду с оценкой их общего количества, проводился расчет их частоты за каждый час мониторирования.
Анализ интервала QT при ХМ проводили аналогично стандартной ЭКГ в 12 отведениях. При этом рассчитывали максимальную и минимальную продолжительность интервала QT (QTmax, QTmin), а так же дисперсию QT как разность между наибольшим и наименьшим (QTmin) его значениями, измеренными в 12 отведениях — QTdis. При регистрации максимальных значений QT более или равным 450мс за любой промежуток времени в течение мониторирования определяли удлинение интервала QT.
Расчет характеристик вариабельности сердечного ритма (ВСР) производился на базе последовательности интервалов R — R синусового происхождения по всей записи в последовательно взятых «окнах» длительностью 300 секунд. Для спектрального анализа, неравномерная временная последовательность интервалов R — R, преобразовывалась в равномерную путем линейной интерполяции и дискретизации с постоянной частотой 4Гц. Спектральный анализ полученной последовательности производился методом быстрого преобразования Фурье с применением предварительного фильтра с частотой среза 2Гц и прямоугольного «окна».
Из показателей анализа во временной области рассчитывались:
VAR (мс) — вариационный размах как разность между максимальным и минимальным значениями RR,.
AVNN (мс) — средняя длительность нормированного интервала RR (NN),.
SDNN (мс) — среднеквадратичное отклонение нормированных интервалов RR,.
pNN50 — доля смежных нормированных RR — интервалов, межинтервальные различия между которыми превосходят 50 мсек,.
RMSSD (мс) — среднеквадратичное отклонение межинтервальных различий,.
SDNN index (мс) — среднее из 5-минутных стандартных отклонений по всему массиву записи,.
SDANN (мс) — среднеквадратичное отклонение, вычисленное на базе нормированных интервалов RR, усредненных за каждые 5 минут записи.
Спектральный анализ осуществлялся с расчетом спектральной плотности мощности (мс2) по следующим частотным диапазонам: очень низких частот (VLF) — 0,0033−0,04Гц, низких частот (LF) — 0,04−0,15Гц, высоких частот (HF) — 0,15−0,4Гц. Вычислялись также значения высокочастотного компонента спектра, выраженные в нормализованных единицах — nHF, а так же отношение мощностей спектров LF и HF (LF/HF) (усл ед) как индекс вагосимпатического взаимодействия [Шпак Л.В. 2002].
Дыхательные расстройства в ночное время определялись при анализе ротоносового потока воздуха и вибрации стенок глотки (храпа). По данным этого исследования определяли число полного или частичного (апноэ и/или гипопноэ), прекращения дыхания во время сна. Во внимание принимались ночные эпизоды отсутствия дыхания в течение 10 с (апноэ) или уменьшение амплитуды дыхательных движений более чем на 50% (гипопноэ). Для оценки синдрома обструктивного апноэ сна (СОАС) определяли индекс апноэ/гипопноэ. Диагностика СОАС осуществлялась в соответствие с критериями Международной классификации расстройств сна (1990). Значимым считали регистрацию более 5 эпизодов апноэ/гипопноэ в час во время сна. Одновременно с этим с помощью пальцевой пульсоксиметрии регистрировали эпизоды ночного снижения насыщения крови кислородом. Во внимание принимали его уменьшение более чем на 3%.
Всем больным проводилась ЭхоКГ на аппарате «Асuson 128 XP/10С» (США) с использованием мультичастотных датчиков 2,0−3,5 МГц в режиме одномерного (М) и двухмерного (В) сканирования. В М-режиме из парастернальной позиции по длинной оси ЛЖ оценивались: толщина межжелудочковой перегородки (ТМЖП), толщина задней стенки ЛЖ (ТЗСЛЖ), конечно-диастолический размер (КДР) ЛЖ, измеряемый как внутренний размер ЛЖ в конце диастолы [Redfield M.M. et al. 2003]. Снижение систолической функции определяли при ФВ 40 мм [Lehto M. et al. 2009]. Использовали следующие критерии выраженности митральной регургитации (МР): 1-я степень — площадь струи МР составляет менее 20% площади ЛП; 2-я — 20−40%; 3-я — 40−80%; 4-я — более 80%. Гемодинамически значимыми считали 3-ю и 4-ю степени МР [Wong C.Y. et al. 2004]. Гипертрофия ЛЖ (ГЛЖ) определялась на основании расчета массы миокарда ЛЖ (ММЛЖ) и индекса ММЛЖ (иММЛЖ). ММЛЖ рассчитывалась по методике Penn [Peterson L.R. et al. 2004]. Полученная величина нормировалась по площади поверхности тела (ММЛЖ/ППТ) — иММЛЖ. За уровень ГЛЖ был принят критерий иММЛЖ, превышающий 134г/м2 у мужчин и 110г/м2 у женщин. В группе больных с ГЛЖ по рекомендации A. Ganau и соавт. (1973) на основании критерия относительной толщины стенок (ОТС) миокарда выделяли концентрическую гипертрофию левого желудочка (КГЛЖ) и эксцентрическую гипертрофию левого желудочка (ЭГЛЖ). ОТС рассчитывали по формуле: (ТМЖПд + ТЗСЛЖд)/КДР. Если ОТС была меньше 0,45, то отмечали эксцентрический тип ГЛЖ. Если больше 0,45, то регистрировали концентрический тип ГЛЖ. В соответствии с рекомендациями D. Savage и соавт. (1994) среди больных с ЭГЛЖ были выделены группы пациентов с дилатацией левого желудочка (ДЛЖ) и без ДЛЖ [Legedz L. et al. 2003]. Разделение проводилось на основании индекса КДР ЛЖ: (КДР) / S, где S — площадь поверхности тела. Если эта величина была больше 3,2см/м2 у женщин и 3,1см/м2 у мужчин, то регистрировалась ДЛЖ. Для оценки диастолической функции ЛЖ изучали показатели трансмитрального кровотока (ТМК). Исследование проводили в четырехкамерной проекции апикальной позиции низкочастотным (2,5МГц) ультразвуковым датчиком в режиме импульсного допплеровского сканирования. Анализировались показатели ТМК: E (м/c) — пиковая скорость раннего диастолического кровотока; A (м/c) — скорость диастолического кровотока во время предсердной систолы. Дополнительно рассчитывались время замедления раннего наполнения и время изоволюмического расслабления (ВИВР) ЛЖ. Диастолическую дисфункцию (ДДФ) ЛЖ регистрировали при E/A 100 мс [Houltz B. et al. 2010].
Для провокации пароксизмальных нарушений сердечного ритма и оценки функции синусового узла ЧПЭФИ выполняли натощак, без премедикации. Стимуляцию осуществляли с помощью аппарата «Cordelectro-4» (Каунас, Литва). В качестве регистратора использовался кардиоанализитор «Fucuda» (Япония). Определяли следующие электрофизиологические (ЭФИ) параметры: время восстановления функции СУ (ВВФСУ), коррегированное ВВФСУ (КВВФСУ), частоту стимуляции с развитием точки Венкебаха. Нормальными считали значения ВВФСУ до 1500 мс, КВВФСУ — до 525 мс, максимальную и минимальную частоту стимуляции с появлением точки Венкебаха — 180 и 130 имп/мин. Для дифференциации органической и функциональной патологии СУ использовали тест полной вегетативной денервации с внутривенным введением атропина и обзидана [Сулимов В.А. и соавт. 2001]. Наличие органического синдрома слабости СУ (СССУ) определяли при сохранении измененных показателей ВВФСУ и КВВФСУ после данной пробы. Провокацию предсердных пароксизмальных аритмий осуществляли с помощью частой и сверхчастой чреспищеводной электрокардиостимуляции (ЧПЭС). Индуцированный пароксизм считали устойчивым, если его длительность превышала 30 секунд.
Суточное мониторирование АД проводилось с помощью комплекса «Shiller BP-102» на фоне полной отмены гипотензивных препаратов за сутки до исследования. Учитывая, что лица с АГ в лечении использовали в-адреноблокаторы, более длительную их отмену считали нецелесообразным, учитывая возникновение на этом фоне тахикардии, которая способна существенно изменять получаемые инструментальные данные. Вычисляли среднее систолическое, диастолическое, пульсовое и среднее АД (САД, ДАД, ПАД, АДср). Оценивали вариабельность САД и ДАД за сутки, день и ночь по величине стандартного отклонения (СО). Кроме этого определяли индекс нагрузки давлением для САД и ДАД как долю их измерений, превышавших допустимый временной предел, выражающийся в процентах от числа проведенных измерений АД. Анализ значений АД для САД и ДАД проводили раздельно по их абсолютным средним величинам (сутки, день, ночь), а так же по индексам нагрузки давлением для САД и ДАД за указанные временные периоды.
Суточный профиль АД изучали по разнице среднего АД в дневные и ночные часы, принимая за нормальный профиль (dipper) превышение средних дневных показателей АД над средними ночными на 10−20%. Недостаточным (non-dipper) считали показатель ниже 10%, чрезмерным (over-dipper) — выше 20%. Процедуру СМАД проводили и оценивали согласно рекомендациям IV Международной конференции по амбулаторному мониторирования АД [Kotsis V. et al. 2006].
Всем пациентам проводилась симптом-лимитированная велоэргометрия (ВЭМ) методом непрерывно — возрастающих нагрузок. Критерием прекращения считали достижение субмаксимального для данного возраста и пола ЧСС, развитие типичного приступа стенокардии, а так же появление выраженной усталости или одышки, не позволявших продолжить исследование [Аронов Д.М. и соавт. 2006]. Одновременно с этим оценивали уровень хронотропного резерва (ХР) учитывая его индекс (ИХР). Последний рассчитывали по формуле:
ЧСС нагрузка — ЧСС исходно/220 — ЧСС должное.
[Nishime E.O. et al. 2000]. За снижение ХР принимали невозможность достижения 80% должной ЧСС [Wilkoff B.L. et al. 1996]. Параллельно изучался характер восстановления ЧСС в первую минуту отдыха после прекращения ВЭМ. Нарушенным считали его снижение за этот период менее чем на 12 уд/мин [Cole C.R. et al. 1999].
Биохимический анализ крови с определением сахара, общего холестерина, липопротеидов высокой, промежуточной и низкой плотности, аполипопротеида, А и В, триглицеридов, индекса атерогенности проводили на базе сети лабораторий «Ситилаб» г. Твери и в лаборатории медицинского центра при Спецстрое РФ (г. Москва). Изучение воспалительных процессов осуществляли определяя концентрацию в крови высокочувствительного с-реактивного белка. Для анализа фибропластических процессов в межклеточном пространстве, патогенетической роли интерстициального фиброза при ремоделировании миокарда определяли уровень в плазме крови неактивной (проформы) матриксной металлопротеиназы-1 (проММП-1) и С-концевого телопетида проколлагена I типа (СТП-I) как маркера деградации коллагена I типа. Все анализы проводились с помощью оригинальных наборов для иммуноферментного анализа фирмы «TBS» (Великобритания), а СТП-I — фирмы «Nordic Bioscience Diagnostics» (Дания).
Все включенные в исследование пациенты проходили первичное углубленное обследование, по результатам которого решался вопрос о способах лечения, определялся вид, дозировка и способ применения лекарственного препарата. Одновременно с этим выявлялись традиционные сердечно-сосудистые факторы риска и решался вопрос о мерах их профилактики и коррекции.
Наряду с констатацией наличия факторов риска ССЗ, по полученным в исследовании данным, рассчитывали суммарный 10-летний риск ССЗ используя шкалу SCORE в которой объединялись следующие факторы риска: возраст, статус курения, САД, уровень общего холестерина. Критерии риска оценивали согласно Российским рекомендациям по диагностике и коррекции нарушений липидного обмена с целью профилактики и лечения атеросклероза (2010). Абсолютный 10-летний риск развития ИМ рассчитывали по методике PROCAM с учетом возраста, фактора курения, содержания в крови ХС ЛПНП, ХС ЛПВП, ТГ, САД, наличия сахарного диабета и наследственной отягощенности по ССЗ.
Период наблюдения за пациентами составил в среднем 18,6 ± 3,4 месяца. Среди наблюдавшихся 304 больных, случайным образом выделены 2 группы. В первой (110; 36,2%) наблюдение за лечением осуществляли активно, путем регулярных консультаций по телефону с периодическими (1 раз в 3−6 мес.) контрольными обследованиями с привлечением потенциала «Центров Здоровья». Вторую группу (194; 63,8%) составили больные, тактика наблюдения у которых была традиционной, и они посещали врача по мере необходимости, в связи с изменениями у них клинической симптоматики.
У всех включенных в исследование пациентов, анализировался факт достижения ими конечной комбинированной точки. В это понятие включали развитие любых кардиоваскулярных осложнений в проспективном наблюдении, требовавших госпитализации по поводу нестабильной стенокардии, острой сердечно-сосудистой недостаточности или декомпенсации ее хронического варианта, тромбоэмболий легочной артерии, появление рефрактерности к применяемым препаратам.
Анализ данных проводился с помощью пакета прикладных программ «Statistica 6.1». Полученные цифровые данные выражались в единицах международной системы измерений (СИ). Определялись следующие показатели описательные статистики: среднее (М), минимум, максимум, ошибка средней арифметической (м), среднее квадратичное отклонение (SD). В зависимости от характера данных и вида их распределения применялись параметрические (парный и непарный t-критерий Стъюдента для зависимых и независимых выборок, коэффициент линейной корреляции Пирсона) и непараметрические (критерий Фишера, U-критерий Вилконсона-Манна-Уитни, 2 с поправкой Йетса). Анализ частот дискретных параметров проводился с применением таблиц сопряженности, 2 — Пирсона и 2 — Макнемара. Обобщение результатов проводили путем анализа четырехпольных таблиц сопряженности на основе соответствующих статистических показателей. Для оценки качественных признаков применяли точный критерий Фишера или 2 в зависимости от количества наблюдений в каждой ячейке таблицы сопряженности. Для сравнения показателей в исходном и проспективном исследованиях использовали T — критерий парных сравнений Вилкоксона. Достоверность различий между группами определялась при уровне безошибочного прогноза 95% (p < 0,05).
Результаты исследования и их обсуждение
Нарушения дыхания во время сна — весьма распространенное состояние, сопровождающее большинство ССЗ. Наиболее частой формой при этом считается его обструктивный вариант. Проблема диагностики, лечения и профилактики СОАС при ССЗ считается важной в современной кардиологии. По нашим данным, не претендующим на репрезентативность выборки, среди пациентов, наблюдаемых в амбулаторных условиях, в 45,3% случаев при анализе анкетных данных имеются указания на наличие остановок дыхания во время сна, что в большинстве случаев удалось подтвердить результатами кардио-респираторного мониторирования, а отсутствие при этом СОАС, имело место только в 9,7% случаях.
Примечательно, что анализ анамнестических данных, включенных в настоящее исследование пациентов, показал, что знали о наличии СОАС только 11,8% больных. Следовательно, у большинства из них обструктивные эпизоды остановок дыхания во сне ранее не диагностировались и эти пациенты не проходили необходимого лечения. Среди субъективных диагностических методов выявления нарушений дыхания во время сна, наиболее часто применяются различные анкетные опросники, преимущественно его Берлинский вариант, а так же оценивается наличие дневной сонливости согласно методике Epworth с расчетом индекса ESS score.
При использовании Берлинского анкетного опросника субъективные признаки остановок дыхания во время сна нами удалось выявить у 45,3% включенных в исследование больных. При этом, даже в отсутствии объективных признаков (группа сравнения), положительный результат ответов на вопросы Берлинской анкеты, оказался сопоставимым по наличию и степенью тяжести АГ и хронической ИБС, которые осложнялись СОАС. В то же время эти осложнения при ССЗ в основной группе и группе сравнения регистрировались с одинаковой частотой. Данный факт позволяет считать оправданным использование Берлинского анкетного опросника для первичного (скринирующего) обследования кардиологических больных в амбулаторных условиях. Тем более, что ответы на вопросы, поставленные в нем, имели значимые корреляционные связи с традиционными сердечно-сосудистыми ФР, что, вероятно, более полно отражает сочетанное влияние нарушений дыхания во время сна и ФР на характер сердечно-сосудистой патологии.
Напротив, анализ дневной сонливости, согласно расчету ESS score, показал низкую чувствительность и специфичность, которые не удалось улучшить даже при одновременном учете известных сердечно-сосудистых ФР.
Среди обследованных нами больных, имевших СОАС, преобладали лица среднего возраста (68,8%). Примечательно, что он обнаруживался у 75,2% мужчин моложе 60 лет. При этом у мужчин чаще встречалась его средняя степень тяжести, тогда как у женщин превалировали легкие формы СОАС. Анализ влияющих на подобное распределение СОАС при ССЗ выявил особенности только по уровню АД, которое оказалось существенно выше у женщин, чем у мужчин с ССЗ и СОАС. В свою очередь ИМТ не имел гендерных и возрастных особенностей, а увеличивал только степень выраженности СОАС, оцениваемой по уровню ИАГ. Все это указывает, что проблема ожирения у данной категории больных с ССЗ не столь существенна, как считалась ранее и на первый план выступает АГ как значимый фактор, влияющий на возникновение СОАС.
Влияние АД наиболее отчетливо прослеживается у больных при сочетании АГ и СОАС. При этом значение имеют показатели как офисного, так и амбулаторного АД, получаемые с помощью СМАД. Примечательно, что у 12,2% больных, не имевших повышения АД в спокойном состоянии, выявлена гипертензивная реакция на нагрузку, что может характеризовать возможность скрытого течения АГ у этой категории больных. Выявленные нами положительные корреляции ИАГ и ДАД, а так же его вариабельность, может характеризовать большую значимость уровня диастолического АД в плане неблагоприятных сердечнососудистых событий у больных с АГ и СОАС. Одновременно с этим следует указать на роль увеличение утреннего подъема ДАД, которое отражается лучше показателем прироста его абсолютной величины, но не скорости.
Примечательно, что присоединение к АГ и СОАС увеличения ИМТ, ассоциируется с увеличением числа больных с чрезмерным ночным снижением АД (с 13,3 до 42,1%), тогда как в отсутствии СОАС при АГ, увеличение ИМТ чаще имела связь с недостаточным ночным снижением АД. Возможно, что суточный профиль АД «over-dipper» при СОАС и АГ является более неблагоприятным у пациентов только с избыточной массой тела. Одновременно с этим нами выявлено у этих пациентов и более существенное увеличение утреннего подъема САД, что может характеризовать этот временной отрезок как наиболее уязвимый в плане развития сердечнососудистых осложнений.
Наряду с увеличением уровня АД, демонстрирующим повышение нагрузки на сердце, больные с АГ и СОАС характеризуются сниженной переносимостью физических нагрузок, которая еще более ухудшается при избыточной массе тела. При этом пациенты с АГ и СОАС имеют по сравнению с больными с АГ без СОАС более высокие уровни двойного произведения при ВЭМ как исходно, так и на высоте нагрузочной пробы, особенно при увеличении ИМТ. Данный факт может свидетельствовать о более выраженной гемодинамической нагрузке на сердечнососудистую систему, что способствует повышению потребности миокарда в кислороде и может явиться одной из причин возникновения ишемии. Кроме этого, отсутствие различий в величинах САД в ответ на нагрузку может свидетельствовать о едином механизме его повышения. Выявленные особенности позволяют предположить, что эта реакция определяется не столько наличием и тяжестью АГ, сколько другими факторами, в частности — наличием СОАС или увеличением ИМТ.
При проведении проб с физической нагрузкой у обследованных больных нами проведен детальный анализ не только периода нагрузки, но и восстановления. При этом в отсутствии АГ выявлено параллельное снижение ЧСС и САД, а при присоединении СОАС, особенно при увеличении ИМТ, восстановление САД начинает запаздывать по отношению к ЧСС. Можно полагать, что восстановление САД, так же как и снижение ЧСС после нагрузки, находится под контролем ВНС, а ее дисфункция является одним из механизмов нарушений гомеостаза у больных с АГ и СОАС. Вероятно, что степень этой дисфункции нарастает по мере присоединения к СОАС и избыточной массы тела.
Выявленные нами особенности позволяют отнести больных с АГ и СОАС с повышенным ИМТ в группу высокого риска развития сердечно-сосудистых осложнений.
Еще одним патофизиологическим механизмом негативного влияния СОАС на функциональный статус у больных с ССЗ большинство авторов считает наличие у них эндотелиальной дисфункции. При проведении проб с реактивной гиперемией патологические реакции со стороны плечевой артерии мы наблюдали у 23,1% пациентов. При этом она чаще имела место при сочетании АГ с СОАС, чем в отсутствии ночных обструктивных нарушений дыхания (соответственно у 38 и 13% обследованных) и крайне редко наблюдалась у больных с ССЗ не имевших АГ (4,9%). Анализ использованных показателей указанной пробы выявил межгрупповые различия у больных АГ в зависимости от наличия СОАС только по степени изменений линейной и конечной диастолической скоростей кровотока, что, на наш взгляд, имеет значение при использовании показателей при проведении проб с реактивной гиперемией, обследуя больных с АГ в амбулаторных условиях.
Обращает на себя внимание и тот факт, что имеющаяся у больных с АГ и СОАС эндотелиальная дисфункция, существенно нарастает по мере увеличения тяжести СОАС и при тяжелой степени процент увеличения диаметра плечевой артерии оказывается в 1,5 раза меньше, чем у лиц с АГ и легкой формой СОАС.
Одним из неблагоприятных факторов, существующих при АГ, считается наличие патологического ремоделирования ЛЖ, протекающего в форме как эксцентрического, так и концентрического вариантов. При этом наличие концентрической ГЛЖ ассоциировалось у больных с АГ и СОАС с более высокими значениями ИММЛЖ, а так же офисного уровня САД и ПАД, имея достоверные корреляционные связи, характеризуемые r = 0,28 -0,29. сердечный ишемический гипертензия апноэ Одновременно с этим, наличие ГЛЖ оказалось связанным с эндотелиальной дисфункцией. Примечательным можно считать тот факт, что как эксцентрический, так и концентрический варианты ремоделирования у больных с АГ и СОАС оказались в одинаковой степени связанными с наличием дисфункции эндотелия, что демонстрирует одинаковое неблагоприятное патофизиологическое значение обоих вариантов изменений геометрии ЛЖ у больных с СОАС при АГ.
Наряду с дисфункцией эндотелия и ремоделированием миокарда ЛЖ, наличие СОАС при АГ связано и с увеличением жесткости миокарда в виде увеличение его фиброза. Нами показано увеличение интерстициального фиброза у больных с АГ и СОАС как с концентрической, так и с эксцентрической ГЛЖ, тогда как показатель деградации коллагена был наименьшим при концентрическом варианте ремоделирования ЛЖ и концентрической ГЛЖ. Возможно, что преобладание процессов синтеза коллагена в миокарде ЛЖ над его распадом, может являться одним из ключевых моментов в патогенезе отрицательного влияния СОАС при АГ.
Следовательно, наличие СОАС при АГ связано с существенным изменением структурно-функциональных характеристик миокарда, когда увеличение с одной стороны системного АД, а с другой — давления в грудной клетке за счет нарушений дыхания во время сна, способно негативно влиять на ремоделирование миокарда с увеличением его жесткости и развитием эндотелиальной дисфункции. Все указанные процессы существенно усугубляются при увеличении массы тела и они прогрессируют по мере утяжеления степени СОАС.
Неблагоприятное влияние СОАС оказывает и на функциональный статус больных хронической ИБС, а так же у пациентов, перенесших ИМ. Так, у больных с хронической ИБС при проведении ВЭМ выявлен более низкий уровень пороговой нагрузки и снижение общего времени работы на велоэргометре, что связано с наибольшим риском развития коронарных осложнений (ОР соответственно 5,0 и 3,11), и ассоциируется у данной категории больных с более низким значением индекса хронотропного резерва. Выявленная при ХМ ишемия миокарда при СОАС преимущественно имела безболевой характер (у 59,2%), чаще выявлялась в утренние часы и имела в это время большую продолжительность, чем в отсутствии СОАС (соответственно у 38,2 и 12,7% пациентов). Наряду с этим суммарная длительность суточной ишемии, продолжительностью более 60 мин при СОАС выявлялась чаще, чем в ее отсутствии (соответственно в 9,2 и 2,8% случаях). Указанные изменения могут характеризовать больных хронической ИБС с СОАС как категорию пациентов высокого риска развития осложнений, требующих к себе более пристального внимания. Примечательно, что выявленные изменения существенно усугубляются при утяжелении СОАС, когда нарушения начинают появляться не только в ночные, но и в дневные часы.
Анализ ВСР у больных с хронической ИБС и СОАС позволил выявить большее значение активации ПСНС при утяжелении эпизодов гипоксемии и гиперкапнии, активность которой оказалась в 1,8 раза выше при ИАГ более 15 в час, а в целом при СОАС — в 2,8 раза выше, чем у пациентов с хронической ИБС без СОАС. Нельзя исключить, что подобный дисбаланс ВНС может способствовать увеличению потребностей миокарда в кислороде и утяжелять выраженность ишемии миокарда.
У больных с хронической ИБС с СОАС, так же как и при АГ, нами выявлено наличие эндотелиальной дисфункции. Однако, если при АГ и СОАС она имела место в 23,1% наблюдений, то при хронической ИБС с сопутствующей СОАС она диагностировалась несколько реже — у 17,6% больных, и существенно не различалась по частоте выявления в сопоставлении с больными хронической ИБС без СОАС (у 16,9%). Вместе с тем, ее наличие при хронической ИБС и СОАС коррелировало с уровнем общего холестерина (r=0,49). Обращает на себя внимание более частое выявление эндотелиальной дисфункции у больных с хронической ИБС и СОАС, имевших ИАГ более 15 в час (r=0,56). Можно полагать, что присутствие дисфункции эндотелия у этих больных связано как с тяжестью ночных обструктивных остановок дыхания, так и с выраженностью атеросклеротического процесса. Об этом свидетельствует нарастание уровня общего холестерина по мере увеличения ИАГ, повышение ЛПНП, снижение аполипопротеида, А и повышение аполипопротерида В с увеличением их отношения, что признается значимым маркером риска развития коронарных событий.
Выявленные изменения липидного профиля крови и эндотелиальной дисфункции у больных хронической ИБС с СОАС оказались связанными с увеличением маркеров системного воспаления. При этом у больных с тяжелой формой СОАС отмечена зависимость увеличение высокочувствительного С-реактивного белка с наличием эндотелиальной дисфункции (r=0,44), что еще более усиливает атерогенез. Примечательно, что у 31,5% больных с хронической ИБС и СОАС выявлены нарушения баланса коллагена, что свидетельствует о формировании избыточного фиброза миокарда (при хронической ИБС без СОАС — только у 7,7% пациентов). Данный факт можно так же считать важным патофизиологическим моментом, влияющим на неблагоприятное течение хронической ИБС при СОАС.
Обнаружение СОАС — частая диагностическая находка у больных, перенесших ИМ. По нашим данным, по результатам ответов на вопросы Берлинской анкеты, СОАС определен у 37% больных с ПИКС. Примечательно, что эти пациенты поступали на обследование по мере их обращения, что может характеризовать естественность процесса. При этом отмечены существенные гендерные и возрастные особенности. В частности, у женщин СОАС начинает проявляться позже, чем у мужчин, но с возрастом его распространенность вначале выравнивается, а в постменопаузе женщины начинают в количественном плане преобладать над мужчинами. У больных с ПИКС и СОАС в сравнении с аналогичной группой без СОАС, чаще регистрировалась постинфарктная стенокардия (соответственно у 35,1 и 13% обследованных). При этом лица с СОАС и постинфарктной стенокардией оказались моложе пациентов без СОАС. Обращает на себя внимание тот факт, что у больных с СОАС ИМ чаще развивался на фоне имевшейся ранее хронической ИБС (72,8%), однако прогрессирование стенокардии у этих больных наблюдалась достоверно реже, чем у больных с ПИКС без СОАС (соответственно у 19,4 и 44,6%).
Проведенные нами пробы с физической нагрузкой показали худшую их переносимость при сочетании ПИКС с СОАС, а так же большее время, необходимое для восстановления изменений на ЭКГ после прекращения исследования, что в целом характеризует этих пациентов как лиц с более низкой толерантностью к физической нагрузке и требует проведения у них амбулаторной физической реабилитации. Сравнение результатов нагрузочного тестирования по информативности в плане выявления ишемии миокарда показало сопоставимость результатов в отношении больных хронической ИБС. Однако, если у последних положительный результат ВЭМ имели 72,9% больных, то при ПИКС и СОАС — только 48,4% пациентов с сопоставимыми в обоих случаях характеристиками ишемии миокарда.
Обращает на себя внимание различие в характере ишемических изменений ЭКГ у больных с ПИКС и СОАС, выявленные нами при проведении ХМ. При сопоставимости в числе эпизодов изменений сегмента ST у больных с ПИКС с/без СОАС, его элевация оказалась наиболее характерной для больных с СОАС, что мы регистрировали в 28,1% случаев, а у лиц без СОАС — только у 4,3% обследованных. Можно полагать, что для сочетания ПИКС и СОАС может быть весьма характерным наличие вазоспастического механизма развития ишемии миокарда, однако данное предположение требует дальнейшего изучения.
Как и у больных с АГ и хронической ИБС, наличие СОАС существенно ухудшает клинико-инструментальные показатели у пациентов по мере увеличения ИМТ. В этом случае частота выявления элевации сегмента ST при ХМ увеличивается до 90,6%. При этом основным детерминантом в этом случае явилось увеличение окружности шеи, значения которой коррелировали как с ИАГ (r = 0,51), так и с обнаружением при ХМ подъема сегмента ST (r = 0,44).
Следует отметить, что все изучаемые клинико-инструментальные показатели у больных с ПИКС и СОАС существенно ухудшались по мере нарастания ИАГ, т. е. параллельно утяжелению степени СОАС. При этом именно в группе больных с ИАГ более 15 в час значительно чаще мы встречались с постинфарктной стенокардией (78,9% наблюдений), тогда как при легкой степени СОАС она регистрировалась только в 32,3% случаях. Напротив, стенокардию до ИМ чаще имели пациенты с ПИКС и легкой степенью СОАС. Однако корреляционных связей клинико-инструментальных показателей с наличием постинфарктной или прединфарктной стенокардии выявить не удалось. Тем не менее можно считать учащение постинфарктной стенокардии неблагоприятным прогностическим моментом возможных сердечно-сосудистых осложнений.
На вероятность таких событий указывает и проведенный нами анализ суммарного коронарного риска у больных ИБС с СОАС вне зависимости от факта перенесенного ранее ИМ. На основе изучения ОР в связи с наличием/отсутствием СОАС при ИБС удалось ранжировать показатели по их прогностической значимости. При этом по степени убывания их вклада в риск развития осложнений, они расположились следующим образом: наличие АГ в анамнезе, курение, гипергликемия, увеличение ИМПТ, повышение концентрации в крови общего холестерина и ЛПНП. Обращает на себя внимание, что наличие АГ в анамнезе и одновременно 4 ФР отмечено в 22,7% наблюдений, а у лиц без АГ — только в 7,3% случаев. Необходимо подчеркнуть, что применение разных шкал оценки рисков (в частности SCORE и PROCAM) дает неодинаковые результаты и в группу высокого риска больные с ИБС и СОАС чаще относились, когда использовалась методика PROCAM. Однако ее применение, на наш взгляд, можно считать более оправданным, т.к. включение в риск-стратификацию большего числа пациентов дает возможность привлечь внимание кардиологов при проведении амбулаторных реабилитационных мероприятий.
Наличие СОАС, определяемого на фоне ССЗ, связано и с появлением нарушений сердечного ритма и проводимости, которые регистрировались нами в 68,5% случаев. Их наличие позволяет предсказать проведенное в исследовании изучение дисперсионных характеристик ЭКГ, снятой в 12 стандартных отведениях При этом у больных с ССЗ и СОАС в 1,9 раза чаще выявлялось удлинение QTdis и в 1,6 раза чаще регистрировалось удлинение Pdis. Усугубление негомогенности процессов реполяризации в связи с наличием СОАС сопровождалось изменениями морфологических показателей. Так, при АГ имело место увеличение ПП и ГЛЖ, а при концентрическом варианте ремоделировния ЛЖ у них изменялись процессы релаксации и раннего наполнения ЛЖ. В свою очередь, при ИБС процесс аритмогенеза чаще имелся при эксцентрическом ремоделировании ЛЖ, что в случаях с СОАС проявлялось в 35,5% наблюдений, а без СОАС — только у 8,8% обследованных. Одновременно с этим не выявлено в этом случае значения в аритмогенезе нарушений диастолического наполнения.
Аритмии сердца являются частым проявлением постинфарктного периода, в том числе и у больных, имеющих СОАС. Следует отметить, что обследованная нами группа больных с ПИКС отличалась более выраженными ишемическими изменениями на ЭКГ, зарегистрированной при ХМ. При этом ИАГ преобладал в этом случае по сравнению с больными с ПИКС без ишемии миокарда в 1,6 раза. Эти пациенты характеризовались более низкими минимальными и средними значениями насыщения крови кислородом, что может свидетельствовать о более значимой у них гипоксии тканей в ночные часы.
На этом фоне при ХМ у больных с ПИКС и СОАС нами выявлено учащение в ночные часы как тахи-, так и брадикардий (соответственно в 3,4 и 5,7 раза в сравнении с больными с ПИКС без СОАС). Но более значимым оказалось учащение у них почти всех видов желудочковой экстрасистолии, которая появлялась как в ночные, так и в дневные часы. При этом выявлена ассоциация между ночной брадикардией и ИАГ (r=0,408), а так же ночной брадикарии и минимального насыщения крови кислородом (r=0,789).
Можно полагать, что у больных, перенесших ИМ, наличие эпизодов обструктивных нарушений дыхания во время сна связано с усугублением как ишемических, так и аритмических событий, что может характеризовать СОАС как значимый фактор, определяющим их более тяжелое состояние, что требует к себе особого внимания и построения адекватной программы амбулаторной реабилитации.
Нарушения сердечного ритма и проводимости у больных с ССЗ и СОАС связаны с изменениями вегетативного баланса. При этом при анализе ВСР нами выявлено преобладание влияние нейрогуморальной активности при одновременном снижении общей мощности спектра, что само по себе является прогностическим маркером риска развития нарушений сердечного ритма. Изучение корреляционных связей показало независимость влияния на аритмогенез мощности спектральных волн как низкого, так и высокого диапазонов, но наиболее значимым в этом плане явилось отношение LF/HF, считающегося критерием оценки вегетативного баланса.
При регистрации различных нарушений ритма и проводимости сердца у больных с ССЗ и СОАС их относительные риски (ОР) оказались различными. Наибольшее значимость выявлена нами для частой желудочковой экстрасистолии с частотой более 10 в час (ОР = 2,27) и при ее частоте более 30 в час (ОР = 2,58), а так же примерно одинаковую значимость регистрации пауз продолжительностью более 2 с и брадикарии с ЧСС менее 40 уд/мин (ОР = 2,56 и 2,25). При этом указанные риски сохраняли свое значение и при проведении многофакторного анализа Наличие СОАС способно не только усугублять в количественном отношении нарушения сердечного ритма и проводимости, но и изменить их циркадность. Нами показано, что предсердная патологическая эктопия чаще проявлялась в период от 3 до 6 часов, а желудочковая — с 21 до 3 часов, т. е. выраженность аритмических проявлений существенно увеличивается либо в момент пробуждения, либо в момент засыпания.
Нарушения сердечного ритма у больных с ССЗ и СОАС выявлялись нами не только при «пассивном» наблюдении с помощью ХМ, но и провоцировались активно при проведении неинвазивного электрофизиологического исследования сердца. Так, в группе больных с ИБС и СОАС пароксизмальные аритмии удавалось воспроизвести в 37,96% случаях, из которых 70,73% имели устойчивый характер. В свою очередь в отсутствии СОАС получены только у 4,9% обследованных, имея у всех неустойчивый характер. В структуре индуцированных аритмий преобладала ФП. При этом она чаще провоцировалась у мужчин, имевших увеличение ИМТ. Обращает на себя внимание тот факт, что у больных с ССЗ и СОАС относительно редко, но все же с большей частотой, чем в отсутствии СОАС, диагностировалась патология водителя ритма сердца (соответственно у 12,9 и 2,8%), имея чаще органический характер.
Сопоставление результатов неинвазивного ЭФИ сердца и данных ХМ у больных с ССЗ и СОАС позволило по-новому взглянуть на связи дневной и ночной брадикардии с патологией водителя ритма сердца. В работе показано, что наличие дневной брадикардии при СОАС ассоциировалось с более существенным увеличением ИАГ и более значимым снижением десатурации крови. Примечательно, что в этом случае существенно чаще, чем при ночной брадикардии, при ЧПЭС удавалось индуцировать пароксизмы ФП. При сопоставлении с уровнем вегетативного баланса обращает на се себя внимание преобладание вагусной активности при ночной брадикардии и гиперактивности СНС при ее появлении в дневные часы. Можно полагать, что присоединение дневной брадикардии у больных с ССЗ и СОАС может являться компенсаторным механизмом хронотропной недостаточности и ее наличие связано ч более выраженным снижением резервов сердечно-сосудистой и дыхательной систем.
Выявленные нами патофизиологические механизмы негативного влияния СОАС на состояние больных с ССЗ существенно влияют на уровень достижения ими комбинированной конечной точки при длительном амбулаторном наблюдении. При этом отрицательное влияние связано и с меньшей приверженностью больных с ССЗ и СОАС к проводимому лечении.
Из всех наблюдавшихся нами пациентов, комбинированная конечная точка была достигнута у больных с ССЗ при наличии или отсутствии СОАС соответственно в 22,7 и 9,9% случаях, а отсутствие приверженности к лечению в этих группах мы наблюдали соответственно у 45,1 и 30,6% пациентов. При этом число лиц, достигших конечной точки и не приверженных к лечению оказалась достоверно выше у больных с ССЗ и СОАС, чем в его отсутствии (соответственно 20,1 и 9,2% случаев). В целом естественное течение ССЗ при СОАС можно охарактеризовать неблагоприятными тенденциями с прогрессированием изменений со стороны клинико-функциональных показателей. При этом нами выявлено увеличение индекса SCORE у 19,5% пациентов. Наиболее значимыми факторами неблагополучия у больных с СОАС следует признать увеличение окружности талии, повышение в крови уровня триглицеридов, а так же фактор курения, отягощенный семейный анамнез по ССЗ и их развитие в молодом возрасте.
Негативные последствия СОАС у больных с ССЗ должны были бы изменить проводимые в амбулаторных условиях адекватные состоянию больных современные методы лечения. Однако, признающаяся основным методом воздействия на ночные нарушения дыхания СРАР-терапия, используется крайне недостаточно, прежде всего из-за нежелания самих больных. Так, из 304 пациентов, которым мы рекомендовали его проведение, реально он использовался только 13,8% больных. В то же время его применение существенно изменило большинство анализируемых клинико-функциональных характеристик, за исключением показателей структурного ремоделирования ЛЖ. Одновременно с этим у больных с АГ в результате проведения СРАР-терапии выявлено уменьшение показателей АД, особо значимо в ночные часы, что позволило снизить частоту выявления его патологических суточных профилей с 80,9 до 26,2%, что сопровождалось одновременно уменьшением выраженности вегетативной дисфункции и увеличением общей спектральной мощности волн при анализе ВСР. Наряду с этими позитивными моментами при СРАР-терапии нами найдено уменьшение дисперсионных характеристик ЭКГ, что свидетельствует о благоприятных изменениях в процессах негомогенности миокарда предсердий и желудочков, что, на наш взгляд, может оказать положительное влияние в плане предотвращения возможных нарушений сердечного ритма. В то же время сама СРАР-терапия не оказывала влияния на липидный профиль крови, показатели системного воспаления и маркеры фиброза, для чего, вероятно, необходимо проведение комбинированной терапии.
При длительном амбулаторном наблюдении за больными с ССЗ и СОАС наиболее пристальное внимание нами обращалось на пациентов с АГ и ПИКС, что объяснимо во-первых наличием при АГ феномена резистентности к лечению, а так же самостоятельным значением наличия АГ как фактора, способствующего прогрессированию остальных ССЗ, а во-вторых рекомендациями по включению статинов в комплекс медикаментозной терапии при проведении амбулаторной реабилитации больных, перенесших ИМ. Данные аспекты мало отражены в литературе, касающейся проблемы лечения больных с СОАС и, на наш взгляд, требуют более детального анализа.
Характер динамики клинико-инструментальных показателей, характеризующих функциональное состояние больных с АГ и СОАС, имевших резистентность к проводимому традиционному лечению, выявил, что одним из механизмом недостаточной эффективности терапии является сохранение дисфункции ВНС. Кроме этого нельзя исключить значимость такого факта, что при СОАС имелась более выраженная степень АГ и она часто сочеталась с избыточной массой тела. При этом наиболее существенно с резистеностью к лечению ассоциировалось повышение ПАД, характеризующее динамическую составляющую прессорного воздействия на органы-мишени.
Одним из путей преодоления резистентности к лечению АГ у больных с СОАС в настоящее время считается использование как дополнительного компонента спиролактона (верошпирона), который мы использовали в дозе 50 мг в сутки. Однако немногочисленные данные литературы в этом плане весьма противоречивы.
По нашим данным, на фоне его приема удалось существенно снизить уровень АД, улучшить показатель достижения его целевого значения, а так же нормализовать неблагоприятные суточные профили АД. При этом контроль за проводимым лечением с помощью измерений офисного и амбулаторного АД показал более значимые изменения при использовании первого способа. Данный факт необходимо предусмотреть при выборе метода контроля за качеством лечения больных с АГ и СОАС.
Особенности течения заболевания у больных с ПИКС и СОАС оказались существенно связанными с фактом наличия до ИМ стабильной стенокардии. В сравнении с пациентами, у которых ИМ развился как первое проявление ИБС, в данной подгруппе пациентов выявлены определенные особенности. Необходимо отметить, что исходно при включении в исследование больные имевшие до ИМ стабильную стенокардию и СОАС были моложе, у них чаще в анамнезе имелся диабет, но реже встречалась АГ. В то же время у больных после перенесенного ИМ и СОАС в отсутствии хронической ИБС в анамнезе было более выраженное нарушение дыхания во время сна. Анализ динамики состояния больных с ПИКС и СОАС в зависимости от наличия стенокардии до ИМ, показал, что ее присутствие ассоциировалось со снижением суммарной длительности эпизодов ишемии миокарда в 2,2 раза и снижением общего количества этих эпизодов в 1,9 раза без отчетливой динамики основных гемодинамических показателей. Можно полагать, что если наличие СОАС способствует ухудшению течения постинфарктного периода, то наличие до ИМ стабильной стенокардии способно, хотя бы частично, нивелировать эти неблагоприятные последствия.
Учитывая низкую приверженность к СРАР-терапии и рекомендации включения в медикаментозное лечение больных, перенесших ИМ, статинов, нами проведен анализ влияния розувастатина на клинико-функциональные показатели у больных с ПИКС и СОАС. Нами не найдено ассоциаций между приемом розувастатина и изменением структурных показателей ЛЖ. В то же время выявлено уменьшение у них размеров ЛП и, как следствие, снижение числа предсердных аритмий. Одновременно с этим розувастатин значимо влиял на липидный профиль крови, уменьшая степень его атерогенности. Можно ожидать в этом случае и антиишемического воздействия, но этот аспект проблемы, так же как и влияние розувастатина на диастолическую функцию ЛЖ, требует дальнейшего более детального изучения.
В целом, наличие ИБС независимо от ее хронической формы, или возникающей как следствие развития ИМ, сочетающейся с СОАС, следует считать поводом для включения в группу с повышенным риском развития осложнений. Результаты динамического наблюдения с использованием отношений шансов (ОШ) показали, что наиболее существенное неблагоприятное влияние оказывают диаметр ЛП, снижение ФВ ЛЖ менее 50% и наличие клинических проявлений СН II-III ФК по классификации NYHA. Обращает на себя внимание тот факт, что при многофакторном анализе относительный риск осложнений оказался значимым только для мужчин, перенесших ИМ в возрасте старше 50 лет, имевших ИАГ 10 в час и более, а при его уровне более 30 в час вероятность развития осложнений в постинфарктном периоде была на 22% выше, чем у мужчин с ИАГ менее 15 в час.
Мы считаем оправданным проведение риск-стратификации у больных с ИБС и СОАС и целесообразность выделения этих пациентов в группу высокого риска с проведением у них комплекса реабилитационных мероприятий, направленных на модификацию выявленных факторов, способных негативно влиять на динамику их состояния. Характеристика основных выявленных факторов риска, в частности ассоциированных с наличием эндотелиальной дисфункции, приведена на рисунке 1.
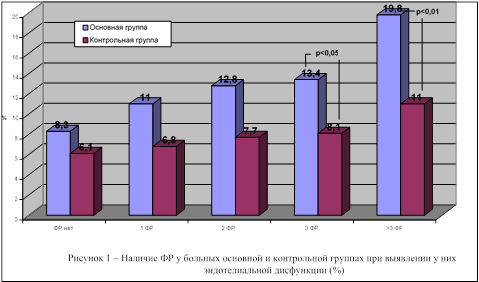
Как видно из приведенных данных, эндотелиальная дисфункция в основной группе выявлялась достоверно чаще при наличии одновременно 3 ФР (в 1,65 раза; 2 = 4,18; p < 0,05) и, особенно, при их количестве более 3 (в 1,8 раза; 2 = 3,92; p < 0,01).
Можно полагать, что наличие ФР при СОАС у пациентов с ССЗ неблагоприятно изменяет не только функциональный статус больных, но и включается в патофизиологический механизм развития осложнений заболеваний, что способствует утяжелению их состояния. Об этом свидетельствует и проведенный нами корреляционный анализ уровня ИАГ у больных с СОАС с общим количеством ФР и определенными ранее наиболее значимыми показателями, включавшими объем талии, уровень триглицеридов в крови, курением, отягощенным семейным анамнезом и фактом развития ССЗ в молодом возрасте. Результаты анализа представлены в таблице 2.
Таблица 2.
Корреляционная связь ИАГ с некоторыми ФР ССЗ.
Факторы риска. | Коэффициент корреляции ®. | р | |
отягощенная наследственность. | 0,264. | 0,0001. | |
повышение уровня триглицеридов в крови. | 0,294. | 0,0001. | |
увеличение объема талии. | 0,255. | 0,0002. | |
начало ССЗ в молодом возрасте. | 0,181. | 0,0081. | |
курение. | 0,178. | 0,0091. | |
возраст старше 55 лет. | 0,129. | 0,06. | |
общее количество сосуществующих ФР. | 0,365. | 0,0001. | |
Как следует из приведенных данных, имеется тесная корреляция тяжести СОАС в форме увеличение ИАГ с общим количеством ФР, а так же с уровнями триглицеридов в крови, объемом талии и отягощенной наследственность, и менее значимая — с курением и началом ССЗ в молодом возрасте.
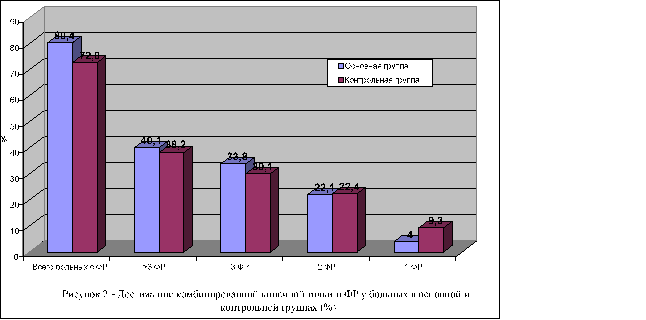
Одной из главных задач любой реабилитационной программы у больных с ССЗ является коррекция модифицируемых факторов риска, что, на наш взгляд, особенно актуально при сочетании ССЗ и СОАС. В работе показано, что при учете традиционных 6 наиболее значимых ФР — ожирения, дислипидемии, курения, отягощенного семейного анамнеза по ССЗ и возраста, у 43% больных наблюдалось наличие одновременно 3 ФР. При этом при утяжелении степени выраженности СОАС количество этих факторов достоверно возрастает. Показано их влияние на ухудшение эндотелиальной функции, увеличение маркеров фиброза миокарда. При этом с учетом корреляционных зависимостей именно наличие ФР при ССЗ и СОАС неблагоприятно изменяет не только функциональный статус пациентов, но и включается в патофизиологический механизм развития осложнений. Нами выявлена тесная корреляционная связь тяжести СОАС в форме увеличение ИАГ как с общим количеством ФР, так и с уровнем триглицеридов крови, объемом талии и отягощенной наследственностью по ССЗ. Следует отметить, что среди пациентов с ССЗ и СОАС наиболее часто в динамике достигали комбинированной конечной точки больные, имевшие тяжелое течение СОАС при ИАГ более 15 в час. Данный факт представлен на рисунке 2.
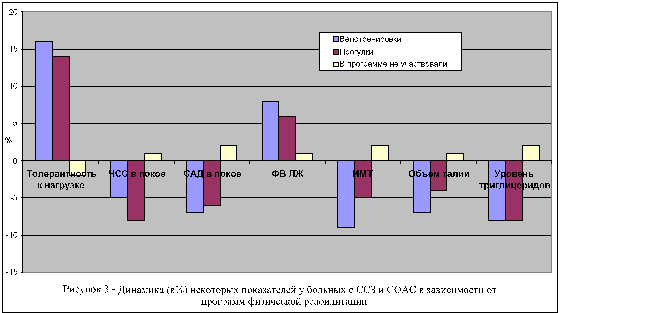
Из проводимых реабилитационных мероприятий в исследовании детально изучена программа модификации образа жизни с использованием физических нагрузок и коррекции диетических привычек. На рисунке 3 представлена динамика некоторых показателей функционального статуса больных используемые велотренировки и прогулки в сравнении с пациентами не участвовавшими в программе физической реабилитации.
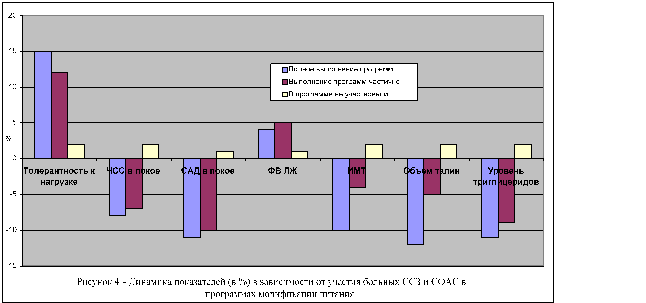
Нами показана положительная роль регулярных физических тренировок при использовании велотренажеров или пеших прогулок, отклик на которые спустя 6 мес составил соответственно 33,4 и 68,6%. Одновременно с этим изменение характера питания с назначением диет, проводившееся согласно рекомендациям институтов питания и эндокринологии РАМН, осуществленное у 78% пациентов, включенных в исследование, существенно снизил уровень окружности талии и концентрацию в крови триглицеридов. На рисунке 4 представлена динамика некоторых показателей функционального состояния больных придерживавшихся полностью или частично рекомендаций по питанию в сопоставлении с данными в группе больных с ССЗ и СОАС не использовавших в повседневной жизни рекомендованных диет.
При этом достижение комбинированной конечной точки среди больных, выполнявших рекомендации по модификации образа жизни оказалось возможным в меньшем числе случаев по сравнению с лицами, отказавшимися от подобных мероприятий (соответственно у 11,2 и 35,8%).
Одновременно с этим выявлено и снижение числа больных, имевших высокие индексы рисков SCORE и PROCAM, что в целом характеризует положительные тенденции у больных с ССЗ и СОАС при модификации ФР, проводимое при амбулаторной их реабилитации.
Вместе с тем нельзя не признать очевидный факт, что пациенты с ССЗ лечатся не достаточно активно, существует значимая проблема их низкой приверженности к проводимой медикаментозной терапии, что существенно снижает результативность реабилитационных мероприятий. Данная проблема существует и по отношению к модификации образа жизни.
В нашем исследовании неприверженность к лечению отмечена у 45% пациентов. При этом именно эти больные чаще достигали комбинированной конечной точки. Все это указывает на актуальность проблемы улучшения приверженности к реабилитационным мероприятиям.
На наш взгляд, определенных успехов в этом плане можно достигнуть используя потенциал «Центов Здоровья» и элементов телемедицинского контроля за пациентами, что способно существенно улучшить взаимодействие между врачом и пациентом. Так, при проведении мероприятий, направленных на модификацию образа жизни больных с ССЗ и СОАС в «Центре Здоровья» спустя 3 мес отмечено более значительное снижение ИМТ по сравнению с лицами, не принимавшими участия в этих мероприятиях с реднем на 5,9 и 2,1% соответственно. При этом динамика веса оказалась в этом случае стабильной на протяжении 1 года наблюдения, тогда как в группе больных, не участвовавших в работе «Центра Здоровья» выявлена волнообразная динамика ИМТ с периодическим снижением и последубщим повышением веса, что мы считаем неблагоприятным фактом, не отражающим истинных метаболических и энергетических потребностей организма. Увеличение приверженности к лечению в группе больных, наблюдение за которыми осуществлялось более агрессивно, проявилось и в снижении у них выраженности СОАС, оцениваемой по уровню ИАГ. Результаты наблюдения спустя 3 месяца от начала лечения представлены на рисунке 5.
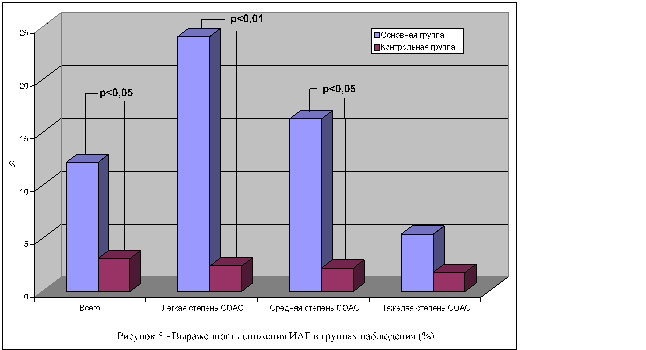
Следует особо отметить, что при использовании «Центров Здоровья» приверженность по оптимальной физической активности имелась у 82% больных, а диетические рекомендации выполняли 79% пациентов. Одновременно с этим 77% больных придерживались схем приема препаратов, назначаемых кардиологом при контрольных посещениях. Все это может характеризовать улучшение приверженности к проводимому лечению. Примечательно, что улучшение приверженности к лечению касалось и увеличения числи больных, использующих в качестве немедикаментозного метода лечения СРАР-терапию, которой пользовались спустя 3 мес. 61% пациентов, тогда как среди лиц, отказавшихся от проведения активных мероприятий по модификации образа жизни таких больных оказалось только 9%.
Параллельно с этим у больных с ССЗ и СОАС, посещавших «Центры Здоровья» выявлена и более существенная динамика ИАГ. При этом, если в целом в сравнении с группой лиц, не проводивших активных программ реабилитации, различие характеризовалось уровнем в 3,9 раза, то среди больных легкой степенью СОАС показатель ИАГ различался в 10 раз, а при средней степени тяжести — в 7,4 раза. Следует отметить, что больных с менее значимым уровнем ИАГ легче удавалось включать в группы, посещавшие «Центры Здоровья». При легкой и средней степени тяжести СОАС посещаемость программ реабилитации составила 44,8%, а при тяжелой форма этот уровень оказался достоверно ниже — всего 9,7% пациентов.
Обращает на себя внимание сохранение положительных тенденций у больных после посещения «Центров Здоровья» и спустя 3 месяца. При этом нормализация касалась не только ИАГ, но и гемодинамических показателей, прежде всего уровня САД и ЧСС в покое. В то же время программа активной амбулаторной реабилитации, проводимая среди больных с АГ и СОАС не улучшила достижимость пациентами целевых уровней АД. Данный факт в группах посещавших и не посещавших «Центры Здоровья» отмечен соответственно только у 21 и 19% больных. Результаты динамического наблюдения на протяжении первого года представлены на рисунке 6.
Как видно из приведенных данных, в основной группе, наблюдавшихся в «Центрах здоровья», динамика ИАГ в указанные сроки наблюдения, оставалась однотипной и по выраженности существенно не различалась. Напротив, в контрольной группе, среди пациентов, отказавшихся от активных вмешательств, исходно более низкий уровень снижения ИАГ в динамике еще более замедлялся, а к исходу 1-го года наблюдения выявлено его увеличение. Подобная характеристика касается и уровней САД, которое в основной группе последовательно снижалось, а в контрольной к 12-му месяцу наблюдения так же как и ИАГ повышалось. Необходимо отметить, что у этих пациентов раньше отмечены негативные процессы в отношении ЧСС, когда развитие тахикардии мы наблюдали уже спустя 6 месяцев от начала наблюдения.
Таким образом, можно полагать, что привлечение потенциала «Центров Здоровья» весьма оправдано среди больных с ССЗ и СОАС. Это существенно улучшает приверженность больных к проводимому лечению, благоприятно влияет как на выраженность СОАС, так и на гемодинамику, что, в итоге, должно улучшить исходы и прогноз у больных с ССЗ и СОАС. В то же время в образовательных программах необходимо уделять должное внимание вопросам обучения элементам модификации образа жизни, что имеет важное значение в плане улучшения приверженности к проводимым реабилитационным мероприятиям.
Выводы
- 1. Характер обструктивных нарушений дыхания во время сна достаточно полно отражают данные Берлинского анкетного опросника, ответы на поставленные в нем вопросы имеют значимые корреляционные связи с традиционными сердечно-сосудистыми факторами риска.
- 2. При выявлении синдрома обструктивного апноэ сна у мужчин и женщин не найдено гендерных различий, однако выраженность нарушений дыхания у женщин выше, даже при нормальном индексе массы тела, а с увеличением веса отмечается возрастание его степени тяжести, существенно зависимое от уровня артериального давления.
- 3. Наличие синдрома обструктивного апноэ сна у больных артериальной гипертензией ассоциируется со структурно-функциональными изменениями левого желудочка, протекающими на фоне увеличения концентрации в крови биомаркеров фиброза миокарда и развивающейся дисфункции вегетативной нервной системы с нарушением баланса ее симпатического и вагусного отделов.
- 4. Эпизоды обстуктивного апноэ сна при хронической ишемической болезни сердца связаны с увеличением числа утренних ишемических событий, увеличением ее суммарной суточной продолжительности с преобладанием безболевых эпизодов не только в ночные, но и в дневные часы, сочетающиеся с атерогенными изменениями липидного профиля крови, наличием дисфункции вегетативной нервной системы и увеличением маркеров системного воспаления и фиброза.
- 5. У больных, перенесших инфаркт миокарда, наличие синдрома обструктивного апноэ сна характеризуется более выраженной клинической симптоматикой, увеличением числа развития постинфарктной стенокардии, усугублением ишемических проявлений, нарушением липидного профиля крови и наличием как систолической, так и диастолической дисфункции левого желудочка.
- 6. Развитие аритмий у больных с сердечно-сосудистыми заболеваниями и синдромом обструктивного апноэ сна связано с дисфункцией вегетативной нервной системы, проявляющейся усилением симпатических влияний, которые с одной стороны могут являться компенсаторным механизмом хронотропной недостаточности, а с другой стороны — фактором, потенцирующим процессы неблагоприятного структурного ремоделирования сердца. При этом у больных с артериальной гипертензией развитие аритмий ассоциирцется преимущественно с концентрическим ремоделированием левого желудочка, а при хронической ишемической болезни сердца — с его эксцентрическим вариантом.
- 7. Риск неблагоприятных сердечно-сосудистых событий у больных с синдромом обструктивного апноэ сна при длительном их амбулаторном наблюдении возрастает при увеличении окружности талии, повышении в крови концентрации триглицеридов, курении, отягощенном семейном анамнезе по сердечно-сосудистым заболеваниям и их развитии в молодом возрасте.
- 8. У больных с инфарктом миокарда, диагностируемым на фоне полного здоровья, эпизоды обструктивных апноэ сна существенно ухудшают динамику клинико-функциональных показателей. В то же время наличие до инфаркта миокарда стабильной стенокардии способно частично нивелировать отрицательные эффекты, уменьшая преимущественно показатели, характеризующие ишемию миокарда.
- 9. У больных с сердечно-сосудистыми заболеваниями наличие синдрома обстуктивного апноэ сна прямо коррелирует с увеличением числа одновременно сосуществующих традиционных факторов риска, включающихся в патофизиологический механизм развития и течения основного заболевания.
- 10. Модификация образа жизни с увеличением физической активности и изменением диетических привычек улучшает клинические характеристики состояния больных с сердечно-сосудистыми заболеваниями и синдромом обструктивного апноэ сна, повышает приверженность их к лечению. Однако необходимо совершенствование образовательных программ для интенсификации лечебного процесса.
- 11. Использование потенциала «Центров Здоровья» с целью более активной диспансеризации, улучшает как характеристики обструктивного апноэ сна, так и гемодинамические параметры работы сердечно-сосудистой системы и способствует повышению приверженности больных к проводимому амбулаторному лечению.
Практические рекомендации
- 1. При амбулаторном обследовании больных с подозрением на обструктинные эпизоды апноэ во время сна целесообразно начинать диагностический поиск с использования Берлинского анкетного опросника с последующим проведением кардио-пульмонального мониторирования.
- 2. Для оценки наличия и определения тяжести синдрома обструктивного апноэ сна больным в амбулаторных условиях помимо кардио-респираторного мониторирования необходимо проведение суточного мониторирования артериального давления, оценивать систолическую и диастолическую функции левого желудочка с помощью эхокардиорграфии и изучать биохимические маркеры системного воспаления, фиброза и липидного профиля крови.
- 3. В план лечения больных артериальной гипертензией при синдроме обструктивного апноэ сна целесообразно включать спиролактон, а у лиц, перенесших инфаркт миокарда при обструктивных остановках дыхания во вне — розувастатин, благоприятно влияющие как на степень нарушений дыхания, так и на гемодинамические показатели функционирования сердечно-сосудистой системы.
- 4. При амбулаторном наблюдении за больными с сердечно-сосудистыми заболеваниями и синдромом обструктивного апноэ сна необходимо активно выявлять традиционные сердечно-сосудистые факторы риска, обращая особое внимание на окружность талии, концентрацию в крови триглицеридов, фактор курения и отягощенный семейный анамнез по сердечно-сосудистысм заболеваниям. При этом для риск-стратификации этих пациентов целесообразно использовать методику PROCAM.
- 5. При проведении амбулаторной реабилитации больных с сердечно-сосудистыми заболеваниями и синдромом обструктивного апноэ сна необходимы активные вмешательства в виде модификации образа жизни, направленные на уменьшение сердечно-сосудистых факторов риска.
- 6. Улучшение приверженности к амбулаторному лечению больных с сердечно-сосудистыми заболеваниями и синдромом обструктивного апноэ сна можно достичь применяя новые медицинские телекоммуникационные технологии и использования потенциала «Центров Здоровья».
Список работ, опубликованных по теме диссертации
- 1. Иванов А. П. Сравнительные возможности оценки коронарного резерва у больных, перенесших инфаркт миокарда неинвазивными методами [Текст]. / АП. Иванов, В. В. Ростороцкая, В. Г. Патрикеев // Материалы 5-го Росс научного форума «Кардиология 2003», Москва 2003. с.142−143.
- 2. Иванов А. П. Вегетативный баланс и некоторые показатели суточного мониторирования ЭКГ у больных, перенесших инфаркт миокарда [Текст]. / А. П. Иванов, И. А. Эльгардт, В. В. Ростороцкая //Клиническая медицина. — 2003. — № 10. — С. 24−26.
- 3. Ростороцкая В. В. Оценка эффективности и безопасности длительного применения симвастатина у больных с ИБС и ГЛЖ в амбулаторных условиях [Текст]. / В. В. Ростороцкая //РМЖ. — 2008. — № 16. — С. 1060−1064.
- 4. Иванов А. П. Аритмии и апноэ сна у больных, перенесших инфаркт миокарда, при их амбулаторной реабилитации [Текст]. / А. П. Иванов, И. А. Эльгардт, Н. С. Сдобнякова, В. В. Ростороцкая //Сердечная недостаточность-2010. Тезисы конгресса. Москва, 2010. с 54.
- 5. Иванов А. П. Риск развития аритмий у больных артериальной гипертензией с обструктивным апноэ сна: роль дисперсии интервала QT в сочетании с ремоделированием левого желудочка [Текст]. /А.П. Иванов, И. А. Эльгардт, Н. С. Сдобнякова, В. В. Ростороцкая // Тезисы докладов образовательного форума «Профилактическая кардиология 2011». Москва 2011. с. 48−49.
- 6. Эльгардт И. А. Эффективность применения программы модификации образа жизни, направленной на снижение веса у больных артериальной гипертензией и обструктивным апноэ сна [Текст]. / И. А. Эльгардт, В. В. Ростороцкая, А. П. Иванов // Кардиоваскулярная профилактика и реабилитация 2011. Тезисы докладов. Москва 2011. с 93.
- 7. Иванов А. П. Arrhythmia and sleep apnea at the patients who have transferred a myocardial infarction, at their out-patient rehabilitation [Текст]. / А. П. Иванов, И. А. Эльгардт, Н. С. Сдобнякова, В. В. Ростороцкая // Материалы 14 Всемирного конгресса холтеровского мониторирования и неинвазивной электрокардиологии. Москва 2011. с 129−130.
- 8. Иванов А. П. Значение регулярных физических тренировок у больных артериальной гипертензией с синдромом обструктивного апноэ сна [Текст]. / А. П. Иванов, В. В. Ростороцкая, И. А. Эльгардт, Н. С. Сдобнякова // CardioСоматика 2011.1. Приложение 1. с. 50.
- 9. Иванов А. П. Риск развития фибрилляции предсердий у больных ИБС с обструктивным апноэ сна [Текст]. / А. П. Иванов, В. В. Ростороцкая, И. А. Эльгардт, Д. В. Дедов // Тезисы Российского конгресса аритмологов. Москва 2011. с.78−79.
- 10. Ростороцкая В. В. Апноэ сна и эпизоды дневной сонливости у больных, перенесших инфаркт миокарда, и их связь с ожирением и артериальной гипертензией [Текст]. / В. В. Ростороцкая, А. П. Иванов, И. А. Эльгардт // Кардиология и сердечно-сосудистая хирургия 2011. — № 4. — С. 11−14.
- 11. Дедов Д. В. Предикторы неблагоприятного прогноза у больных с фибрилляцией предсердий по данным холтеровского мониторирования электрокардиограммы и пульсоксиметрии [Текст]. / Д. В. Дедов, А. П. Иванов, И. А. Эльгардт, В. В. Ростороцкая // Вестник аритмологии 2011. — № 63. — С. 22−27.
- 12. Иванов А. П. Особенности хронотропного ответа на физическую нагрузку у больных с систолической сердечной недостаточностью и синдромом обструктивного апноэ во время сна [Текст]. / А. П. Иванов, И. А. Эльгардт, В. В. Ростороцкая // Кардиология 2011. — № 8. — С. 45−48.
- 13. Иванов А. П. Роль метаболического синдрома у больных ИБС и артериальной гипертензией, осложненных синдромом обструктивного апноэ сна [Текст]. / А. П. Иванов, В. В. Ростороцкая, И. А. Эльгардт, Н. С. Сдобнякова // Материалы Российского конгресса кардиологов 2011. Кардиоваскулярная терапия и профилактика 2011. 6. Приложение 1. с.129−130.
- 14. Ростороцкая В. В. Синдром обструктивного апноэ сна и риск сердечно-сосудистых осложнений у больных после инфаркта миокарда [Текст]. / В. В. Ростороцкая, А. П. Иванов, И. А. Эльгардт // Врач. 2011. — № 11. — С. 41−43.
- 15. Иванов А. П. Плейотропные эффекты розувастатина при реабилитации после инфаркта миокарда [Текст]. / А. П. Иванов, В. В. Ростороцкая, И. А. Эльгардт // Врач. 2011. — № 11. — С. 25−27.
- 16. Иванов А. П. Динамика показателей функционального состояния сердца при сердечной недостаточности и артериальной гипертензии, ассоциированной с синдром обструктивного апноэ сна [Текст]. / А. П. Иванов, В. В. Ростороцкая, И. А. Эльгардт, Н. С. Сдобнякова // Тезисы докладов VI конгресса Сердечная недостаточность 2011. Москва 2011. с 13.
- 17. Иванов А. П. Риск развития аритмий у больных артериальной гипертензией с апноэ сна: роль дисперсии интервала QT в сочетании с ремоделированием левого желудочка [Текст]. / А. П. Иванов, В. В. Ростороцкая, И. А. Эльгардт, Н. С. Сдобнякова // Профилактическая медицина 2011. — № 6. — С. 55−56.
- 18. Иванов А. П. Особенности сердечных аритмий у кардиологических больных, находящихся в блоке интенсивной терапии, в связи с нарушениями дыхания во сне [Текст]. / А. П. Иванов, В. В. Ростороцкая, Д. В. Клюквин, И. А. Эльгардт // Материалы Всероссийского научно-образовательного форума Кардиология-2012. Москва 2012. с. 70.
- 19. Иванов А. П. Сердечно-сосудистое ремоделирование и маркеры общего атеросклеротического процесса у пациентов с артериальной гипертензией в связи с обструктивным апноэ сна [Текст]. / А. П. Иванов, И. А. Эльгардт, В. В. Ростороцкая // Материалы Всероссийского научно-образовательного форума Кардиология-2012. Москва 2012. с.70−71.
- 20. Ростороцкая В. В. Субъективные характеристики сна, эпизоды апноэ и дневной сонливости у больных с систолической сердечной недостаточностью: возможности клинико-функционального амбулаторного обследования [Текст]. / В. В. Ростороцкая, А. П. Иванов, И. А. Эльгардт // Терапевтический архив 2012. — № 1. — С. 8−11.
- 21. Ростороцкая В. В. Обструктивное апноэ во время сна, артериальная гипертензия и ожирение: клинико-функциональные аспекты [Текст]. / В. В. Ростороцкая, А. П. Иванов, И. А. Эльгардт // Клиническая медицина 2012. — № 2. — С. 27−30.
- 22. Ростороцкая В. В. Анализ возможностей риск-стратификации на основе различных шкал для прогнозирования возможных осложнений синдрома обструктивного апноэ сна [Текст]. / В. В. Ростороцкая, А. П. Иванов, Д. В. Клюквин, И. А. Эльгардт // Профилактическая медицина 2012. 2. вып 2. 122−123.
- 23. Иванов А. П. Значение теста 6-минутной ходьбы в оценке эффективности программы физичекой реабилитации у пациентов, перенесших инфаркт миокарда с обструктивным апноэ сна [Текст]. / А. П. Иванов, В. В. Ростороцкая, Д. В. Клюквин, И. А. Эльгардт // Профилактическая медицина 2012. 2. вып 2. 60−61.
- 24. Иванов А. П. Особенности циркадного ритма артериального давления у больных артериальной гипертензией с синдромом обструктивного апноэ во сне, в зависимости от увеличения массы тела [Текст]. / А. П. Иванов, В. В. Ростороцкая, И. А. Эльгардт // Кардиоваскулярная терапия и профилактика 2012. — № 2. — С. 24−28.
- 25. Иванов А. П. Динамика состояния больных инфарктом миокарда с предшествующей стабильной стенокардией в анамнезе в связи с обструктивным апноэ сна [Текст]. / А. П. Иванов, В. В. Ростороцкая, И. А. Эльгардт, Д. В. Клюквин // Российский кардиологический журнал 2012. — № 2. _ С. 21−26.
- 26. Ростороцкая В. В. Нарушения ритма сердца у больных с обструктивным апноэ сна, перенесших инфаркт миокарда, на амбулаторном этапе реабилитации [Текст]. / В. В. Ростороцкая, А. П. Иванов, И. А. Эльгардт, Н. С. Сдобнякова // Кардиология 2012. — № 5. — С. 4−7.
- 27. Иванов А. П. Роль комбинированного мониторирования ЭКГ, АД и дыхания, как метода контроля амбулаторного лечения артериальной гипертензии у больных с обструктивным апноэ сна [Текст]. / А. П. Иванов, В. В. Ростороцкая, Д. В. Клюквин, И. А. Эльгардт // Функциональная диагностика — Тезисы докладов конф. 2012. 1. 134.
- 28. Иванов А. П. Возможности электрои эхокардиографического контроля выраженности гипертрофии левого желудочка при длительном амбулаторном наблюдении за больными с артериальной гипертензией с избыточной массой тела и обструктивным апноэ сна [Текст]. / А. П. Иванов, В. В. Ростороцкая, Д. В. Клюквин, И. А. Эльгардт, Н. С. Сдобнякова // Московский международный форум кардиологов. Тезисы докладов. Москва 2012. с. 36.
- 29. Иванов А. П. Клинико-инструментальные особенности сочетания стабильного течения сердечной недостаточности и обструктивного апноэ сна: роль амбулаторного кардиореспираторного мониторирования [Текст]. / А. П. Иванов, В. В. Ростороцкая, И. А. Эльгардт, Д. В. Дедов, Н. С. Сдобнякова // Журнал Сердечная недостаточность 2012. — № 2. — С. 87−90.
- 30. Иванов А. П. Синдром обструктивного апноэ сна и его место в риск-стратификации больных инфарктом миокарда при их амбулаторной реабилитации [Текст]. / А. П. Иванов, В. В. Ростороцкая // Верхневолжский мед журнал 2012. — № 2. — С. 7−10.
- 31. Ростороцкая В. В. Суммарный риск развития коронарных осложнений у кардиологических больных в связи с наличием храпа, дневной сонливости и синдрома обструктивного апноэ сна [Текст]. / В. В. Ростороцкая, А. П. Иванов, И. А. Эльгардт //Терапевтический архив 2012. — № 9. — С.76−79.
- 32. Иванов А. П. Роль центра здоровья в снижении массы тела как метода профилактики осложнений сердечно-сосудистых заболеваний у пациентов с обструктивным апноэ сна [Текст]. / А. П. Иванов, В. В. Ростороцкая, И. А. Эльгардт // Росс национальный конгресс кардиологов 2012. Тезисы докладов. М. 2012. 170−171.
Список сокращений
АГ — артериальная гипертензия АД — артериальное давление ВЗРН — время замедления раннего наполнения ЛЖ ВНС — вегетативная нервная система ВСР — вариабельности сердечного ритма ВСС — внезапная сердечная смерть ГЛЖ — гипертрофия левого желудочка ДАД — диастолическое АД ДДФ — диастолическая дисфункция ДЛЖ — дилатация ЛЖ ДЛП — дилатация ЛП ИАГ — индекс апноэ/гипопноэ ИБС — ишемическая болезнь сердца ИВ — индекс времени ИДС — избыточная дневная сонливость ИМ — инфаркт миокарда ИММЛЖ — индекс массы миокарда ЛЖ ИМТ — индекс массы тела.
КГЛЖ — концентрическая гипертрофия левого желудочка КГЛЖ — концентрическая гипертрофия ЛЖ.
КРЛЖ — концентрическое ремоделирование ЛЖ ЛЖ — левый желудочек ЛП — левое предсердие ММЛЖ — масса миокарда ЛЖ ОР — относительный риск ОТС — относительная толщина стенки ОШ — отношения шансов ПАД — пульсовое АД ПИКС — постинфарктный кардиосклероз ПСГ — полисомнография ПСНС — парасимпатическая нервная система САД — систолическое АД СМАД — суточное мониторирование АД СНС — симпатическая нервная система СОАС — синдром обструктивного апноэ сна СРАР — терапия — лечение дыханием с положительным давлением на вдохе ССЗ — сердечно-сосудистые заболевания ТГ — триглицериды ФВ — фракция выброса ФП — фибрилляция предсердий ФР — факторы риска ХИБС — хроническая ишемическая болезнь сердца ХМ — холтеровское мониторирование ХСН — хроническая сердечная недостаточность ЧПЭС — чреспищеводная электростимуляция ЧПЭФИ — чреспищеводное ЭФИ ЧСС — частота сердечных сокращений ЭГЛЖ — эксцентрическая гипертрофия ЛЖ.
ЭКГ — электрокардиография ЭКС — электрокардиостимуляция ЭФИ — электрофизиологическое исследование.