Изучение связывания катионов цинка с человеческим сывороточным гамма-глобулином

Зависимость прироста оптической плотности в растворе г-глобулина, связавшего цинк, от количества связанного металла, свидетельствует о последовательном заполнении катионами белковых сайтов разной пространственной локализации. При этом связывание начинается с внутренних районов молекулы г-глобулина и вызывает ее выраженную компактизацию (рис.2). Связывание металла внешними сайтами белковой глобулы… Читать ещё >
Изучение связывания катионов цинка с человеческим сывороточным гамма-глобулином (реферат, курсовая, диплом, контрольная)
Известно, что входящие в состав металлоферментов катионы цинка образуют поперечные связи в их активных центрах, участвуют в формировании общей структуры активного центра и его конформационной динамики. Установлена способность цинка активно связываться белками, гликопротеинами и аминокислотами плазмы крови, что определяет достаточно стабильный уровень присутствия этих катионов в биологических жидкостях и тканях организма. При этом образование белковых металлокомплексов с цинком может приводить к появлению и реализации принципиально новых свойств биополимеров.
Многопланова и разнообразна роль цинка в иммуногенезе. Он определяет биологическую активность тимулина, контролирует ранние стадии созревания Т-лимфоцитов, апоптоз, играет важную роль в обеспечении выработки и рецепции цитокинов, непосредственно участвует в протекании основных иммунных реакций, в т. ч. реакций естественной и специфической цитотоксичности.
Физиологическое содержание цинка в плазме оценивают на уровне 10−20 мкМ, в то время как концентрация свободных, биологически активных катионов составляет порядка 0.2−1.0 нМ. И хотя множественность опосредуемых цинком эффектов позволяет предполагать, что называемая концентрация свободного металла существенна занижена по сравнению с его реальным содержанием и участием в метаболических процессах, понятно: хелатирование даже незначительных количеств катионов при их взаимодействии с белками сыворотки может создавать ощутимый дефицит цинка в микроокружении и выражено изменять интенсивность и динамику замкнутых на транспорт и обмен металла гуморальных и клеточных иммунных реакций.
Нашими предшествующими исследованиями обнаружена способность белков г-глобулиновой фракции взаимодействовать с катионами цинка в растворе. Очевидные изменения конформации белка, проявляющиеся в зависимости от концентрации цинка, развертыванием молекулы во внемолекулярное пространство либо — компактизацией глобулы, указывают на происходящее при этом связывание металла сайтами, локализованными на поверхности молекулы г-глобулина или в ее междоменном пространстве.
иммунный реакция цинк белок.
Методика исследования
Использовали препарат человеческого сывороточного г-глобулина (Serva) в 0.15 М растворе NaCl (pH 7.12−7.15) с концентрацией белка 100 мкг/мл. Освобожденные от крупных ассоциатов мембранной фильтрацией (0.45 мкм, Millipore) образцы г-глобулина инкубировали в течение 1 час при 37 °C с осветленным (0.22 мкм, Millipore) хлоридом цинка, примененным в концентрациях металла от 1.0 до 4.5 мкг/мл. В качестве контроля использовали образцы г-глобулина, инкубированные в тех же условиях, но без хлорида цинка.
По истечении срока инкубации опытные и контрольные образцы в объеме 5.0 мл подвергали молекулярной ультрафильтрации на конусах CF-25 (Amicon) в режиме 300 g, 10−15 мин, 20 °C. Объем в конусах доводили до первоначального 0.15 М раствором NaCl и повторяли фильтрацию в прежнем режиме. Супернатанты поднимали из конусов, вновь доводили до исходного объема и анализировали спектрофотометрически в ультрафиолете, в диапазоне длин волн от 190 до 320 нм с шагом 10 нм, в полуавтоматическом режиме с использованием дифференцирующего спектрофотометра PU 8730 UV/VIS (Philips). Спектрофотометрический контроль образцов осуществляли также на всех предшествующих этапах исследования.
Содержание свободного цинка в фильтрате оценивали реакцией комплексообразования с о-фенантролином в 0.15 М растворе NaCl при нейтральном рН, с использованием спектрофотометрии при длине волны 226 нм. Постановку реакции осуществляли с применением разработанного нами методического подхода: для построения калибровочной кривой и учета результатов разведение о-фенантролина подбирали опытным путем — так, чтобы уровень его поглощения обеспечивал линейную зависимость показателей оптической плотности образующегося с цинком комплекса от концентрации цинка в исследуемом диапазоне. Использованные концентрации о-фенантролина составили от 3.5×10-5 до 7.0×10-5 М.
Расчет показателей изменения оптической плотности и молярных отношений в растворе осуществляли на основании концентрации г-глобулина, установленной спектрофотометрически при длине волны 280 нм (коэффициент экстинкции 0.7). Кислотность образцов контролировали с помощью электронного рН-метра-иономера Эксперт-001 (Эконикс-Эксперт).
Результаты исследования В соответствии с результатами предшествующих исследований, инкубация г-глобулина в растворе с надфизиологическим содержанием катионов цинка приводит к развертыванию молекулы белка в периглобулярное пространство, что может рассматриваться как проявление тенденции к денатурации исходного образца [5, 6]. Удаление из раствора не связавшегося с белком (свободного) цинка возвращает спектр поглощения г-глобулина в состояние, близкое к контрольному, и обнаруживает гипохромию, свидетельствующую о компактизации глобулы в условиях встраивания определенных количеств цинка в ее внутренние компартменты (рис.1).
Следовательно, после удаления избытка металла присоединивший катионы цинка г-глобулин переходит в более близкую к нативной конформацию, что говорит о его способности к ренатурации. Полученные данные соответствуют имеющимся сведениям о низкой редокс-активности цинка в межмолекулярных взаимодействиях и указывают на обратимость внемолекулярного развертывания белка при взаимодействии с металлом.
Концентрации цинка, связывающегося с г-глобулином, не превышают 30−40 мкМ. Они оказываются выше физиологических [7, 10] и выше порога содержания цинка в плазме, допускаемого в ходе терапевтического применения препаратов металла [8], но не проявляют токсичность на клетках человека [13]. Поэтому, в условиях обмена металлом присоединивший цинк г-глобулин не будет обладать токсическими свойствами в отношении взаимодействующих с ним или фиксирующих его на мембране клеточных элементов.
Зависимость прироста оптической плотности в растворе г-глобулина, связавшего цинк, от количества связанного металла, свидетельствует о последовательном заполнении катионами белковых сайтов разной пространственной локализации. При этом связывание начинается с внутренних районов молекулы г-глобулина и вызывает ее выраженную компактизацию (рис.2). Связывание металла внешними сайтами белковой глобулы приводит к развертыванию структуры во внемолекулярное пространство с одновременным нарастанием поглощения в растворе г-глобулина. Это происходит до присоединения того количества цинка (около 27 мкМ), которое вызывает экспрессию ранее скрытых металлосвязывающих сайтов. Дальнейшее связывание катионов вновь происходит по внутренним участкам молекулы и заполняет внутренние области белковой глобулы или связи, открывшиеся в результате конформационных изменений молекулы, произошедших при фиксации цинка на внешних связях. Оптическая плотность раствора начинает снижаться за счет естественной при этом компактизации (рис.2).
Согласно результатам полученным сотрудниками лаборатории, насыщение внутренних компартментов молекулы отмечается при связывании, примерно, 40 мкМ цинка; далее металл продолжает действовать на внешних связях г-глобулина, вторично развертывая содержащую цинк внутри глобулы структуру.
Сказанное подтверждается расчетом графиков Скэтчарда (рис.3). Он обнаруживает присутствие в составе белковой глобулы нескольких групп металлосвязывающих сайтов, характеризующихся различными, параметрами связывания. Точки 2 и 3 на рис. 3, очевидно, относятся к взаимодействию с цинком сайтов связывания, существенно отличных от таковых, описанных отрезком. Следовательно, присоединение металла действительно осуществляют сайты разной пространственной локализации, которые заполняются катионами поэтапно, по мере насыщения цинком определенных участков молекулы белка. Довольно резкие переходы с одной группы сайтов на другую свидетельствуют о неэквивалентности и зависимости друг от друга обнаруживаемых в г-глобулине центров связывания цинка (рис.3).
Обнаружение в условиях взаимодействия г-глобулина с катионами цинка скачкообразных конформационных переходов, по-видимому, отражает уникальную структурную организацию белка, способного, в зависимости от принимаемой конформации, определяемой, в том числе, состоянием локального микроокружения, экспрессировать сайты, существенно разнящиеся всей совокупностью физико-химических характеристик структуры, в которую встраивается катион металла.
Полученные в нашем исследовании данные служат указанием на отмеченную ранее положительную кооперативность реакции. Присоединение цинка частью аминокислотных остатков или олигосахаридов талии молекулы белка создает конформационные предпосылки к экспрессии скрытых пространственной конфигурацией глобулы сайтов связывания металла. Это позволяет предполагать, что в процессе взаимодействия с катионами цинка г-глобулин проходит последовательную смену ряда конформаций и может, таким образом, находиться в нескольких конформационных состояниях.
Рассчитанная константа связывания цинка с г-глобулином составляет М-1. Это говорит об относительно слабом связывании и непрочности образуемых г-глобулином с цинком комплексов. Она близка константам, описывающим взаимодействие цинка с отдельными сайтами стафилококкового энтеротоксина, А (5×105 М-1), оказывается несколько ниже параметров взаимодействия с другими белками и одноцепьевыми фрагментами молекулы IgG (106 М-1), на 2 порядка отлична от показателей связывания цинка специализированными сайтами модельных пептидов (4×107 М-1) и практически совпадает с константами связывания г-глобулином катионов меди (1.6−3.3×105 М-1). Тем самым, г-глобулин и, следовательно, полноразмерные антитела по параметрам связывания цинка принципиально не отличаются от других биомакромолекул, неспецифически присоединяющих металл. В то же время, как отмечали ранее, динамика связывания металла и особенности структурной организации г-глобулинов и антител существенно выделяют эти белки из числа других биологически активных макромолекул. Сказанное подтверждается результатами наших опытов, свидетельствующими о способности белков г-глобулиновой фракции присоединять, в среднем, до 50 катионов цинка на молекулу, что например в 2−3 раза превышает емкость белка для катионов меди.
С учетом особенностей действия цинка, проявляющихся в ходе его взаимодействия с г-глобулином сродством к внутриглобулярным структурам и интенсивным встраиванием в сайты междоменного пространства, внутренние участки молекулы белка, включая как собственно шарнирную область, так и центры связывания, открывающиеся в динамике конформационных изменений, следующих за присоединением определенных количеств металла, обоснованно представляются районами, способными связывать и, вероятно, удерживать достаточные для реализации регистрируемых конформационных перестроек количества цинка.
Полученные в нашей работе данные следует принимать во внимание в контексте терапевтического использования цинка и содержащих его препаратов, поскольку связывание г-глобулином значительного количества металла, пусть даже носящее неспецифический характер, в диапазонах физиологических и применяемых в клинике концентраций катионов может выраженно изменять распределение цинка в биологических жидкостях организма и тем самым естественно смещать действующий вектор транспорта и обмена этих иммуноактивных катионов.
Заключение
В современной клинической фармакологии широко внедряются методы коррекции иммунопатологических состояний, предполагающие, как терапевтическое использование цинка или содержащих его препаратов, так и хелатирование катионов металла, обеспечивающее поддержание иммунорегуляторного баланса, либо инактивацию цинка в активных центрах ферментов, в частности — играющих ключевую роль в ремоделировании опухолевой ткани.
- 1. Авицын А. П., Жаворонков А. А., Риш М. А., Строчкова Л. С. Микроэлементозы человека: этиология, классификация, органопатология. — М., Медицина, 1991. — 496 с.
- 2. Бабаева Е. Е., Воробьёва У. А., Жаркова М. С., Чекнёв С. Б. // Бюлл. эксперим. биол. и медицины. — 2005, в печати.
- 3. Волькенштейн М. В. // Молек. биология. — 1991. — Т.25, № 4. — С.883−925.
- 4. Киселёв С. М., Луценко С. В., Северин С. Е., Северин Е. С. // Биохимия. — 2003. — Т.68, № 5. — С.611−631.
- 5. Лим В. И. // Биофизика. — 1991. — Т.36, № 3. — С.441−454.
- 6. Чекнёв С. Б., Бабаева Е. Е., // Мед. иммунология. — 2004. — Т.6, № 3−5. — С. 186−189.
- 7. Чекнёв С. Б., Бабаева Е. Е., Воробьёва У. А., Денисова Е. А. // Мед. иммунология. — 2005, в печати.
- 8. Чекнёв С. Б., Бабаева Е. Е., Воробьёва У. А., Денисова Е. А. // Бюлл. эксперим. биол. и медицины. — 2005. — Т.140, № 8. — С.177−180.
- 9. Чекнёв С. Б., Бабаева Е. Е., Жаркова М. С., и др. // Бюлл. эксперим. биол. и медицины. — 2005. — Т.139, № 5. — С.528−532.
- 10. Чекнёв С. Б., Бабаева Е. Е., Жаркова М. С., и др. // Иммунология. — 2005. — Т.26, № 3. — С.146−150.
- 11. Aiken S.P., Horn N.M., Saunders N.R. // J. Phisiol. — 1998. — V.273, Jan. — P.69−80.
- 12. Borza D.-B., Morgan W.T. // J. Biol. Chemistry. — 1998. — V.273, N10. — P.5493−5499.
- 13. Coto J.A., Hadden E.M., Sauro M. et all. // Proc. Natl. Acad. Sci. USA. — 1992. — V.89, N16. — P.7752−7756.
- 14. Driessen C., Hirv K., Kirchner H., Rink L. // Immunology. — 1995. — V.84, N2. — P.272−277.
- 15. Fabris N., Mocchgiani E., Muzzioli M., Provinciali M. // Biomedical Advances in Aging / Ed. By A.L.Goldstein. — New York, Plenum Press, 1989. — P.271−281.
- 16. Fraser J.D., Urban R.G., Strominger J.L., Robinson H. // Proc. Natl. Acad. Sci. USA. — 1992. — V.89, N12. — P.5507−5511.
- 17. Gorgani N.N., Parish C.R., Easterbrook Smith S.B., Altin J.G. // Biochemistry. — 1997. — V.36, N22. — P.6653
- 18. Gorgani N.N., Parish C.R., Altin J.G. // J. Biol. Chemistry. — 1999. — V.274, N42. — P.29 633−29 640.
- 19. Magneson G.R., Puvathingal J.M., Ray W.J., Jr. // J. Biol. Chemistry. — 1987. — V.262, N23. — P.11 140−11 148.
- 20. Oblender M., Carpentieri U. // J. Cancer Res. Clin. Oncol. — 1991. — V.117, N5. — P.444−448.
- 21. Provinciali M., Di Stefano G., Fabris N. / Int. J. Immunopharmacol. — 1995. — V.17, N9. — P.753−744
- 22. Regan L., Clarke N.D. // Biochemistry. — 1990. — V.29, N49. — P.10 878−10 883.
- 23. Rink L., Kirchner H. // J. Nutrition. — 2000. — V.130, suppl.5. — P.1407−1411.
- 24. Roberts V.A., Iverson B.L., Iverson S.A. et al. // Proc. Natl. Acad. Sci. USA. — 1990. — V.87. — P.6654−6658.
- 25. Schroeder J.J., Cousins R.J. // Proc. Natl. Acad. Sci. USA. — 1990. — V.87, N8. — P.3137−3141.
Приложение
Рис. 1. Спектры поглощения в ультрафиолете человеческого сывороточного г-глобулина в процессе связывания катионов цинка.
По оси абсцисс: длина волны, нм. По оси ординат: оптическая плотность, ед.
Спектры белка: 1 — после инкубации в течение 1 час при 37 °C в 0.15 М растворе NaCl; 2 — после инкубации в течение 1 час при 37 °C в том же растворе, содержащем ZnCl2 с концентрацией цинка 5.0 мкг/мл; 3 — восстановленного в 0.15 М растворе NaCl после контрольной (без цинка) ультрафильтрации; 4 — связавшего цинк и восстановленного в 0.15 М растворе NaCl после удаления свободного металла молекулярной ультрафильтрацией.
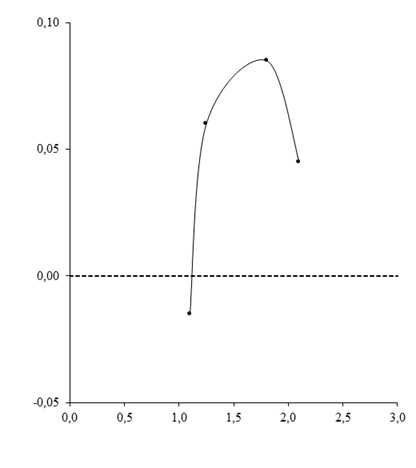
Рис. 2. Изменение показателей поглощения в растворе человеческого сывороточного г-глобулина, связавшего катионы цинка. Оценка при длине волны 280 нм.
По оси абсцисс: концентрация связанного металла ([Zn2+] связ.), мкг/мл. По оси ординат: изменение показателей оптической плотности, ед.
Рис. 3. График Скэтчарда, полученный при связывании катионов цинка с человеческим сывороточным г-глобулином.
По оси абсцисс: концентрация связанного металла ([Zn2+] связ.), мкМ. По оси ординат: отношение концентраций связанного и свободного металла ([Zn2+] связ./[Zn2+] своб.).
Рассчитанная константа связывания цинка: 1 — М-1