Симптом изжоги в свете Римских критериев IV

В клинической практике интернисту и гастроэнтерологу наиболее часто приходится проводить дифференциальный диагноз между НЭРБ, гиперсенситивным пищеводом и ФИ. Говоря о патогенетических отличиях данных состояний, следует отметить, что в случае классической НЭРБ у пациента имеются патологические забросы как кислого, так и некислого содержимого желудка в пищевод, которые, как правило, ассоциированы… Читать ещё >
Симптом изжоги в свете Римских критериев IV (реферат, курсовая, диплом, контрольная)
Изжога — один из наиболее распространенных соматических симптомов. В РФ он встречается у 40% людей в возрасте от 18 до 59 лет и у 30% - в возрасте старше 60 лет. В статье подробно рассматривается патофизиология возникновения изжоги у пациентов с рефлюксным эзофагитом (РЭ) и неэрозивной рефлюксной болезнью (НЭРБ), при которой могут выявляться такие патологические состояния, как гиперсенситивный пищевод (ГП) или функциональная изжога (ФИ). Для диагностики и разграничения ГЭРБ и ГП от ФИ применяют микроскопическое исследование слизистой дистальной части пищевода. Также для диагностики причин изжоги применяют ФГДС и суточную рН-импедансометрию. Согласно Римским критериям IV, группа функциональных расстройств пищевода включает в себя: функциональную боль в груди, ФИ, ГП, ком в горле — «глобус» и функциональную дисфагию.
У пациентов с РЭ, НЭРБ, ГП высокоэффективна кислотосупрессивная терапия, в особенности при применении современных ингибиторов протонной помпы (ИПП). Особенностью ИПП деклансопразола является более выгодный с фармакокинетической и фармакодинамической точки зрения правовращающий изомер. Однако у пациентов с ФИ ИПП могут быть неэффективны, в этом случае нужно отдать предпочтение препаратам, уменьшающим висцеральную гиперчувствительность.
Ключевые слова: изжога, ГЭРБ, рефлюксный эзофагит, гиперсенситивный пищевод, ИПП, деклансопразол.
Вступление В XXI в. изжогу по праву можно считать одним из наиболее частых соматических симптомов. Так, в США изжога ежедневно возникает у 25 млн человек, дважды в неделю ее испытывают более 50 млн, не менее 60 млн — не реже 1 раза в месяц [1]. Российское многоцентровое эпидемиологическое исследование МЭГРЭ демонстрирует, что изжога встречается у 39,7% населения в возрасте от 18−44 лет, у 42,9% - в возрасте 45−59 лет, у 32,2% - в возрасте 60−74 лет и у 29,8% населения старше 75 лет [2].
Согласно наиболее подробному отечественному определению, изжога — это чувство жжения за грудиной и/или под ложечкой, распространяющееся снизу вверх, индивидуально возникающее в положении сидя, стоя, лежа или при наклонах туловища вперед, иногда сопровождающееся ощущением кислоты и/или горечи в глотке и во рту, нередко связанное с чувством переполнения в эпигастрии, возникающее натощак или после употребления какого-либо вида твердых или жидких пищевых продуктов, алкогольных или неалкогольных напитков и акта табакокурения [2].
Изжога наряду с регургитацией является основным классическим симптомом гастроэзофагеальной рефлюксной болезни (ГЭРБ), встречающейся примерно у 20% российской популяции [2]. Современные эпидемиологические исследования свидетельствуют, что примерно у 70% пациентов с ГЭРБ имеется неэрозивная рефлюксная болезнь (НЭРБ), а у 30% выявляется рефлюксный эзофагит (РЭ) [3]. В случае выявления НЭРБ у пациента имеются характерные беспокоящие жалобы (изжога и/или регургитация) без развития макроскопических повреждений слизистой, определяемых при проведении стандартной фиброгастродуоденоскопии (ФГДС).
В прошлом существовало представление, что изжога всегда вызывается попаданием кислого содержимого желудка с рН < 4 в пищевод, однако в процессе проведения суточных рН-метрии и рН-импедансометрии и определения индекса ассоциации симптома (сочетаемости симптома изжоги и гастроэзофагеального рефлюкса (ГЭР) во времени) данное представление было опровергнуто.
Тот факт, что пациенты с НЭРБ более резистентны к терапии ИПП по сравнению с больными с РЭ, свидетельствует о том, что в патогенезе неэрозивного варианта ГЭРБ, вероятно, задействованы нарушение сократимости мышечного слоя пищевода, гиперчувствительность слизистой, особенности функционирования нервной системы [4, 5].
В ряде исследований было продемонстрировано, что только 45% пациентов с НЭРБ имеют повышенную экспозицию кислоты в пищеводе, тогда как у 55% отмечаются нормальные показатели пищеводной рН-метрии. При этом среди больных, имеющих нормальные суточные рН-метрические показатели, были выявлены подгруппы пациентов, у которых изжога возникала на фоне слабокислого рефлюкса с рН от 4 до 7, а также тех, у которых изжога не была ассоциирована с наличием ни кислого, ни слабокислого ГЭР [6]. В схожей работе, включившей в себя 150 пациентов с НЭРБ, также было показано, что 58% больных имели нормальные показатели экспозиции кислого болюса в пищеводе, из них 32% имели положительную связь изжоги с ГЭР, а 26% - отрицательную [7]. При обследовании 200 больных с НЭРБ установлено, что лишь 81 пациент страдал классической НЭРБ, у 65 отмечался гиперсенситивный пищевод (ГП), у 54 была диагностирована функциональная изжога (ФИ) [8].
Таким образом, можно констатировать, что изжога, как правило, — проявление трех патологических состояний: ГЭРБ, ГП и ФИ. При этом следует отметить, что активное внедрение в научную и клиническую практику суточной рН-импедансометрии позволило расширить представления о классической НЭРБ как о патологии, в основе которой может лежать повышенная экспозиция в пищеводе не только кислого, но и слабокислого, и щелочного болюса.
Патофизиология симптома изжоги В основе гетерогенности симптома изжоги лежат сложные патофизиологические процессы, происходящие в слизистой дистального участка пищевода. Как отмечалось ранее, у большей части пациентов с ГЭРБ изжога возникает на фоне присутствия патологических кислых ГЭР с рН < 4. Немногочисленные и непродолжительные кислые ГЭР являются нормальным явлением и у здорового человека, т. е. являются физиологическими. Основные отличия физиологических и патологических ГЭР представлены в таблице 1.
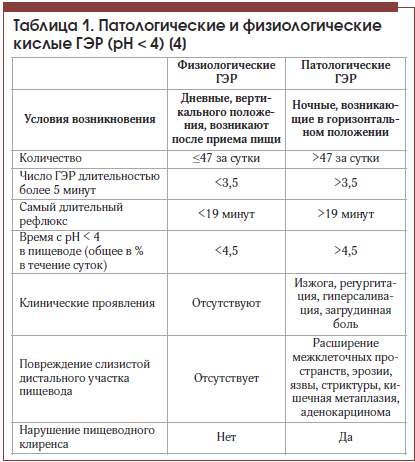
Таким образом, физиологические рефлюксы не приводят к повреждению пищевода и возникновению беспокоящих жалоб. Считается, что физиологическая изжога возникает с частотой не более 1 раза в неделю, не беспокоит ночью и не оказывает выраженного влияния на повседневную активность. Патологические же по продолжительности и количеству забросы в случае НЭРБ обусловливают возникновение более частой и интенсивной изжоги, снижающей качество жизни человека [9].
На фоне хронического закисления дистальной части пищевода в его слизистой происходит ряд патологических процессов. Наличие грыжи пищеводного отверстия диафрагмы (ГПОД), тонуса нижнего пищеводного сфинктера (НПС), частота и продолжительность ГЭР, состав рефлюктата наряду с физиологическими и патофизиологическими процессами, происходящими в слизистой дистального участка пищевода, определяют, какой вариант ГЭРБ разовьется у пациента — НЭРБ (70%) или эрозивная форма ГЭРБ (30%) [10]. Со стороны слизистой оболочки пищевода вероятность развития эрозивного повреждения может определяться различными фенотипами пациентов с ГЭРБ, в частности, особенностями воспалительной и иммунной реакции слизистой в ответ на диффузию Н+, простагландиновым, цитокиновым профилем, особенностями образования и обезвреживания активных форм кислорода [11].
У пациентов с НЭРБ, РЭ и ГП начальной реакцией на хроническое попадание желудочного рефлюктата в пищевод является расширение межклеточных пространств в слизистой дистального отдела пищевода, что в дальнейшем обусловливает более легкую диффузию ионов водорода в межклеточные пространства, раздражение хеморецепторов и возникновение ощущения изжоги. Попадание Н+ вглубь слизистой пищевода приводит к запуску воспалительного каскада, который, по всей видимости, имеет фенотипические отличия у пациентов с НЭРБ и РЭ. Так, воздействие Н+ на клетки слизистой у пациентов с РЭ приводит к более выраженной продукции цитокинов, в частности интерлейкина-8 и фактора активации тромбоцитов, которые обеспечивают миграцию лейкоцитов в очаг воспаления и продукцию большего количества Н2О2, что обусловливало развитие более выраженного деструктивного воспаления в слизистой [11].
Отличия процессов, происходящих в слизистой у пациентов с НЭРБ и РЭ, также были продемонстрированы в многоцентровом исследовании, включившем в себя 135 пациентов с ГЭРБ. Исследование показало, что микроскопический эзофагит, проявлявшийся расширением межклеточных пространств, утолщением сосочкового слоя и гиперплазией базальных клеток, обнаруживается более чем у 90% пациентов с РЭ, но только приблизительно у 2/3 пациентов с НЭРБ, при этом выраженность инфильтрации иммунокомпетентными клетками была значительно выше в группе РЭ [12].
В настоящее время одним из способов разграничения ГЭРБ и ГП от ФИ является микроскопическое исследование слизистой дистальной части пищевода. Микроскопический эзофагит, в основном проявляющийся расширением межклеточных пространств, выявляется у 15% здоровых людей, 13% пациентов с ФИ, 65% - с ГП и 77% больных ГЭРБ [13].
Особенностью пациентов с НЭРБ по сравнению с пациентами с РЭ является то, что данные больные характеризуются более выраженной чувствительностью пищевода к химическим и механическим раздражителям вследствие повышенной экспрессии чувствительных к кислоте рецепторов в эпителиальном слое и особенностей функционирования афферентных волокон в собственной пластинке слизистой пищевода [14].
В настоящее время основной теорией, объясняющей возникновение изжоги, является пенетрационная теория, согласно которой в основе данного симптома лежит раздражение чувствительных рецепторов слизистой дистального участка пищевода, возникающее вследствие диффузии Н+ через расширенные межклеточные промежутки слизистой. Со временем данное состояние усугубляется снижением порога болевой чувствительности рецепторного аппарата, а также гиперактивацией нейронов, расположенных в ЦНС, в частности на уровне спинного мозга. Также в патогенезе изжоги важную роль может играть растяжение пищевода желудочным болюсом [15].
Основными рецепторными структурами, способными реагировать на присутствие Н+ в слизистой пищевода, являются кислото-чувствительные ионные каналы (ASIC — Acid-SensingIonChannels) — нейронные потенциал-независимые катионные каналы, активируемые внеклеточными протонами; ванилоидные рецепторы (TRPV1), являющиеся своеобразными «интеграторами» болевой чувствительности, и пуринергические рецепторы P2X и P2Y [16]. Ванилоидные рецепторы типа TRPV1 избыточно экспрессируются на нейронах слизистой оболочки пищевода у пациентов с ГЭРБ [17]. Активация данных нейронов может усиливать изжогу, вплоть до ощущения жгучей боли, а также способна обусловливать развитие нейрогенного воспаления за счет высвобождения вещества P и пептида, связанного с геном кальцитонина (CGRP — calcitoningene-relatedpeptide). Умеренная активация данных структур может играть позитивную роль, активируя местное кровообращение, что обеспечивает возрастание протективного потенциала слизистой [18].
Функциональные расстройства пищевода в Римских критериях IV.
В настоящее время группа функциональных расстройств пищевода согласно Римским критериям IV включает в себя: функциональную боль в груди, ФИ, ГП, ком в горле — «глобус» и функциональную дисфагию.
В клинической практике интернисту и гастроэнтерологу наиболее часто приходится проводить дифференциальный диагноз между НЭРБ, гиперсенситивным пищеводом и ФИ. Говоря о патогенетических отличиях данных состояний, следует отметить, что в случае классической НЭРБ у пациента имеются патологические забросы как кислого, так и некислого содержимого желудка в пищевод, которые, как правило, ассоциированы с симптомом изжоги. Под ГП понимают состояние, когда у пациента отсутствует патологическая экспозиция болюса в пищеводе, а чувство изжоги возникает при попадании в пищевод рефлюктата с рН от 4 до 7, которого в норме здоровый человек не ощущает. При этом следует отметить, что ряд специалистов относят к ГП клинические состояния, при которых у пациента с нормальным временем экспозиции желудочного болюса в пищеводе изжога ассоциируется со всеми вариантами ГЭР. При ФИ у пациента также отсутствует патологическая экспозиция желудочного болюса в пищеводе, а чувство изжоги не ассоциировано с какими-либо ГЭР и возникает при поступлении в пищевод жидкости, к примеру, при проглатывании слюны, пищевого комка, при перистальтике пищевода.
В Римских критериях IV приводятся следующие диагностические критерии ГП:
* Симптоматика должна присутствовать по меньшей мере 2 раза в неделю.
* Симптоматика должна присутствовать в течение последних 3-х мес., при дебюте за 6 мес. до постановки диагноза.
* У пациента должны присутствовать все нижеперечисленные симптомы:
1. Ретростернальные симптомы, включая изжогу и/или загрудинную боль.
2. Нормальная эндоскопическая картина и отсутствие доказательств, что причиной симптомов является эозинофильный эзофагит.
3. Отсутствие больших эзофагеальных моторных расстройств (ахалазиякардии, обструкция пищевода, диффузный эзофагеальный спазм, пищевод jackhammer («отбойный молоток»)), других перистальтических нарушений.
4. Наличие ассоциации изжоги и ГЭР (преимущественно с рН > 4) на фоне нормальной экспозиции желудочного болюса в пищеводе, регистрируемого при проведении рН-метрии и рН-импедансометрии. При этом позитивная динамика в ответ на антисекреторную терапию не исключает диагноз.
У пациентов с ГП, так же как у пациентов с НЭРБ, выявляется расширение межклеточных пространств, при этом у данной подгруппы пациентов, возможно, имеется повышенная чувствительность к низким концентрациям Н+ как на уровне рецепторного аппарата, так и на разных уровнях ЦНС. Данные особенности могут быть обусловлены модуляцией болевой чувствительности брадикинином, гистамином и цитокинами [19−21].
В Римских критериях IV описываются следующие диагностические критерии ФИ:
* Симптоматика должна присутствовать по меньшей мере 2 раза в неделю.
* Симптоматика должна присутствовать в течение последних 3-х мес. при дебюте за 6 мес. до диагностики.
* У пациента должны присутствовать все нижеперечисленные симптомы:
1. Жжение за грудиной и/или ретростернальная боль.
2. Отсутствие позитивной клинической динамики при проведении оптимальной антисекреторной терапии.
3. Отсутствие доказательств того, что кислый и/или некислый ГЭР ассоциирован с симптоматикой заболевания по данным рН-импедансометрии или что у пациента имеется эозинофильный эзофагит.
4. Отсутствие больших эзофагеальных моторных расстройств (ахалазиякардии, обструкция пищевода, диффузный эзофагеальный спазм, пищевод jackhammer («отбойный молоток»)), других перистальтических нарушений.
Исследования с применением ФГДС и суточной рН-импедансометрии демонстрируют, что функциональный генез выявляется у 10−40% пациентов с изжогой [22]. Клинически ФИ в течение дня возникает в дневное время, может провоцироваться определенными продуктами питания, горизонтальным положением, наклонами вперед и физическими упражнениями [23]. Среди пациентов с ФИ преобладают женщины, по сравнению с пациентами с НЭРБ у них достоверно чаще встречаются другие функциональные расстройства: постпрандиальныйдистресс-синдром, тошнота, рвота, синдром раздраженного кишечника. При этом в группе пациентов с НЭРБ чаще встречается синдром эпигастральной боли. Как правило, показатели у больных с ФИ (индекс массы тела, наличие ГПОД, показатели рН-импедансометрии, особенности моторной функции гастроэзофагеальной зоны) не отличаются от популяционных показателей [23, 24].
Патогенез развития ФИ не до конца ясен, при этом в качестве рабочей гипотезы предполагается, что пациенты с ФИ являются чувствительными к механическим и/или химическим некислотным раздражителям, однако изучение этого феномена требует проведения дальнейших исследований [25]. При этом пациенты с ФИ достоверно чаще испытывают хронический стресс, страдают расстройствами тревожного или депрессивного спектра, что может приводить к извращенному восприятию процессов, происходящих в дистальном отделе пищевода [26].
Для проведения дифференциальной диагностики между пациентами с ГЭРБ, ГП и ФИ основным методом является суточная рН-импедансометрия. Алгоритм дифференциальной диагностики с применением данного метода исследования представлен на рисунке 1.
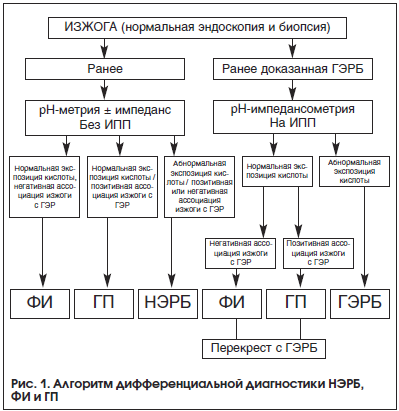
Необходимо отметить, что в клинической практике могут встречаться пациенты с синдромом «перекреста» ФИ или ГП с классической ГЭРБ. У данных пациентов с доказанной в прошлом при проведении ФГДС и/или суточной рН-импедансометрии ГЭРБ на фоне проводимой терапии ИПП сохраняется симптом изжоги. В случае негативной ассоциации симптома изжоги с ГЭР у таких пациентов диагностируется коморбидность ГЭРБ и ФИ. В случае позитивной ассоциации симптома с ГЭР у таких пациентов диагностируется коморбидность ГЭРБ и ГП.
Заключение
В серии работ, посвященных рефрактерности ГЭРБ, демонстрируется, что у 5−17% пациентов двойная доза ИПП является недостаточно эффективной [27, 28]. Одной из многочисленных причин сохранения изжоги у таких пациентов является наличие ГП и ФИ. Рассматривая последовательно цепочку заболеваний РЭ, НЭРБ, ГП и ФИ, мы можем констатировать, что роль кислотного фактора в патогенезе данных заболеваний неуклонно снижается на фоне нарастания значимости гиперчувствительности слизистой. Данный феномен представлен на рисунке.
.
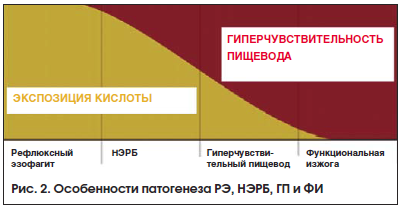
Таким образом, мы вправе ожидать высокой эффективности кислотосупрессивной терапии у пациентов с РЭ, НЭРБ, а также с ГП, в особенности при применении современных ИПП. Именно к такой категории ИПП относится правовращающий изомер лансопразола — деклансопразол (Дексилант®). Препарат был одобрен FoodandDrugAdministration (FDA) 30 января 2009 г., в Российской Федерации декслансопразол под торговым наименованием Дексилант® был зарегистрирован в 2014 г. В настоящее время основным показанием к применению данного лекарственного средства является инициальная и поддерживающая терапия у пациентов с НЭРБ и РЭ [29]. Особенностями Дексиланта® являются не только используемый правовращающий изомер декслансопразол, более выгодный с фармакокинетической и фармакодинамической точки зрения, но и уникальная форма доставки с использованием технологии двойного высвобождения. Кислотоустойчивая капсула препарата содержит 2 типа гранул, покрытых кишечнорастворимой оболочкой, которые высвобождают активное вещество в зависимости от рН в различных областях тонкого кишечника. Технология двойного высвобождения разработана для продления действия препарата: так, гранулы 1-го типа начинают высвобождать активное вещество в течение 1 ч, а гранулы 2-го типа обеспечивают второе высвобождение активного вещества через 4−5 ч после приема препарата. Данная уникальная форма доставки позволяет принимать препарат 1 р./сут и вне зависимости от приема пищи, что оказывает позитивное влияние на приверженность лечению пациентов с ГЭРБ [30, 31].
В исследовании W. Zhangetal. было продемонстрировано, что на 5-й день приема 60 мг декслансопразола у здоровых добровольцев рН в желудке поддерживается на уровне >4 в течение 17 ч. В многочисленных клинических исследованиях была показана высокая эффективность Дексиланта® у пациентов с различными формами ГЭРБ в режиме как стартовой, так и поддерживающей терапии [30−32]. Вышеописанные фармакокинетические и фармакодинамические преимущества Дексиланта® позволяют рассматривать его в качестве препарата, способного преодолевать резистентность к стандартной кислотосупрессивной терапии, в частности у пациентов с ГП [30].
Следует подчеркнуть, что, несмотря на высокую эффективность ИПП у пациентов с классической ГЭРБ, эти препараты будут практически неэффективны при применении у пациентов с ФИ. У данной когорты пациентов могут быть востребованы препараты, уменьшающие висцеральную гиперчувствительность, в частности антидепрессанты [33].
- 1. The American College of Gastroenterology Digestive Disease Specialists Committed to Quality in Patient Care. Is it just a little HEARTBURN or something more serious? 2013. 17 p. http://s3.gi.org/patients/pdfs/UnderstandGERD.pdf.
- 2. Лазебник Л. Б., Машарова А. А., Бордин Д. С. и др. Результаты многоцентрового исследования «Эпидемиология гастроэзофагеальнойрефлюксной болезни в России» («МЭГРЭ») // Терапевтический архив. 2011. № 1. С. 5−50 [Lazebnik L.B., Masharova A.A., Bordin D.S. i dr. Rezul'tatymnogocentrovogoissledovanija «Jepidemiologijagastrojezofageal'nojrefljuksnojbolezni v Rossii» («MJeGRJe») // Terapevticheskijarhiv. 2011. № 1. S. 5−50 (in Russian)].
- 3. Ronkainen J., Aro P., Storskrubb T. et al. High prevalence of gastroesophagealrefux symptoms and esophagitis with or without symptoms in the general adult Swedish population: a Kalixanda study report // Scand J Gastroenterol. 2005. Vol. 40. P. 275−285.
- 4. Orlando R.C. The pathogenesis of gastroesophageal reflux disease: the relationship between epithelial defense, dysmotility, and acid exposure // Am J Gastroenterol. 1997. Vol. 92. P. 3−5.
- 5. Trimble K.C., Pryde A., Heading R.C. Lowered oesophageal sensory thresholds in patients with symptomatic but not excess gastro-oesophageal reflux: evidence for a spectrum of visceral sensitivity in GORD // Gut. 1995. Vol. 37. P. 7−12.
- 6. Martinez S.D., Malagon I., Garewal H.S. et al. Nonerosive reflux disease (NERD) — acid reflux and symptom patterns // Aliment Pharmacol. Ther. 2003. Vol. 17. P. 537−545.
- 7. Savarino E., Zentilin P., Tutuian R. et al. The role of nonacid reflux in NERD — Lessons learned from impedancepH monitoring in 150 patients off therapy // Am J Gastroenterol. 2008. Vol. 103. P. 2685−2693.
- 8. Savarino E., Pohl D., Zentilin P. et al. Functional heartburn has more in common with functional dyspepsia than with non-erosive reflux disease // Gut. 2009. Vol. 58. P. 1185−1191.
- 9. Ивашкин В. Т., Лапина Т. Л. Гастроэнтерология. Национальное руководство. М.: ГЭОТАР-Медиа, 2008. 704 с. [Ivashkin V.T., Lapina T.L.Gastrojenterologija. Nacional’noerukovodstvo. M.: GJeOTAR-Media, 2008. 704 s. (in Russian)].
- 10. Armstrong D. Endoscopic evaluation of gastro-esophageal reflux disease // Yale J Biol Med. 1999. Vol. 72. P. 93−100.
- 11. Altomare A., Ma J., Guarino M.P. et al. Platelet-activating factor and distinct chemokines are elevated in mucosal biopsies of erosive compared with non-erosive reflux disease patients and controls // Neurogastroenterol. Motil. 2012. Vol. 24. P. 943−963.
- 12. Isomoto H., Saenko V.A., Kanazawa Y. et al. Enhanced expression of interleukin-8 and activation of nuclear factor kappa-B in endoscopy-negative gastroesophageal reflux disease // Am J Gastroenterol. 2004. Vol. 99. P. 589−597.
- 13. Savarino E., Zentilin P., Mastracci L., et al. Microscopic esophagitis distinguishes patients with nonerosive reflux disease from those with functional heartburn // J Gastroenterol. 2013. Vol. 48. P. 473−482.
- 14. Bhat Y.M., Bielefeldt K. Capsaicin receptor (TRPV1) and nonerosive reflux disease // Eur J GastroenterolHepatol. 2006. Vol. 18. P. 263−270.
- 15. Bredenoord A.J. Mechanisms of reflux perception in gastroesophageal reflux disease: a review // Am J Gastroenterol. 2012. Vol. 107. P. 8−15.
- 16. Barlow W.J., Orlando R.C. The pathogenesis of heartburn in nonerosive reflux disease: a unifying hypothesis // Gastroenterology. 2005. Vol. 128. P. 771−778.
- 17. Guarino M.P., Cheng L., Ma J. et al. Increased TRPV1 gene expression in esophageal mucosa of patients with non-erosive and erosive reflux disease // NeurogastroenterolMotil. 2010. Vol. 22. P. 746−751.
- 18. Ma J., Altomare A., Guarino M. et al. HCl-induced and ATP-dependent upregulation of TRPV1 receptor expression and cytokine production by human esophageal epithelial cells // Am J PhysiolGastrointest Liver Physiol. 2012. Vol. 303. P. 635−645.
- 19. Savarino E., Tutuian R., Zentilin P. et al. Characteristics of reflux episodes and symptom association in patients with erosive esophagitis and nonerosive reflux disease: study using combined impedancepH off therapy // Am J Gastroenterol. 2010. Vol. 105. P. 1053−1061.
- 20. Cao W., Cheng L., Beghar J. et al. Proinflammatory cytokines alter/reduce esophageal circular muscle contraction in experimental cat esophagitis // Am J PhysiolGastrointest Liver Physiol. 2004. Vol. 287. P. 1131−1139.
- 21. Harnett K. M, Rieder F., Behar J., Biancani P. Viewpoints on acidinduced inflammatory mediators in esophageal mucosa // J. NeurogastroenterolMotil. 2010. Vol. 16. P. 374−388.
- 22. Quigley E.M. Nonerosive reflux disease, functional heartburn and gastroesophageal reflux disease; insights into pathophysiology and clinical presentation // Chin J Dig Dis. 2006. Vol. 7. P. 186−190.
- 23. Savarino E., Zentilin P., Marabotto E. et al. Overweight is a risk factor for both erosive and nonerosive reflux disease // Dig Liver Dis. 2011. Vol. 43. P. 940−945.
- 24. Talley N.J., Meineche-Schmidt V., Pare P. et al. Efficacy of omeprazole in functional dyspepsia: doubleblind, randomized, placebocontrolled trials (the Bond and Opera studies) // Aliment PharmacolTher. 1998. Vol. 12. P. 1055−1065.
- 25. Zerbib F., des Varannes S.B., Simon M. et al. Functional Heartburn: Definition and Management Strategies // CurrGastroenterol Rep. 2012. Vol. 14. P. 181−188.
- 26. Shapiro M., Green C., Bautista J.M. et al. Functional heartburn patients demonstrate traits of functional bowel disorder but lack a uniform increase of chemoreceptor sensitivity to acid // Am J Gastroenterol. 2006. Vol. 101. P. 1084−1091.
- 27. Richter J. The refractory GERD patient // World Gastroenterol News. 2007. Vol. 12. P. 11−13.
- 28. Vaezi M.F. Refractory GERD: acid, nonacid, or not GERD? // Am J Gastroenterol. 2004. Vol. 99(6). P. 981−988.
- 29. Инструкция по применению лекарственного препарата для медицинского применения Дексилант®. Рег. уд. ЛП 2 477 от 26.05.14 на сайте www.rlsnet.ru/tn_index_id_67 661.htm (последнее обращение 26.04.2017) [InstrukcijapoprimenenijulekarstvennogopreparatadljamedicinskogoprimenenijaDeksilant®. Reg.ud. LP 2 477 ot 26.05.14 nasajte www.rlsnet.ru/tn_index_id_67 661.htm (posledneeobrashhenie 26.04.2017) (in Russian)].
- 30. Behm B., Peura D. Modern options and therapeutic prospects in the resistant forms of gastroesophageal reflux disease // Expert Rev GastroenterolHepatol. 2011. Vol. 5. P. 439−445.
- 31. Peura D. The effects of increasing body mass index on heartburn severity, frequency and response to treatment with dexlansoprazole or lansoprazole // Aliment PharmacolTher. 2013. Vol. 37. P. 810−818.
- 32. Zhang W. Pharmacokinetics and safety of dexlansoprazolemr in adolescents with symptomatic GERD // Gastroenterology. 2007. Vol. 132. P. 285−293.
- 33. Blaga T.S., Dumitrascu D., Galmiche J.P. et al. Functional heartburn: clinical characteristics and outcome // Eur J GastroenterolHepatol. 2013. Vol. 25. P. 282−290.