Подходы к терапии неалкогольной жировой болезни печени

Длительное применение эксенатида было связано со снижением содержания триглицеридов печени у тучных мышей. В открытом неконтролируемом клиническом испытании, целью которого являлась оценка безопасности препарата у пациентов с СД, было отмечено, что у 25% испытуемых, имеющих наибольшую потерю веса, наблюдалось самое значительное снижение уровня АЛТ и АСТ, а 41% пациентов, которые имели повышенные… Читать ещё >
Подходы к терапии неалкогольной жировой болезни печени (реферат, курсовая, диплом, контрольная)
Неалкогольная жировая болезнь печени (НАЖБП) в настоящее время представляет собой наиболее распространенное заболевание печени, поражающее примерно 1/3 населения мира [1]. В последние годы в России наблюдается неуклонный рост распространенности НАЖБП. Так, согласно результатам российского эпидемиологического исследования DIREG 2, охватившего 16 городов страны, частота встречаемости НАЖБП у пациентов увеличилась за период с 2007 по 2015 г. на 10% - с 27 до 37,3% [2]. НАЖБП может варьировать от простого стеатоза, характеризующегося благоприятным течением, до таких грозных форм, как неалкогольный стеатогепатит (НАСГ) и цирроз печени, а в некоторых случаях прогрессировать до гепатоцеллюлярной карциномы [3]. Патогенез НАЖБП до конца неясен. Согласно теории «двух ударов», в основе развития НАЖБП лежит периферическая инсулинорезистентность, способствующая накоплению жиров в печени и повышению уязвимости ее клеток ко многим факторам, таким как окислительный стресс c последующим перекисным окислением липидов, провоспалительные цитокины, адипокины и митохондриальная дисфункция [4]. Наиболее часто НАЖБП встречается у пациентов с метаболическим синдромом (МС), висцеральным ожирением, сахарным диабетом 2-го типа (СД2), дислипидемией [5]. НАЖБП стала серьезной проблемой из-за ее распространенности, трудностей в диагностике, сложного патогенеза, а также отсутствия оптимальных, разработанных и утвержденных методов лечения.
Подходы к лечению НАЖБП Как было сказано ранее, для НАЖБП нет утвержденной терапии. В настоящее время для лечения данного заболевания на стадии простого стеатоза принято использовать методы по коррекции образа жизни с целью снижения веса. Медикаментозную терапию рекомендуют назначать лишь при прогрессировании НАСГ (мостовидный фиброз и цирроз), а также на ранней стадии НАСГ с высоким риском прогрессирования фиброза (пожилой возраст пациента; наличие ассоциированных состояний, таких как СД2, МС, повышение уровня трансаминаз) или при НАСГ с выраженной некровоспалительной активностью [3]. Далее рассмотрены некоторые подходы к терапии НАЖБП.
Снижение массы тела.
Коррекция образа жизни
Изменение образа жизни является первым шагом в лечении НАЖБП [3, 5]. Снижение веса минимум на 5% уменьшает выраженность стеатоза печени, а потеря веса на 7−10% способствует регрессу воспаления в печени. В рандомизированном контролируемом исследовании (РКИ) Look Ahead исследователи изучали отдаленное влияние активного образа жизни на здоровье у людей с избыточной массой тела, ожирением и СД2, в общей сложности 96 пациентов прошли магнитно-резонансную спектроскопию для количественной оценки стеатоза печени. Через 12 мес. у участников, ведущих активный образ жизни (n=46), наблюдались потеря веса и снижение выраженности стеатоза больше, чем у тех, кто придерживался только стандартной диеты [6].
При выборе варианта диеты рекомендованы следующие подходы: диета с низким содержанием жиров (<30% от общей калорийности), диета с низким содержанием углеводов (<60 г. углеводов в сутки) и низкокалорийная диета (800−1500 ккал/сут) [3, 5].
В нескольких исследованиях, изучавших эффективность коррекции питания с или без назначения физических упражнений, с использованием различных методов диагностики было установлено значительное снижение содержания жира в печени — в среднем на ~40% (в диапазоне от 20 до 80%) [7, 8]. В недавнем исследовании, проведенном на Кубе, с помощью низкокалорийной диеты и изменения привычек у пациентов была достигнута потеря веса на 30% в течение 1 года [9]. Тем не менее только у 19% пациентов наблюдался регресс фиброза печени, а у 16% участников с фиброзом печени заболевание прогрессировало. Хотя изменение образа жизни является основой лечения НАЖБП, по-прежнему существует недостаток РКИ, оценивающих влияние коррекции рациона питания, изменения привычек и потери веса на течение НАСГ и фиброза печени. Ранее аэробные упражнения считались лучшим способом снижения содержания жира в печени по сравнению с силовыми тренировками, но недавние исследования показали, что сочетание аэробных и силовых упражнений является более эффективным, чем использование только аэробных упражнений. В целом степень уменьшения стеатоза прямо пропорциональна интенсивности изменения образа жизни [10].
Таким образом, при выявлении НАЖБП пациенту необходима модификация образа жизни с подбором рационального питания и аэробных нагрузок в сочетании с силовыми упражнениями.
Лекарственные средства, способствующие снижению веса
Несколько небольших исследований позволяют предположить, что потеря веса, индуцированная лекарствами, например, орлистатом или римонабантом, антагонистом каннабиноидных СВ1-рецепторов, также способствует уменьшению выраженности стеатоза и снижению уровня аланинаминотрансферазы [11, 12]. Орлистат ингибирует желудочную и панкреатическую липазы, что приводит к уменьшению всасывания жиров в тонкой кишке. Этот препарат показан пациентам с индексом массы тела (ИМТ) > 30 кг/м2, а также при условии отсутствия тяжелой соматической патологии. Тем не менее существует очень мало доказательств, полученных в контролируемых клинических испытаниях, подтверждающих эффективность орлистата в улучшении течения НАЖБП в краткосрочной перспективе, и в настоящее время нет данных о долгосрочном влиянии этого препарата на исходы заболеваний печени. Римонабант, первоначально утвержденный для управления избыточным весом и связанным с ожирением риском кардиометаболических заболеваний, был отозван из-за часто возникающих суицидальных наклонностей на фоне приема препарата. Попытки избежать возможных побочных эффектов препаратов этого класса способствовали открытию периферических антагонистов СВ1 с ограниченной пенетрантностью к головному мозгу. Эффективность некоторых из этих соединений была подтверждена в доклинических моделях НАЖБП (наблюдалось благоприятное воздействие на фиброз) [13].
Бариатрическая хирургия
Целями бариатрической хирургии являются не только достижение удовлетворительной потери веса, но и улучшение течения связанных с ожирением сопутствующих заболеваний, в т. ч. НАЖБП. Однако никаких РКИ по изучению последствий бариатрической хирургии на НАЖБП в литературе найдено не было. Два метаанализа оценивали влияние бариатрической хирургии на гистологическую картину печени у пациентов с НАЖБП [14, 15].
Mummadi et al. сообщили, что доля разрешения стеатоза, улучшения течения стеатогепатита и фиброза по результатам 15 исследований, включивших 766 парных биопсий печени после бариатрической операции, составила 91,6, 81,3 и 65,5% соответственно [14]. Полное разрешение НАСГ было установлено у 69,5% больных. Однако в недавно опубликованном Кокрановском обзоре был сделан вывод о том, что отсутствие РКИ или квази-РКИ не позволяет провести окончательную оценку преимуществ и рисков бариатрической хирургии как терапевтического подхода к ведению пациентов с НАСГ [15].
Таким образом, такие методы, как назначение препарата орлистат или бариатрическая хирургия находят свое применение при выраженной степени ожирения у пациентов с НАЖБП.
Гипогликемические препараты.
Тиазолидиндионы
С учетом роли резистентности к инсулину в патогенезе НАЖБП сенсибилизаторы инсулина, такие как PPAR-гамма агонисты, были тщательно изучены у пациентов с НАЖБП в нескольких пилотных исследованиях, результаты которых показали благоприятное действие на течение заболевания [16−18]. Росиглитазон уменьшает уровни аминотрансфераз и стеатоз печени, однако не влияет на выраженность воспаления или фиброз [19]. В фазе II двойного слепого плацебо-контролируемого 24-месячного исследования пиоглитазон значительно снижал уровни аминотрансфераз, уменьшал выраженность стеатоза, баллонной дистрофии и воспаления у пациентов с НАСГ и нарушенной толерантностью к глюкозе или СД2. Индекс активности НАЖБП улучшился у 73% пациентов, принимавших пиоглитазон, по сравнению с 24% пациентов, принимавших плацебо, также была отмечена тенденция к улучшению течения фиброза [16]. В мультицентровом рандомизированном плацебо-контролируемом двойном слепом исследовании PIVENS были рандомизированы 247 пациентов с НАСГ, подтвержденным биопсией печени, и не страдающих СД. 1-я группа принимала пиоглитазон (30 мг/сут), 2-я — витамин Е (800 МЕ/сут), 3-я — плацебо в течение 24 мес. [18]. У пациентов, получавших пиоглитазон, снизились уровни АЛТ и АСТ, уменьшились стеатоз и выраженность лобулярного воспаления по данным парных биопсий. Однако препарат не повлиял на течение фиброза. В клинических рекомендациях EASL — EASD — EASO по диагностике и лечению НАЖБП авторы подчеркивают, что пиоглитазон может быть использован для лечения стеатогепатита у пациентов, страдающих СД [3]. Однако не были установлены долгосрочная безопасность и эффективность пиоглитазона у пациентов с НАСГ.
Метформин
В нескольких исследованиях изучали влияние метформина на уровни аминотрансфераз и гистологические характеристики печени у пациентов с НАСГ. В некоторых небольших открытых исследованиях было показано, что метформин снижает резистентность к инсулину и уровни аминотрансфераз [20, 21]. В РКИ по оценке эффективности метформина по сравнению с плацебо с одинаковым режимом питания и физическими упражнениями в обеих группах не удалось обнаружить существенных различий между эффективностью лечения метформином или плацебо по степени влияния на стеатоз печени, индекс активности НАЖБП, сывороточные уровни трансаминаз и маркеры резистентности к инсулину [22]. Действие метформина на стеатоз печени недостаточно в связи с его неспособностью восстанавливать уровень адипонектина сыворотки. Однако имеются данные об антиканцерогенном действии метформина в отношении гепатоцеллюлярной карциномы [3].
Миметики инкретина
Длительное применение эксенатида было связано со снижением содержания триглицеридов печени у тучных мышей [23, 24]. В открытом неконтролируемом клиническом испытании, целью которого являлась оценка безопасности препарата у пациентов с СД, было отмечено, что у 25% испытуемых, имеющих наибольшую потерю веса, наблюдалось самое значительное снижение уровня АЛТ и АСТ, а 41% пациентов, которые имели повышенные значения АЛТ на исходном уровне, достигли нормализации уровня АЛТ после 3-летнего приема эксенатида независимо от степени снижения веса [25]. В 12-месячном проспективном исследовании у пациентов с СД2 изучалось действие комбинации пиоглитазона и эксенатида по сравнению с монотерапией пиоглитазоном у пациентов, страдающих СД [26]. На исходном уровне содержание жира в печени и уровень адипонектина в плазме были схожи в 2-х группах участников. Результаты настоящего исследования показали, что использование комбинации пиоглитазона и эксенатида было связано со значительным сокращением содержания жира в печени и снижением уровня AЛT по сравнению с таковыми на фоне монотерапии пиоглитазоном. Однако результаты исследования носят предварительный характер, и последствия комбинированного использования эксенатида и тиазолидиндиона в большой группе пациентов с НАСГ до сих пор не изучены.
Таким образом, становится очевидным, что назначение терапии пиоглитазоном, метформином и / или эксенатидом возможно только у пациентов с НАЖБП и СД2, у которых есть гистологические признаки НАСГ.
Гиполипидемические средства.
Статины
Антиоксидантные и противовоспалительные свойства, частое сочетание НАЖБП с дислипидемией, а также повышенный риск сердечно-сосудистых заболеваний у пациентов с НАЖБП делают статины привлекательными для лечения данного заболевания. В недавнем кросс-секционном исследовании анализ данных 2578 пациентов показал, что пациенты с ИМТ > 27,5 кг/м2, принимавшие статины более 2-х лет, имеют распространенность стеатоза в 3 раза ниже, чем группа контроля. Исследования по эффективности симвастатина были противоречивыми: так, в одном исследовании наблюдалось значительное снижение уровня AЛT и АСТ в сыворотке, в то время как в другом исследовании не было выявлено статистически значимого уменьшения активности сывороточных аминотрансфераз, а также жировой дистрофии печени, некровоспалительной активности и выраженности фиброза печени [27, 28]. Исследования, в которых изучалась эффективность аторвастатина, показали значительное снижение активности аминотрансфераз, уровня липидов и стеатоза, а также замедления прогрессирования НАЖБП до НАСГ [29−32]. В РКИ с участием пациентов с УЗ-признаками НАЖБП и гиперлипидемией 63 участникам была назначена монотерапия аторвастатином в дозе 20 мг/сут, 62 участника получали 200 мг/сут фенофибрата, 61 пациенту проводилась терапия комбинацией фенофибрата и аторвастатина [33]. В группах аторвастатина и комбинированного лечения наблюдались более высокая степень улучшения биохимических показателей и регресс УЗ-признаков НАЖБП по сравнению с таковыми в группе фенофибрата в виде монотерапии. Таким образом, большинство исследований показывают благоприятное влияние статинов на течение НАЖБП в виде уменьшения активности трансаминаз и замедления прогрессирования заболевания до НАСГ и фиброза. Однако пока нет данных, полученных в РКИ, в которых эффективность применения статинов у пациентов с НАЖБП была подтверждена гистологически. В целом в литературе и рекомендациях поддерживается использование статинов у пациентов с НАЖБП в сочетании с гиперлипидемией [3, 5].
Омега-3 жирные кислоты
Омега-3 относится к группе жиров, называемых полиненасыщенными жирными кислотами (ПНЖК). Они изучаются в качестве варианта лечения НАЖБП. Исследования на животных показали снижение жировой дистрофии печени, улучшение чувствительности к инсулину, а также уменьшение выраженности воспаления и окислительного стресса. У людей предварительные клинические испытания подтвердили эти данные, продемонстрировав уменьшение стеатоза печени и повышение чувствительности к инсулину, а также улучшение функциональных тестов печени в сыворотке крови [34]. Тем не менее большинство из этих исследований были открытыми. В фазе II рандомизированного двойного слепого 12-месячного клинического исследования, целью которого была оценка эффективности и безопасности эйкозапентаеновой кислоты у лиц с подтвержденным биопсией НАСГ, препарат не продемонстрировал существенного влияния на стеатоз, воспаление, баллонную дистрофию или фиброз печени, а также существенных эффектов в отношении биохимических показателей печени, резистентности к инсулину. В настоящее время использование омега-3 ЖК рекомендовано пациентам с НАСГ с гипертриглицеридемией [3, 5]. В дальнейшем необходимо проведение РКИ с целью оценки эффективности других омега-3 ЖК (например, докозагексаеновой кислоты) у пациентов с НАЖБП.
Антиоксиданты.
Витамин Е
Окислительный стресс считается одним из ключевых механизмов в патогенезе НАЖБП, ведущих к гепатоцеллюлярному повреждению и прогрессированию заболевания. Витамин Е обладает антиоксидантными свойствами, что натолкнуло некоторых исследователей на мысль изучить препарат в качестве возможного средства лечения НАСГ. Витамин Е способствует снижению активности аминотрансфераз, а также благоприятно влияет на гистологическую картину у пациентов с НАСГ. Некоторые исследования также продемонстрировали полное разрешение НАСГ. Но имеются смешанные результаты его влияния на динамику фиброза печени [3, 5]. В испытании PIVENS, рассмотренном выше, авторы пришли к выводу, что витамин Е по сравнению с плацебо приводит к значительно более высокому темпу регресса некровоспалительных процессов (43% случаев против 19%), хотя препарат не оказывал никакого существенного влияния на фиброз. Влияние витамина Е на НАЖБП было также оценено во многих исследованиях в составе комбинированной терапии. В проспективном двойном слепом рандомизированном плацебо-контролируемом исследовании с участием 45 пациентов с гистологически доказанным НАСГ оценивалась эффективность комбинации витаминов Е 1000 МЕ и C 1000 мг в сравнении с эффективностью плацебо в течение 6 мес. [35]. В конце лечения группа, получавшая витамины Е и С, имела статистически значимое улучшение течения фиброза. Однако препарат не повлиял на процессы некровоспаления и активность AЛT. В другом исследовании с использованием комбинации витамина Е с урсодезоксихолевой кислотой (УДХК), включившем 48 пациентов с НАСГ, подтвержденным биопсией печени, было продемонстрировано значительное улучшение уровней аминотрансфераз и стеатоза в группе комбинированной терапии по сравнению с таковыми у пациентов, получавших монотерапию УДХК и плацебо [36]. Таким образом, витамин Е может быть использован в качестве средства лечения НАСГ без сопутствующего СД. Но следует соблюдать осторожность при назначении витамина Е у пациентов с НАЖБП ввиду того, что имеются данные о повышении общей смертности, а также риска развития рака предстательной железы [3, 37, 38].
Гепатопротекторы.
Урсодезоксихолевая кислота
УДХК оказывает благоприятное влияние на заболевания гепатобилиарной системы благодаря своим цитопротекторному, иммуномодулирующему и антиапоптотическому эффектам [39]. Благоприятное действие препарата на активность АЛТ и гистологическую картину у пациентов с НАЖБП было продемонстрировано в испытаниях, изучавших влияние УДХК в комбинации с другими лекарственными средствами, однако результаты других исследований не показали существенных различий между эффективностью УДХК и плацебо [40−44]. Это согласуется с выводами, сделанными в недавнем систематическом обзоре 12 РКИ. Монотерапия УДХК оказала значимое влияние на активность ферментов печени, стеатоз и фиброз лишь в некоторых исследованиях, но применение УДХК в сочетании с другими лекарственными средствами показало заметное улучшение течения стеатоза и воспаления [45]. В целом в литературе и рекомендациях поддерживается использование УДХК у пациентов с НАЖБП.
Эссенциальные фосфолипиды
Эссенциальные фосфолипиды (ЭФЛ) обладают мембранопротективным, антиоксидантным, антифибротическим эффектами, тем самым применение препаратов данной группы патогенетически оправданно. Так, в недавно опубликованном систематическом обзоре, в ходе которого изучалась эффективность применения ЭФЛ при НАЖБП и алкогольной болезни печени (АБП), было продемонстрировано благоприятное влияние данных лекарственных средств на течение заболевания в виде уменьшения стеатоза по данным визуализирующих методов исследования, снижения активности трансаминаз, а также улучшения показателей липидного профиля [46].
В 2009 г. М. В. Журавлевой и соавт. было проведено исследование, изучавшее эффективность и безопасность препарата «Эслидин®» (АО «Нижфарм», Россия) у 40 пациентов с НАЖБП. «Эслидин®» — комбинированный препарат, состоящий из фосфолипидов (липоид ППЛ-400) и метионина. В ходе исследования пациенты получали препарат по 2 капсулы 3 р./сут в течение 12 нед. На фоне приема «Эслидин®» у пациентов наблюдались регресс жалоб со стороны гепатобилиарной системы и ослабление проявлений астенического синдрома. Кроме того, у 46% испытуемых отмечалось снижение активности АЛТ [47]. Схожие результаты были получены и в исследовании, проведенном С. М. Ткачом и А. Э. Дорофеевым, включившем 60 пациентов с НАЖБП. Также авторы отметили, что препарат не только способствовал улучшению клинической картины, уменьшению стеатоза, гепатомегалии и нормализации АЛТ и АСТ, но и обладал гипохолестеринемическим эффектом [48]. И, наконец, в исследовании В. Т. Ивашкина, М. В. Маевской и соавт., включившем 1732 пациента, отмечалось положительное влияние препарата на состояние пациентов с НАЖБП, маркеры цитолиза и холестаза и липидный профиль [49]. Таким образом, применение ЭФЛ, в частности препарата «Эслидин®», для лечения пациентов с НАЖБП целесообразно.
Уменьшение содержания железа
Накопление железа в печени связано с инсулинорезистентностью, и поэтому уменьшение содержания этого элемента улучшает течение НАЖБП. В работе L. Valenti et al. было показано, что кровопускания у пациентов с НАСГ и высоким уровнем железа и ферритина, не имеющих генетического полиморфизма наследственного гемохроматоза, приводят к улучшению гистологических показателей без прогрессирования фиброза [3].
Будущие терапевтические агенты Обетихолевая кислота (англ. obeticholic acid) — агонист фарнезоидного Х-рецептора (FXR), в настоящее время используется для лечения первичного билиарного цирроза. В плацебо-контролируемом РКИ обетихолевая кислота улучшила биохимические показатели и гистологические особенности НАСГ по сравнению с плацебо у пациентов без цирроза [50]. Тем не менее были отмечены значительное увеличение уровня триглицеридов в крови и ЛПНП и снижение концентрации ЛПВП. С учетом того, что многие пациенты с НАСГ умирают из-за сердечно-сосудистых заболеваний, повышенный уровень холестерина в крови за счет использования обетихолевой кислоты делает назначение препарата проблематичным [51]. Будущие исследования должны представить данные, подтверждающие положительное влияние обетихолевой кислоты на течение НАЖБП, а также уменьшить потенциальные последствия изменений липидов на сердечно-сосудистые исходы.
GKT137831 является первым в своем классе препаратом, ингибирующим никотинамидадениндинуклеотидфосфат (НАДФН) — оксидазы NOX 1 и 4, участвующие в фиброгенезе печени. GKT137831 был разработан в качестве антидиабетического препарата, впоследствии расширил свой терапевтический диапазон, включая атеросклероз, идиопатический легочный фиброз, фиброз печени, а также модели ангиогенеза. Ингибитор NOX¼ блокирует фиброгенез печени и подавляет маркеры окислительного стресса, воспаления при тестировании на животных [52]. Еще одной интересной находкой является то, что ингибитор NOX¼ уменьшает апоптоз гепатоцитов.
Сенекривирок (CVC, TAK-652, TBR-652) — новый антиретровирусный препарат, ингибитор C-C рецепторов хемокина 2 и 5 (CCR2, CCR5) (Cenicriviroc, Tobira, фаза IIb). Рецептор CC хемокина (CCR) экспрессируется в различных иммунных клетках, в т. ч. и печеночных клетках Купфера. После повреждения печени клетки Купфера начинают синтезировать лиганды хемокина СС типа 2, обладающие хемоаттрактантными свойствами в отношении моноцитов. В печени моноциты созревают до макрофагов, секретирующих различные провоспалительные цитокины, что впоследствии приводит к активации звездчатых клеток и усугублению повреждения печени. Сенекривирок был разработан в качестве противовирусного агента для лечения пациентов с ВИЧ-1. Он показал высокую противовирусную активность и безопасность в фазе IIb клинических испытаний у пациентов со СПИДом [53]. Сенекривирок оказал благоприятное влияние на гистологическую картину печени на животных моделях. В настоящее время клинические исследования по оценке эффективности и безопасности препарата у пациентов, страдающих НАСГ, находятся в фазе II [53, 54].
Эмрикасан является мощным необратимым ингибитором пан-каспазы. Каспазы занимают важное место в процессе апоптоза, играющего ключевую роль в развитии и прогрессировании НАСГ и НАЖБП, что приводит к предположению, что ингибирование каспаз может оказать значительное положительное влияние на НАЖБП и НАСГ. Эмрикасан снижает стеатоз, воспаление, апоптоз и фиброз у животных [55]. Исследования на людях показали, что препарат может уменьшить активность сывороточных трансаминаз после внутривенного или перорального введения. В недавно завершенном рандомизированном плацебо-контролируемом 28-дневном исследовании фазы II у пациентов с НАЖБП и повышенным уровнем АЛТ использование эмрикасана привело к статистически значимому снижению уровня АЛТ и ЦK-18 (примерно на 30% по отношению к плацебо) на 28-й день. Эмрикасан, как правило, хорошо переносился, не было зарегистрировано никаких изменений в весе, уровнях холестерина, липопротеидов высокой и низкой плотности [56].
Элафибранор (GFT-505) — агонист к рецепторам, активирующим пролиферацию пероксисом б и д (PPAR-б/д). РPAR экспрессируется в печени и контролирует гены, вовлеченные в метаболизм липидов и липопротеидов. PPARд обладает эффектом улучшения функций митохондрий, сжигания жира и уменьшения резистентности к инсулину. В фазе II многоцентрового рандомизированного плацебо-контролируемого исследования 274 пациента с гистологически доказанным НАСГ получали GFT505 в дозе 80 мг/сут или 120 мг/сут либо плацебо в течение 1 года [57]. В ходе исследования наблюдалось разрешение НАСГ без ухудшения фиброза. В группе, получавшей 120 мг/сут препарата, произошло значительное улучшение всех показателей гистологических маркеров, включая фиброз. Кроме того, по сравнению с плацебо GFT505 приводит к существенному улучшению показателей метаболических маркеров. Это исследование показало, что GFT505 способствует улучшению гистологической картины у пациентов с НАСГ. В настоящее время фаза III испытания элафибранора идет полным ходом.
Арамхол — ингибитор стеароил-СоА десатуразы-1 (SCD-1), представляет собой конъюгат из 2-х природных компонентов — холевой кислоты и арахидоновой кислоты. Как показали опыты на животных моделях, ингибирование SCD-1 способствует уменьшению содержания жира в печени (включая триглицериды и свободные жирные кислоты), а также приводит к снижению резистентности к инсулину. В рандомизированном двойном слепом плацебо-контролируемом исследовании с участием 60 пациентов с подтвержденной биопсией НАЖБП 6 из них имели НАСГ, испытуемые получали арамхол (в дозе 100 или 300 мг/сут) или плацебо 1 р./сут в течение 3-х мес. У 58 участников, которые завершили данное исследование, никаких серьезных неблагоприятных событий не наблюдалось. По истечении 3-х мес. авторы отметили уменьшение содержания жира в печени на 12,57−22,14% у пациентов, получавших препарат в дозе 300 мг/сут, в то время как в группе плацебо этот параметр увеличился на 6,39−36,27%. Содержание жира в печени уменьшилось и в группе, принимавшей 100 мг/сут, однако эти изменения были незначимыми [58]. В настоящее время проводится фаза IIb клинического исследования, включившего 240 больных с НАСГ, с целью определения эффективности и безопасности препарата у пациентов данной категории [59].
Селонсертиб (GS-4997) — ингибитор апоптоз-сигнал-регулирующей киназы 1. Апоптоз-сигнал-регулирующая киназа 1 (ASK1) активируется различными раздражителями, включая гипергликемию, TGF-бета и окислительный стимул в организме. Активированный ASK1 индуцирует апоптоз и фиброз через JNK1- и р38-зависимые сигнальные пути. У животных с НАСГ антагонист ASK1 индуцировал снижение содержания печеночного жира и фиброза. Он также способствовал уменьшению резистентности к инсулину и метаболического индекса, стимулируя потерю веса [60]. В феврале 2017 г. завершилось клиническое исследование по изучению влияния и безопасности монотерапии селонсертибом и комбинации препарата с симтузумабом у пациентов с НАСГ. Результаты исследования еще не опубликованы. Однако в 2016 г. на конференции Американской ассоциации по изучению заболеваний печени Rohit Loomba et al. доложили, что препарат способствует регрессии фиброза печени и снижению риска развития цирроза, а также уменьшению содержания жира в печени, АЛТ и ЦК-18 в сыворотке крови. Препарат показал хороший уровень безопасности [61, 62].
Симтузумаб — это гуманизированный иммуноглобулин G4, моноклональное антитело против лизилоксидазоподобного фермента-2, способствующего развитию фиброза за счет формирования поперечных связей коллагена I типа и эластина. В 2012 г. было начато рандомизированное двойное слепое плацебо-контролируемое 96-недельное исследование с участием 222 пациентов с компенсированным фиброзом печени на фоне НАСГ. Основной целью данного исследования является оценка эффективности препарата в дозе 75 мг или 125 мг каждые 2 нед. в виде подкожных инъекций с целью предотвращения гистологического прогрессирования фиброза печени и клинического прогрессирования до цирроза печени у участников с НАСГ. Исследование подходит к концу, необходимо дождаться результатов [63].
Трансплантация печени Цирроз печени в исходе НАЖБП входит в тройку основных причин пересадки печени (вместе с HCV-инфекцией и алкоголизмом). Пациенты с НАЖБП, перенесшие трансплантацию, имеют высокий риск летальных исходов от сердечно-сосудистых осложнений и сепсиса, низкие риски недостаточности трансплантата. На показатели смертности в этой группе пациентов оказывают влияние ИМТ и СД2, а пациенты с ИМТ > 35 кг/м2 умирают в течение 1 года после трансплантации.
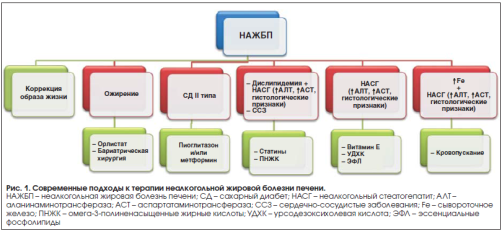
Подходы к терапии НАЖБП представлены на рисунке 1. Несмотря на значительные исследования и многочисленные клинические испытания, в настоящее время не имеется данных о достижении каким-либо фармакологическим агентом клинически значимого соотношения пользы и риска. Совместные усилия научного сообщества, фармацевтической промышленности, а также регулирующих органов в конечном итоге приведут к тому, что терапия НАЖБП будет окончательно разработана и утверждена. Для этого в дальнейшем требуется проведение развернутых мультицентровых исследований с обязательной динамической оценкой гистологической картины печени на фоне терапии.
жировой печень неалкогольный терапия.
- 1. Michelotti G.A., Machado M.V., Diehl A.M. NAFLD, NASH and liver cancer // Nat Rev Gastroenterol Hepatol. 2013. Vol. 10 (11). P. 656−665.
- 2. Ивашкин В. Т., Драпкина О. М., Маев И. В. и др. Распространенность неалкогольной жировой болезни печени у пациентов амбулаторно-поликлинической практики в Российской Федерации: результаты исследования DIREG 2 // Рос. журн. гастроэнтерол. гепатол. колопроктол. 2015. № 6. С. 31−41 [Ivashkin V.T., Drapkina O.M., Maev I.V. i dr. Rasprostranennost' nealkogol’noj zhirovoj bolezni pecheni u pacientov ambulatorno-poliklinicheskoj praktiki v Rossijskoj Federacii: rezul’taty issledovanija DIREG 2 // Ros. zhurn. gastrojenterol. gepatol. koloproktol. 2015. № 6. S. 31−41 (in Russian)].
- 3. EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease // J Hepatol. 2016. Vol. 64 (6). P. 1388−1402.
- 4. Duvnjak M., Lerotic I., Barsic N. et al. Pathogenesis and management issues for non-alcoholic fatty liver disease // World J Gastroenterol. 2007. Vol. 13. P. 4539−4550.
- 5. Ивашкин В. Т., Маевская М. В., Павлов Ч. С. и др. Клинические рекомендации по диагностике и лечению неалкогольной жировой болезни печени Российского общества по изучению печени и Российской гастроэнтерологической ассоциации // Рос. журн. гастроэнтерол. гепатол. колопроктол. 2016. № 26 (2). С. 24−42 [Ivashkin V.T., Maevskaja M.V., Pavlov Ch.S. i dr. Klinicheskie rekomendacii po diagnostike i lecheniju nealkogol’noj zhirovoj bolezni pecheni Rossijskogo obshhestva po izucheniju pecheni i Rossijskoj gastrojenterologicheskoj associacii // Ros. zhurn. gastrojenterol. gepatol. koloproktol. 2016. № 26 (2). S. 24−42 (in Russian)].
- 6. Lazo M., Solga S.F., Horska A. et al. Effect of a 12-month intensive lifestyle intervention on hepatic steatosis in adults with type 2 diabetes // Diabetes Care. 2010. Vol. 33. P. 2156−2163.
- 7. Larson-Meyer D.E., Heilbronn L.K., Redman L.M. et al. Effect of calorie restriction with or without exercise on insulin sensitivity, beta-cell function, fat cell size, and ectopic lipid in overweight subjects // Diabetes Care. 2006. Vol. 29 (6). P. 1337−1344.
- 8. Thamer C., Machann J., Stefan N. et al. High visceral fat mass and high liver fat are associated with resistance to lifestyle intervention // Obesity (Silver Spring). 2007. Vol. 15 (2). P. 531−538.
- 9. Vilar-Gomez E., Martinez-Perez Y., Calzadilla-Bertot L. et al. Weight Loss Through Lifestyle Modification Significantly Reduces Features of Nonalcoholic Steatohepatitis // Gastroenterology. 2015. Vol. 149 (2). P. 367−378.
- 10. Musso G., Gambino R., Cassader M. et al. A meta-analysis of randomized trials for the treatment of nonalcoholic fatty liver disease // Hepatology. 2010. Vol. 52 (1). P. 79−104.
- 11. Harrison S.A., Brunt E.M., Fecht W.J. et al. Orlistat for overweight subjects with nonalcoholic steatohepatitis: A randomized prospective trial // Hepatology. 2009. Vol. 49. P. 80−86.
- 12. Wierzbicki A.S., Pendleton S., McMahon Z. et al. Rimonabant improves cholesterol, insulin resistance and markers of non-alcoholic fatty liver in morbidly obese patients: a retrospective cohort study // Int J Clin Pract. 2011. Vol. 65 (6). P. 713−715.
- 13. Mallat A., Teixeira Clerc F., Lotersztajn S. Cannabinoid signaling and liver therapeutics // J Hepatol. 2013. Vol. 59. P. 891−896.
- 14. Mummadi R.R., Kasturi K.S., Chennareddygari S. et al. Effects of bariatric surgery on nonalcoholic fatty liver disease: systematic review and meta-analysis // Clin Gastroenterol Hepatol. 2008. Vol. 6 (12). P. 1396−1402.
- 15. Chavez-Tapia N.C., Tellez-Avila F.I., Barrientos-Gutierrez T. et al. Bariatric surgery for non-alcoholic steatohepatitis in obese patients //Cochrane Detabase Syst Rev. 2010. Vol. 20 (1). CD007340.
- 16. Belfort R., Harrison S.A., Brown K. et al. A placebo-controlled trial of pioglitazone in subjects with nonalcoholic steatohepatitis // N Engl J Med. 2006. Vol. 355. P. 2297−307.
- 17. Promrat K., Lutchman G., Uwaifo G.I. et al. A pilot study of pioglitazone treatment for nonalcoholic steatohepatitis // Hepatology. 2004. Vol. 39. P. 188−196.
- 18. Sanyal A.J., Chalasani N., Kowdley K.V. et al. Pioglitazone, Vitamin E, or Placebo for Nonalcoholic Steatohepatitis // N Engl J Med. 2010. Vol. 362 (18). P. 1675−1685.
- 19. Ratziu V., Giral P., Jacqueminet S. et al. Rosiglitazone for nonalcoholic steatohepatitis: one-year results of the randomized placebo-controlled Fatty Liver Improvement with Rosiglitazone Therapy (FLIRT) Trial // Gastroenterology. 2008. Vol. 135 (1). P. 100−110.
- 20. Li Y., Liu L., Wang B., Wang J. et al. Metformin in non-alcoholic fatty liver disease: a systematic review and meta-analysis // Biomedical Reports. 2013. Vol. 1 (1). P. 57−64.
- 21. Mazza A., Fruci B., Garinis G.A. et al. The role of metformin in the management of NAFLD // Experimental Diabetes Research. 2012. Vol. 2012. Article ID716404.
- 22. Bugianesi E., Gentilcore E., Manini R. et al. A randomized controlled trial of metformin versus vitamin E or prescriptive diet in nonalcoholic fatty liver disease // The American Journal of Gastroenterology. 2005. Vol. 100 (5). P. 1082−1090.
- 23. Samson S.L., Gonzalez E.V., Yechoor V. et al. Gene therapy for diabetes: metabolic effects of helper-dependent adenoviral exendin 4 expression in a diet-induced obesity mouse model // Mol Ther. 2008. Vol. 16 (11). P. 1805−1812.
- 24. Ding X., Saxena N.K., Lin S., et al. Exendin-4, a glucagon-like protein-1 (GLP-1) receptor agonist, reverses hepatic steatosis in ob/ob mice // Hepatology. 2006. Vol. 43 (1). P. 173−181.
- 25. Klonoff D.C., Buse J.B., Nielsen L.L. et al. Exenatide effects on diabetes, obesity, cardiovascular risk factors and hepatic biomarkers in patients with type 2 diabetes treated for at least 3 years // Curr. Med. Res. Opin. 2008. Vol. 24 (1). P. 275−286.
- 26. Sathyanarayana P., Jogi M., Muthupillai R. et al. Effects of combined exenatide and pioglitazone therapy on hepatic fat content in type 2 diabetes // Obesity (Silver Spring). 2011. Vol. 19 (12). P. 2310−2315.
- 27. Abel T., Feher J., Dinya E. et al. Safety and efficacy of combined ezetimibe/simvastatin treatment and simvastatin monotherapy in patients with non-alcoholic fatty liver disease // Med Sci Monit. 2009. Vol. 15 (12). P. 6−11.
- 28. Nelson A., Torres D.M., Morgan A. et al. A pilot study using simvastatin in the treatment of nonalcoholic steatohepatitis: a randomized placebo-controlled trial // Journal of Clinical Gastroenterology. 2009. Vol. 43 (10). P. 990−994.
- 29. Athyros V.G., Tziomalos K., Gossios T.D. et al. Safety and efficacy of long-term statin treatment for cardiovascular events in patients with coronary heart disease and abnormal liver tests in the Greek Atorvastatin and Coronary Heart Disease Evaluation (GREACE) Study: a post-hoc analysis // The Lancet. 2010. Vol. 376 (9756). P. 1916;1922.
- 30. Gуmez-Domнnguez E., Gisbert J.P., Moreno-Monteagudo J.A. et al. A pilot study of atorvastatin treatment in dyslipemid, non-alcoholic fatty liver patients // Alimentary Pharmacology & Therapeutics. 2006. Vol. 23 (11). P. 1643−1647.
- 31. Kiyici M., Gulten M., Gurel S. et al. Ursodeoxycholic acid and atorvastatin in the treatment of nonalcoholic steatohepatitis // Canadian Journal of Gastroenterology. 2003. Vol. 17 (12). P. 713−718.
- 32. Samy W., Hassanian M.A. Paraoxonase-1 activity, malondialdehyde and glutathione peroxidase in non-alcoholic fatty liver disease and the effect of atorvastatin // Arab Journal of Gastroenterology. 2011. Vol. 12 (2). P. 80−85.
- 33. Athyros V.G., Mikhailidis D.P., Didangelos T.P. et al. Effect of multifactorial treatment on non-alcoholic fatty liver disease in metabolic syndrome: a randomised study // Current Medical Research and Opinion. 2006. Vol. 22 (5). P. 873−883.
- 34. Masterton G.S., Plevris J.N., Hayes P.C. Review article: omega-3 fatty acids-a promising novel therapy for non-alcoholic fatty liver disease // Aliment Pharmacol Ther. 2010. Vol. 31 (7). P. 679−692.
- 35. Harrison S.A., Torgerson S., Hayashi P. et al. Vitamin E and vitamin C treatment improves fibrosis in patients with nonalcoholic steatohepatitis // Am J Gastroenterol. 2003. Vol. 98 (11). P. 2485−2490.
- 36. Dufour J.F., Oneta C.M., Gonvers J.J. et al. Randomized placebo-controlled trial of ursodeoxycholic acid with vitamin e in nonalcoholic steatohepatitis // Clinical Gastroenterology and Hepatology. 2006. Vol. 4 (12). P. 1537−1543.
- 37. Miller E.R., Pastor-Barriuso R., Dalal D. et al. Meta-analysis: high-dosage vitamin E supplementation may increase all-cause mortality // Intern Med. 2005. Vol. 142 (1). P. 37−46.
- 38. Klein E.A., Thompson I.M., Tangen C.M. et al. Vitamin E and the Risk of Prostate Cancer: Updated Results of The Selenium and Vitamin E Cancer Prevention Trial (SELECT) // JAMA. 2011. Vol. 306 (14). P. 1549−1556.
- 39. Надинская М. Ю. Исследование применения урсодеоксихолевой кислоты в гепатологии с позиции медицины, основанной на научных доказательствах // Consilium Medicum. 2003. № 6. С. 318−322 [Nadinskaja M. Ju. Issledovanie primenenija ursodeoksiholevoj kisloty v gepatologii s pozicii mediciny, osnovannoj na nauchnyh dokazatel’stvah // Consilium Medicum. 2003. № 6. S. 318−322 (in Russian)].
- 40. Кутишенко Н. П., Марцевич С. Ю., Лерман О. В. и др. Повышение эффективности гиполипидемической терапии у пациентов высокого сердечно-сосудистого риска с сочетанной патологией печени (результаты дополнительного анализа исследования РАКУРС) // Рациональная Фармакотерапия в Кардиологии. 2015. Т. 11. № 2. C. 300−306 [Kutishenko N.P., Marcevich S. Ju., Lerman O.V. i dr. Povyshenie jeffektivnosti gipolipidemicheskoj terapii u pacientov vysokogo serdechno-sosudistogo riska s sochetannoj dopolnitel’nogo analiza (issledovanija RAKURS) // Racional’naja Farmakoterapija v Kardiologii. 2015. T. 11. № 2. C. 300−306 (in Russian)].
- 41. Dufour J.F., Oneta C.M., Gonvers J.J. et al. Randomized placebo-controlled trial of ursodeoxycholic acid with vitamin e in nonalcoholic steatohepatitis // Clinical Gastroenterology and Hepatology. 2006. Vol. 4 (12). P. 1537−1543.
- 42. Leuschner U.F.H., Lindenthal B., Herrmann G. et al. High-dose ursodeoxycholic acid therapy for nonalcoholic steatohepatitis: a double-blind, randomized, placebo-controlled trial // Hepatology. 2010. Vol. 52 (2). P. 472−479.
- 43. Lindor K.D., Kowdley K.V., Heathcote E.J. et al. Ursodeoxycholic acid for treatment of nonalcoholic steatohepatitis: results of a randomized trial // Hepatology. 2004. Vol. 39 (3). P. 770−778.
- 44. Mйndez-Sбnchez N., Gonzбlez V., Chбvez-Tapia N. et al. Weight reduction and ursodeoxycholic acid in subjects with nonalcoholic fatty liver disease. A double-blind, placebo-controlled trial // Annals of Hepatology. 2004. Vol. 3 (3). P. 108−112.
- 45. Xiang Z., Chen Y.P., Ma K.F. et al. The role of ursodeoxycholic acid in non-alcoholic steatohepatitis: a systematic review // BMC Gastroenterol. 2013. Vol. 13. P. 140.
- 46. Gundermann K.J., Gundermann S., Drozdzik M. et al. Essential phospholipids in fatty liver: a scientific update // Clin Exp Gastroenterol. 2016. Vol. 9. P. 105−117.
- 47. Журавлева М. В. Эслидин® — новое средство в терапии диффузных заболеваний печени // Consilium Medicum. 2009. № 8. С. 69−72 [Zhuravleva M.V. Jeslidin® — novoe sredstvo v terapii diffuznyh zabolevanij pecheni // Consilium Medicum. 2009. № 8. S. 69−72 (in Russian)].
- 48. Ткач С. М., Дорофеев А. Э. Эффективность и безопасность препарата Эслидин при неалкогольной жировой болезни печени // Сучасна гастроентерологiя. 2016. № 3 (89). С. 91−95 [Tkach S.M., Dorofeev A. Je. Jeffektivnost' i bezopasnost' preparata Jeslidin pri nealkogol’noj zhirovoj bolezni pecheni // Suchasna gastroenterologija. 2016. № 3 (89). S. 91−95 (in Russian)].
- 49. Ивашкин В. Т., Маевская М. В., Широкова Е. Н и др. Опыт применения препарата Эслидин® у пациентов с неалкогольной жировой болезнью печени в практике врача амбулаторного звена (Global Observation of Liver Disease treatment with Eslidin®, «GOLD») // РМЖ. 2015. № 21. С. 1272−1277 [Ivashkin V.T., Maevskaja M.V., Shirokova E. N i dr. Opyt primenenija preparata Jeslidin® u pacientov s nealkogol’noj zhirovoj bolezn’ju pecheni v praktike vracha ambulatornogo zvena (Global Observation of Liver Disease treatment with Eslidin®, «GOLD») // RMZh. 2015. № 21. S. 1272−1277 (in Russian)].
- 50. Neuschwander-Tetri B.A., Loomba R., Sanyal A.J. et al. Farnesoid X nuclear receptor ligand obeticholic acid for non-cirrhotic, non-alcoholic steatohepatitis (FLINT): a multicentre, randomised, placebo-controlled trial // Lancet. 2015. Vol. 385. P. 956−965.
- 51. Lawlor D.A., Callaway M., Macdonald-Wallis C. et al. Nonalcoholic fatty liver disease, liver fibrosis, and cardiometabolic risk factors in adolescence: a cross-sectional study of 1874 general population adolescents // J Clin Endocrinol Metab. 2014. Vol. 99. P. 410−417.
- 52. Aoyama T., Paik Y.H., Watanabe S. et al. Nicotinamide adenine dinucleotide phosphate oxidase in experimental liver fibrosis: GKT137831 as a novel potential therapeutic agent // Hepatology. 2012. Vol. 56. P. 2316−2327.
- 53. Lefebvre E., Gottwald M., Lasseter K. et al. Pharmacokinetics, Safety, and CCR2/CCR5 Antagonist Activity of Cenicriviroc in Participants With Mild or Moderate Hepatic Impairment // Clin Transl Sci. 2016. Vol. 9. P. 139−148.
- 54. Tobira Therapeutics, Inc. Efficacy and Safety Study of Cenicriviroc for the Treatment of NASH in Adult Subjects With Liver Fibrosis (CENTAUR) // ClinicalTrial.gov NCT02217475.
- 55. Barreyro F.J., Holod S., Finocchietto P.V. et al. The pan-caspase inhibitor Emricasan (IDN-6556) decreases liver injury and fibrosis in a murine model of non-alcoholic steatohepatitis // Liver Int. 2015. Vol. 35. P. 953−966.
- 56. Shiffman M., Freilich B., Vuppalanchi R. et al. A placebo-controlled, multicenter, double-blind, randomised trial of emricasan (IDN-6556) in subjects with non-alcoholic fatty liver disease (NAFLD) and raised transaminases // J Hepatol. 2015. Vol. 62 (2). P. 282.
- 57. Ratziu V., Harrison S.A., Francque S. et al. GOLDEN-505 Investigator Study Group. Elafibranor, an Agonist of the Peroxisome Proliferator-Activated Receptor-б andд, Induces Resolution of Nonalcoholic Steatohepatitis Without Fibrosis Worsening // Gastroenterology. 2016. Vol. 150 (5). P. 1147−1159.
- 58. Safadi R. et al. The fatty acid-bile acid conjugate Aramchol reduces liver fat content in patients with nonalcoholic fatty liver disease // Clin Gastroenterol Hepatol. 2014. Vol. 12 (12). P. 2085;2091.
- 59. Ratziu V. A Clinical Trial to Evaluate the Efficacy and Safety of Two Aramchol Doses Versus Placebo in Patients With NASH (Aramchol005) // ClincialTrails.gov NCT02279524.
- 60. Xiang M., Wang P.X., Wang A.B. et al. Targeting hepatic TRAF1-ASK1 signaling to improve inflammation, insulin resistance, and hepatic steatosis // J Hepatol. 2016. Vol. 64. P. 1365−1377.
- 61. Loomba R. et al. GS-4997, an inhibitor of apoptosis signal-regulating kinase (ASK1), alone or in combination with simtuzumab for the treatment of non-alcoholic steatohepatitis (NASH): A randomized, phase 2 trial // AASLD. 2016. Abstract LB3.
- 62. Gilead Sciences. Safety, Tolerability and Efficacy of GS-4997 Alone or in Combination With Simtuzumab (SIM) in Adults With Nonalcoholic Steatohepatitis (NASH) and Fibrosis Stages F2-F3 // ClinicalTrial.gov NCT02466516.
- 63. Gilead Sciences. Safety and Efficacy of Simtuzumab (GS-6624) in Adults With Advanced Liver Fibrosis But Not Cirrhosis Secondary to Non-Alcoholic Steatohepatitis (NASH) // ClinicalTrials.gov: NCT01672866.