Реакции метаболической трансформации

Суперсемейство цитохромов Р-450 поражает своими почти неограниченными метаболическими возможностями. Оно включает более 1000 клонированных вариантов, способных катализировать около 60 типов ферментативных реакций с тысячами субстратов, как эндогенных (стероиды, жирные кислоты, простагландины, лейкотриены, цитокины, биогенные амины), так и ксенобиотиков. В клетках человека обнаружено 18 семейств… Читать ещё >
Реакции метаболической трансформации (реферат, курсовая, диплом, контрольная)
Окисление
В ЭПР функционируют НАДФи НАД-зависимые дыхательные цепи, коферментами которых служат никотинамидадениндинуклеотидфосфат (НАДФ) и никотинамидадениндинуклеотид (НАД) соответственно. В НАДФ-зависимой системе терминальным переносчиком электронов служит цитохром Р-450 — мембраносвязанный липофильный фермент группы многоцелевых монооксигеназ1. Цитохром P-450 имеет строение гемопротеина: состоит из глобулярного белка и железопротопорфиринового комплекса (атом железа в степени окисления +3, порфириновый макроцикл, осевые лиганды). Буква Р в названии происходит от слова пигмент, число 450 означает, что восстановленный, связанный с оксидом углерода цитохром наиболее активно поглощает излучение с длиной волны 450 нм.
Цитохром Р-450 глубоко погружен в липидный бислой мембраны ЭПР и функционирует совместно с НАДФзависимой цитохром P-450-редуктазой. Соотношение количества молекул цитохрома Р-450 и редуктазы составляет 10:1. Активные центры этих ферментов ориентированы на цитоплазматическую поверхность ЭПР.
Цикл окисления лекарственных средств при участии цитохрома Р-450 состоит из следующих реакций (рис. 31).
- • Окисленный цитохром Р-450 соединяется с лекарственным средством.
- • Комплекс «цитохром-лекарство» восстанавливается цитохром Р-450-редуктазой с использованием электрона НАДФН.
- • Восстановленный комплекс «цитохром-лекарство» связывается с молекулярным (триплетным) кислородом.
- • Кислород активируется электроном НАДФН (триплетный кислород становится синглетным).
- • На финальном этапе один атом кислорода включается в молекулу окисляемого лекарственного средства, второй — в молекулу воды.
- • Цитохром Р-450 регенерирует в исходную окисленную форму. НАД-зависимая дыхательная цепь включает цитохром Ь5, НАДН-цитохром-редуктазу и стероил-КоА-десатуразу. Гемсодержащий фермент цитохром
Ь5 представляет собой двухдоменный белок. Глобулярный цитозольный домен связывается с редуктазой, короткая спирализованная гидрофобная цепь погружена в мембрану ЭПР. Электроны от НАДН переносятся редуктазой на окисленный атом железа цитохрома Ь5. Стероил-КоА-десатураза катализирует образование двойных связей в жирных кислотах.
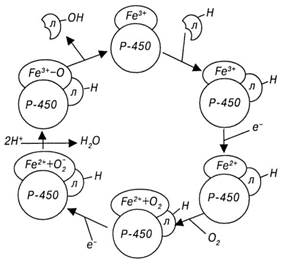
Рис. 3−1. Механизм окисления лекарственных средств при участии цитохрома Р-450.
Суперсемейство цитохромов Р-450 поражает своими почти неограниченными метаболическими возможностями. Оно включает более 1000 клонированных вариантов, способных катализировать около 60 типов ферментативных реакций с тысячами субстратов, как эндогенных (стероиды, жирные кислоты, простагландины, лейкотриены, цитокины, биогенные амины), так и ксенобиотиков. В клетках человека обнаружено 18 семейств цитохрома Р-450, разделенных на 44 подсемейства. Названия изоферментов цитохрома Р-450 обозначаются символом CYP, первая цифра обозначает семейство, затем следует латинская буква, указывающая подсемейство, последняя цифра соответствует конкретному полипептиду. В молекулах изоферментов одного семейства идентичны более 40% аминокислот, в молекулах одного подсемейства — более 55%.
1 Монооксигеназы включают кислород в окисляемые субстраты.
Метод фенотипирования позволяет установить субстратную специфичность изоферментов цитохрома Р-450 по соотношению концентраций неизмененного вещества и его метаболитов в крови.
Методом генотипирования с помощью полимеразной цепной реакции изоферменты идентифицируют по их генам, так как каждый изофермент кодируется одним из 53 генов, локализованных в разных локусах хромосом. Большинство реакций катализируют изоферменты цитохрома Р-450 семейств 1,2 и 3 (рис. 3−2, табл. 3−2).
элиминация лекарственный фармакологический биотрансформация.
Рис. 3−2. Изоферменты цитохрома Р-450.
Таблица 3−2. Содержание изоферментов цитохрома Р-450 в печени человека, локализация в хромосомах, индукторы и ингибиторы.
Изоферменты цитохрома Р- 450. | Содержание в печени, %. | Локус в хромосоме (первая цифра — номер хромосомы). | Индукторы. | Ингибиторы. | |
1А1. | <1. | Щ2224. | Полициклические ароматические углеводороды (в легких преобразуются в канцерогенные метаболиты). | ||
1А2. | ^22^ет. | Фенитоин, фенобарбитал, примидон, рифампицин, полициклические ароматические углеводороды, никотин. | Имипрамин, амитриптилин, флувоксамин, тиклопидин, эритромицин, кларитромицин, фторхинолоны (ципрофлоксацин, пефлоксацин), препараты интерферона. | ||
1В1. | <1. | 2q22-q22. | ; | ; | |
2А6. | Щ13.2. | Фенобарбитал. | Ритонавир | ||
2В6. | <1. | Щ13.2. | Фенитоин, фенобарбитал, примидон. | ; | |
2С8. | Не установлено. | 10q24.1. | Фенобарбитал, примидон. | ; | |
2С9. | 10q24.1−24.3. | Фенитоин, рифампицин. | Пароксетин, флувоксамин, флуоксетин, фенилбутазон, диклофенак, кетопрофен, амиода-рон, флувастатин, зафирлукаст, дисульфирам, сульфаметок-сазол, дапсон, кетоконазол, метронидазол. | ||
Изоферменты цитохрома Р- 450. | Содержание в печени, %. | Локус в хромосоме (первая цифра — номер хромосомы). | Индукторы. | Ингибиторы. | |
2С18. | Не. | Локус в. | ; | ; | |
установлено. | хромосоме 10. | ||||
2С19. | 10q24.1−24.3. | Фенитоин, фенобарбитал, примидон, рифампицин. | Имипрамин, флувоксамин, омепразол. | ||
2Б6. | 2,5. | 22д13.1. | Тиоридазин, галоперидол, имипрамин, кломипрамин, флуоксетин, пароксетин, сертралин, хинидин, пропафенон. | ||
2Е1. | 10q24.3-qter. | Этанол, пиразол, пиридин. | Дисульфирам, ритонавир | ||
ЗА4. | 7q22.1. | Фенитоин, фенобарбитал, примидон, карбамазепин, окскарбазепин, пиоглитазон, глюкокортикоиды, спиронолактон, рифампицин, рифабутин, гиперфорин зверобоя. | Флуоксетин, флувоксамин, пароксетин, амиодарон, хинидин, омепразол, зафирлукаст, эритромицин, кларитромицин, хлорамфеникол, норфлоксацин, ципрофлоксацин, кетоконазол, флуконазол, итраконазол, клотримазол, индинавир, нелфинавир, метронидазол. | ||
ЗА5. | 7q22.1. | Фенитоин, фенобарбитал, примидон, карбамазепин, окскарбазепин, рифампицин. | Кетоконазол, клотримазол, миконазол, метронидазол. | ||
Реакции окисления, катализируемые цитохромом Р-450, могут расщепляться с образованием свободных радикалов кислорода и токсических промежуточных продуктов (эпоксидов, Б-окисей, альдегидов). Свободные радикалы и активные интермедиаты, инициируя перекисное окисление мембранных липидов, вызывают некроз клеток, мутации, тератогенный и эмбриотоксический эффекты, способствуют появлению неоантигенов, провоцируют канцерогенез и ускоряют старение. По этой причине не существует абсолютно безвредных ксенобиотиков.
Токсические продукты биотрансформации обезвреживаются конъюгацией с восстановленным глутатионом и ковалентным связыванием с альбуминами. Повреждение молекулы альбумина неопасно, так как этот белок синтезируется в печени со скоростью 10−16 г в день и присутствует в высоких концентрациях в ЭПР.
Ксенобиотики в процессе окисления могут разрушать цитохром Р-450. Такие вещества получили название «суицидные субстраты». Свойствами суицидных субстратов обладают четыреххлористый углерод, галотан и парацетамол, преобразуемые цитохромом Р-450 в свободные радикалы. Эффект этих веществ можно рассматривать не только как токсический, но и как протективный: под их влиянием элиминируются молекулы цитохрома Р-450, генерирующие реакционно-способные метаболиты.