Смещение химического равновесия.
Принцип ЛеШателье

Задача 2. При изучении гомогенной реакции, А + 2 В = D получены следующие данные: в момент времени t1 = 50 мин количество вещества, А в реакторе составляло 12 моль, а в момент времени t2 = 1 ч 05 мин составляло 8 моль. Вычислить среднюю скорость химической реакции за исследованный промежуток времени по веществу, А и по веществу В, если объем реакционной массы составлял 110 л. Направление смещения… Читать ещё >
Смещение химического равновесия. Принцип ЛеШателье (реферат, курсовая, диплом, контрольная)
При химическом равновесии не происходит изменение количеств веществ в системе, однако это не означает, что химическая реакция не протекает; она идет, но с одинаковыми скоростями в двух противоположных направлениях, Такое равновесие является динамическим.
Если система, находящаяся в равновесии, подвергается внешнему воздействию, то скорость прямой и обратной реакций изменяются по разному. При наступлении равновесия в новых условиях эти скорости также выравниваются, но значения их будут уже другими. В этом случае принято считать, что произошло смещение равновесия.
Направление смещения равновесия можно представить, пользуясь принципом ЛеШателье, или принципом подвижного равновесия: если на систему, находящуюся в состоянии химического равновесия, оказывается внешнее воздействие (изменяется температура, давление или концентрации), то положение равновесия смещается в ту сторону, которая ослабляет данное воздействие.
Влияние температуры В соответствии с принципом ЛеШателье, нагревание вызывает смещение равновесия в сторону того процесса, протекание которого сопровождается поглощением тепла, иначе говоря, повышение температуры вызывает возрастание константы скорости эндотермического процесса.
Естественно, что понижение температуры, приводит к противоположному результату. Равновесие смещается в сторону того процесса, протекание которого сопровождается выделением тепла, иначе говоря, охлаждение благоприятствует экзотермическому процессу и вызывает рост константы скорости экзотермической реакции.
Например, если в установившемся равновесии:
2SO2(г)+О2(г) 2SO3(г); ДH=791,6кДж повышать температуру, то это воздействие сместит равновесие в сторону поглощения теплоты. Таковым является разложение SO3.
Влияние давления Изменение давления вызывает сдвиг равновесия только в том случае, когда количество газообразного вещества меняется до и после реакции.
Влияние давления определяется изменением объема, которое происходит в ходе реакции. Следовательно, при увеличении давления равновесие будет смещаться в сторону образования меньшего количества вещества (молей) газа.
Из этого следует, что в рассматриваемой равновесной системе увеличение давления сместит равновесие в сторону образования SO3.
Влияние концентрации Если внешнее воздействие на систему проявляется в уменьшении концентрации одного из веществ, участвующих в реакции, то это смещает равновесие в сторону его образования. Наоборот, при увеличении концентрации одного из веществ равновесие смещается в сторону той реакции, в которой это вещество расходуется.
Увеличение концентрации SO2 и O2 (или одновременно) сместит равновесие в сторону образования SO3, как процесса, приводящего к уменьшению концентрации SO2 и O2. Если по мере образования из реакционной среды удаляется SO3, то равновесие тоже сдвинется вправо. Таким образом, если в реакционную смесь ввести избыток одного из исходных веществ, то равновесие смещается в сторону образования продуктов реакции.
Примеры решения задач Пример 1. В системе А (г)+2 В (г)С (г) равновесные концентрации равны.
[А]=0,06 моль/ л; [В]=0,12моль/ л; [С]=0,216 моль/ л; найти константу равновесия реакции и исходные концентрации веществ, А и В.
Решение:
Константа равновесия данной реакции выражается уравнением:

Подставляем в него данные задачи, получаем:
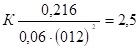
Для нахождения исходных концентраций веществ, А и В учтем, что согласно уравнению реакции, из 1 моля, А и 2 молей В образуется 1 моль С. По условию задачи в каждом литре системы образовалось 0,216 моля С, следовательно, было израсходовано 0,216 моля, А и 0,216 * 2 = 0,432 моля В. Таким образом, искомые исходные концентрации равны:
[А0] = 0,06+0,216= 0,276 моль/ л;
[В0] = 0,12+0,432= 0,552 моль/ л;
Пример 2. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению PCl5 (г) PCl3 (г)+ PCl2 (г); ДН = +92,59кДж. Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону реакции разложения PCl5.
Решение:
- а) т.к. реакция разложения PCl5 эндотермическая, то для смещения равновесия в сторону прямой реакции нужно повысить температуру;
- б) т.к. в данной системе разложения PCl5 ведет к увеличению объема (из одной молекулы газа образуется две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление;
- в) смещение равновесия в указанном направлении можно достигнуть как увеличением концентрации PCl5, так и уменьшением концентрации PCl3 или Cl2.
Пример 3. В сторону какой реакции (прямой или обратной) сместится химическое равновесие обратимой реакции N2 + 3H2 2NH3, если повысить температуру равновесной системы? Прямая реакция экзотермическая.
Решение:
В соответствии с принципом ЛеШателье, при повышении температуры ускоряется реакция, ослабляющая внешнее воздействие, т. е. обратная реакция, протекающая с поглощением теплоты.
Пример 4. Обратимая реакция протекает по уравнению 2NО + О2 2NО2. В сторону какой реакции (прямой или обратной) сместиться химическое равновесие, если давление увеличить в 2 раза?
Решение:
Пусть равновесные концентрации до увеличения давления составляли:
[NO]= a моль/ л,.
[O2]= в моль/ л,.
[NO2]= с моль/ л, скорость прямой реакции — V1, скорость обратной реакции — V2.
Тогда V1=К1 а2 в; V1=К2с2 .
При увеличении давления в 2 раза:
[NO]=2а моль/ л, [O2]= 2 В моль/ л, [NO2]=2с моль/ л; скорости прямой и обратной реакций при новых условиях: V11 = К1 (2а)2 2 В = К18а2в;
V21 = K2 (2с)2 = K24с2.
Отсюда:
V11 / V1 = К18а2 В / (K1а2в) = 8; V21 / V2 = 4K2C2/ (К2С2) = 4.
Следовательно, при увеличении давления в равновесной системе в 2 раза, скорость прямой реакции возрастает в 8 раз, а скорость обратной реакции в 4 раза, поэтому равновесие сместится вправо — в сторону образования NO2.
Пример 5. При 10 000С константа равновесия реакции FeO + CO Fe+CO2 равна 0,5. Каковы равновесные концентрации CO и CO2, если начальные концентрации этих веществ составляли: [CO]=0,05 моль/ л, [CO2]=0,01 моль/ л?
Решение:
Пусть к моменту равновесия в реакцию вступило Х моль СО. Тогда, согласно уравнению реакции, образовалось Х моль СО2. следовательно, к моменту равновесия: [CO]= (0,05Х) моль/ л; [CO2] = (0,01+Х) моль/ л.
Отсюда Кр = (0,01+Х) / (0,05Х). Подставив в этом выражение Кр=0,5, получаем Х= 0,01. Таким образом, искомые равновесные концентрации будут иметь следующие значения: [CO]р = 0,05 — 0,01 = 0,04 моль/ л, [CO2]р = 0,01 + 0,01 = 0,02 моль/ л.
Пример 6. Константы равновесия реакции СО +Н2О СО2+Н2 при 727 и 9270С соответственно равны 1,4 и 0,74. Как найти ДG этой реакции и определить ее направление при указанных температурах?
Решение:
ДG находится из уравнения ДG= RT ln K= 19,1*Т*lg K. Температуры 727 и 9270С соответственно равны 1000 и 1200 К.
Тогда: а) ДG1= 19,1 · 1000 lg 1,4= 2789 Дж/ моль = 2,8 кДж/ моль б) ДG2= 19,1 · 1200 lg 0,7= +2502 Дж/ моль = + 2,5 кДж/ моль.
Таким образом, в температурном интервале 727 и 9270С значение ДG проходит через нуль и направление реакции меняется с прямого на обратное, поэтому реакцию следует проводить при температуре ниже 8000С. С понижением температуры выход будет увеличиваться, однако, время достижения равновесия будет расти.
Пример 7. Известно, что при 2000 К равновесие N2 + O2 2 NO характеризуется константой Kc=2,3 · 104. Определить равновесную концентрацию окиси азота, если исходные концентрации C1(N2) и C1 (O2) будут по 1 моль/ л.
Решение:
Согласно уравнению реакции из каждого моля азота образуется 2 моль окиси азота. Следовательно, если обозначить равновесную концентрацию окиси азота C (NO), для достижения её надо затратить C (NO)/2 молей азота и сколько же молей кислорода. Равновесные концентрации можно записать следующим образом:
Cp (O2) = Cp (N2) = 1 — Cp (NO)/2.
Запишем выражение константы равновесия равной по условию 2,3 · 104.
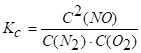
Подставив в него выражение равновесных концентраций, получаем:
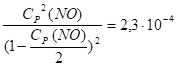
Решая это уравнение относительно Cp (NO), получим 1,52 · 102 моль/ л. Следовательно, при температуре 2000 К почти не происходит превращения исходных веществ (N2 и O2) в окись азота.
Пример 8. Как повлияет увеличение давления на химическое равновесие в обратимой системе:
Fe2O3 (k) + 3 H2 (г) 2Fe (k) + 3H2O (г) Решение:
В гетерогенной равновесной системе повышение давления должно привести к смещению равновесия в сторону реакции, приводящей к образованию меньшего количества веществ газов. Так как количество веществ газов, образующихся при протекании прямой и обратной реакции одинаковы, то изменение давления не приведет к смещению равновесия.
Контрольное задание по разделам «Скорость химических реакций», «Химическое равновесие».
Вариант 1.
Задача 1. Во сколько раз увеличится скорость (константа скорости) химической реакции при повышении температуры на 40 оС, если температурный коэффициент реакции равен 2?
Задача 2. При изучении гомогенной реакции, А + 2 В = D получены следующие данные: в момент времени t1 = 50 мин количество вещества, А в реакторе составляло 12 моль, а в момент времени t2 = 1 ч 05 мин составляло 8 моль. Вычислить среднюю скорость химической реакции за исследованный промежуток времени по веществу, А и по веществу В, если объем реакционной массы составлял 110 л.
Задача 3. В гомогенных химических системах при постоянном давлении, объёме и температуре установилось состояние равновесия. На основании закона действующих масс составьте выражения для константы равновесия. По данным значениям Кс укажите, реагенты или продукты будут преобладать в равновесной смеси веществ.
- 4NH3 +5O2 — 4NO + 6H2O, Kc=0.008
- 2C2H6 + 7O2 — 4CO2 + 6H2O, Kc=145
- 6HF + N2 — 2NF3 + 3H2, Kc=1
- 2NH3 + 3Cl2 — N2 + 6HCl, Kc=106
- 2CH4 + 3O2 + 2NH3 — 2HCN + 6H2O, Kc=1
- 2H2S + 3O2 — 2SO2 + 2H2O, Kc=3Ч105.
Задача 4. Определите значения (в моль/л) равновесных концентраций газообразных веществ для реакции.
Fe2O3(тв) +3СО (г) — 2Fe (тв) + 3CO2(г), Кс = 0.125,.
протекающей при некоторой постоянной температуре, если в некоторый момент концентрации газообразных веществ составляли: [CO] = 0.5 моль/л, [CO2] = 0.1 моль/л Задача 5. Равновесие реакции Н2 +J2 2НJ. установилось при следующих концентрациях: [H2] = 0,5 моль/ л; [J2] = 0,1 моль/ л; [HJ] = 1,8 моль/л. Определите исходные концентрации йода и водорода и константу химического равновесия.
Вариант 2.
Задача 1. На сколько градусов следует понизить температуру в реакционной смеси для уменьшения скорости реакции в 27 раз, если температурный коэффициент этой реакции 3?
Задача 2. В гетерогенных химических системах при постоянных термодинамических параметрах установилось состояние равновесия. На основании закона действующих масс составьте выражения для константы равновесия.
TiO2(тв) + 2С (тв) + 2Cl2(г) — TiCl4(г) + 2CO (г).
Mg3N2(тв) + 6H2O (г) — 3Mg (OH)2(тв) + 2NH3(г).
Si (тв) + 2H2O (г) — SiO2(тв) + 2H2(г).
CS2(г) + 2Cl2(г) — CCl4(г) + 2S (тв).
- 2NO2(г) + 2S (тв) — N2(г) + 2SO2(г)
- 10NO (г) + P4(г) — 5N2(г) + P4O10(тв).
Задача 3. Рассчитайте значения (в моль/л) равновесных концентраций газообразных веществ для реакции.
LiH (тв) + H2О (г) — LiOH (ж) + H2(г), Кс = 2.21,.
протекающей при некоторой постоянной температуре, если в некоторый момент концентрации газообразных веществ составляли: [H2O] = 0.75 моль/л, [H2] = 0.15 моль/л Задача 4. Средняя скорость гомогенной реакции 2А + 3 В = 2D + Е была вычислена по двум измерениям, проведенным на 45 и 52 минутах от начала реакции, и составила 0,09 моль· л-1·мин-1 по веществу А. Известно, что в начале указанного интервала времени концентрация вещества В была равна 1,20 моль/л. Найти концентрацию вещества B в момент второго измерения.
Задача 5. В каком направлении произойдет смещение равновесия системы:
Н2 +S Н2S,.
если: а) увеличить концентрацию водорода, б) понизить концентрацию сероводорода?
Вариант 3.
Задача 1. Чему равен температурный коэффициент реакции, если при увеличении температуры на 50 оС скорость реакции возросла в 32 раза?
Задача 2. На основании принципа Ле Шателье определите, в каком направлении сместится равновесие в следующих системах при повышении температуры и постоянном давлении:
- 2NO (г) + O2(г) — 2NO2(г), ДH0 < 0
- 2SO3(г) — 2SO2(г) + O2(г), ДH0 > 0
C (тв) + CO2(г) — 2СO (г), ДH0 > 0.
2NH3(г) — N2(г) + 3H2(г), ДH0 > 0.
C (тв) + 2Cl2(г) — CСl4(г), ДH0 < 0.
C (тв) + 2N2O (г) — СO2(г) + 2N2(г), ДH0 < 0.
Задача 3. Реакция идёт по уравнению N2 + O2 = 2NO. Концентрации исходных веществ до начала реакций были: [N2] = 0.049 моль/л, [O2] = 0.01 моль/л. Вычислите концентрацию этих веществ в момент, когда [NO] = 0.005 моль/л.
Задача 4. Для реакции, А + 3 В = D + 2Е средняя скорость реакции за интервал времени длительностью 5 мин 30 с составила 0,42 моль· л-1·мин-1. Считая объем реакционной смеси равным 200 л, вычислить убыль веществ, А и В в реакторе в течение указанного промежутка времени.
Задача 5. В каком направлении произойдет смещение равновесия при повышении температуры систем:
- а) COCl2 CO + Cl2 27ккал
- б) 2CO CО2 + C + 41 ккал
Вариант 4.
Задача 1. Напишите выражение константы равновесия для реакции:
2SO2 + O2 2SO3, H=791,6 кДж.
Какие условия способствуют увеличению выхода продукта горения?
Задача 2. На основании принципа Ле Шателье определите, в каком направлении сместится равновесие в следующих системах при повышении давления и постоянной температуре:
2Fe (тв) + 3H2O (г) — Fe2O3(г) + 3H2(г) С3H8(г) + 5O2(г) — 3СO2(г) + 4H2O (г) СO2(г) + 2N2(г) — С (тв) + 2N2O (г).
CO (г) + Cl2(г) — СCl2O (г).
CH4(г) + 4S (тв) — СS2(г) + 2H2S (г).
N2H4(г) + O2(г) — N2(г) + 2H2O (г) Задача 3. Реакция идёт по уравнению N2 + 3H3 = 2NH3. Концентрации участвующих в ней веществ были: [N2] = 0.80 моль/л, [H2] = 1.5 моль/л, [NH3] = 0.10 моль/л. Вычислите концентрацию водорода и аммиака, когда [N2] = 0.5 моль/л.
Задача 4. Написать выражения скорости реакций, протекающих по схеме.
2А + В = А2 В, если: а) А и В — газообразные вещества; б) А и В — жидкости, смешивающиеся в любых отношениях; в) А и В — вещества, находящиеся в растворе; г) А — твердое вещество, а В — газ или вещество, находящееся в растворе.
Задача 5. Как повлияет увеличение давления на смещение равновесия в системах:
- а) SO2(г) + Cl2 (г) SO2Cl2 (г)
- б) H2 (г) + Br2(г) 2 HBr (г)
Вариант 5.
Задача 1. Как будет влиять увеличение давления и температуры на смещение равновесия в системе.
2CO (г) CO2 (г) + C (тв), H<0?
Напишите выражение константы равновесия.
Задача 2. На основании принципа Ле Шателье определите, увеличится ли выход продуктов при одновременном понижении температуры и давления:
С (тв) + O2(г) — CO2(г), ДH0 < 0.
H2(г) + I2(г) — 2HI (г), ДH0 > 0.
- 6HF (г) + N2(г) — 2NF3(г) + 3H2(г), ДH0 > 0
- 2O3(г) — 3O2(г), ДH0 < 0
- 2CO (г) — 2C (тв) + O2(г), ДH0 > 0
I2(г) + 5CO2(г) — I2O5(г) + 5CO (г), ДH0 > 0.
Задача 3. Реакция идёт по уравнению H2 + I2 = 2HI. Константа скорости этой реакции при некоторой температуре равна 0.16. Исходные концентрации реагирующих веществ: [H2] = 0.04 моль/л, [I2] = 0.05 моль/л. Вычислить начальную скорость реакции и её скорость, когда [H2] = 0.03 моль/л.
Задача 4. При исследовании реакции, А + 2 В = АВ2, протекающей в газовой фазе, получены следующие данные зависимости скорости реакции от концентрации реагирующих веществ:
СА, моль/л. | 0,2. | 0,5. | 0,4. | |
СВ, моль/л. | 0,2. | 0,3. | 0,2. | |
Х Ч106, моль· л-1·с-1. | 32,0. | 1,8. | 0,67. | |
Вычислить среднее (из трех измерений) значение константы скорости реакции, указать размерность константы скорости.
Задача 5. В каком направлении сместится химическое равновесие обратимой реакции в случае повышения температуры:
- а) если прямая реакция экзотермическая;
- б) если обратная реакция экзотермическая?
Вариант 6.
Задача 1. В какую сторону сместится равновесие системы.
CO (г) + H2O (г) CO2 (г) + H2(г), H=43 кДж,.
- а) при уменьшении концентрации воды;
- б) при увеличении температуры;
- в) при уменьшении давления?
Напишите выражение константы равновесия.
Задача 2. На основании принципа Ле Шателье определите, увеличится ли выход продуктов при одновременном повышении температуры и понижении давления:
С (тв) + H2O (г) — CO (г) + H2(г), ДH0 > 0.
2(NO)Cl (г) + Br2(г) — 2(NO)Br (г) + Cl2(г), ДH0 > 0.
СO (г) + 2H2(г) — CH3OH (г) + 3H2(г), ДH0 < 0.
N2O4(г) — 2NO2(г), ДH0 > 0.
- 8H2S (г) + 8I2(г) — S8(г) + 16HI (г), ДH0 > 0
- 2CO (г) + O2(г) — 2CO2(г), ДH0 < 0.
Задача 3. В гомогенной системе CO + Cl2 — COCl2 равновесные концентрации реагирующих веществ: [CO] = 0.2 моль/л, [Cl2] = 0.3 моль/л, [COCl2] = 1.2 моль/л. Вычислите константу равновесия системы и исходные концентрации хлора и CO.
Задача 4. Для реакции 2А + В = А2 В, протекающей в растворе, получены следующие данные зависимости скорости реакции от концентрации вещества А, при том что концентрация другого реагента оставалась постоянной:
СА, моль/л. | 0,2. | 0,4. | |
Х Ч106, моль· л-1·с-1. | 1,43. | 3,85. | |
Численное значение константы скорости данной реакции равно.
1,2 Ч10−8 (размерность константы указать самостоятельно). Вычислить концентрацию вещества В в проведенных опытах (учесть возможную погрешность при экспериментальном определении скорости реакции).
Задача 5. Чему равна при 250С константа равновесия обратимой реакции, для которой значение ДG0 равно 5,714 кДж/ моль.
Вариант 7.
Задача 1. Чему равен температурный коэффициент реакции, если при увеличении температуры на 50 оС скорость реакции возросла в 32 раза?
Задача 2. На основании принципа Ле Шателье определите, в каком направлении сместится равновесие в следующих системах при повышении температуры и постоянном давлении:
- 2NO (г) + O2(г) — 2NO2(г), ДH0 < 0
- 2SO3(г) — 2SO2(г) + O2(г), ДH0 > 0
C (тв) + CO2(г) — 2СO (г), ДH0 > 0.
2NH3(г) — N2(г) + 3H2(г), ДH0 > 0.
C (тв) + 2Cl2(г) — CСl4(г), ДH0 < 0.
C (тв) + 2N2O (г) — СO2(г) + 2N2(г), ДH0 < 0.
Задача 3. Реакция идёт по уравнению N2 + O2 = 2NO. Концентрации исходных веществ до начала реакций были: [N2] = 0.049 моль/л, [O2] = 0.01 моль/л. Вычислите концентрацию этих веществ в момент, когда [NO] = 0.005 моль/л.
Задача 4. Для реакции, А + В = 2D + Е, протекающей в газовой фазе, константа скорости равна 0,80 Ч10−8 л· моль-1·с-1. Для некоторого момента времени определена скорость реакции, равная 1,25 моль· л-1·с-1. Рассчитать концентрации реагирующих веществ для указанного момента времени, если известно, что они равны между собой.
Задача 5. Константа равновесия обратимой реакции, А + В С + Д при данной температуре равна 2,5. В реакцию взяты эквивалентные массы веществ, А и В. Может ли установиться равновесие при одинаковой концентрации всех четырёх реагирующих веществ?
Вариант 8.
Задача 1. На сколько градусов следует понизить температуру в реакционной смеси для уменьшения скорости реакции в 27 раз, если температурный коэффициент этой реакции 3?
Задача 2. В гетерогенных химических системах при постоянных термодинамических параметрах установилось состояние равновесия. На основании закона действующих масс составьте выражения для константы равновесия.
TiO2(тв) + 2С (тв) + 2Cl2(тв) — TiCl4(г) + 2CO (г).
Mg3N2(тв) + 6H2O (г) — 3Mg (OH)2(тв) + 2NH3(г).
Si (тв) + 2H2O (г) — SiO2(тв) + 2H2(тв).
CS2(г) + 2Cl2(г) — CCl4(г) + 2S (тв).
- 2NO2(г) + 2S (тв) — N2(г) + 2SO2(г)
- 10NO (г) + P4(г) — 5N2(г) + P4O10(тв).
Задача 3. Рассчитайте значения (в моль/л) равновесных концентраций газообразных веществ для реакции.
LiH (тв) + H2О (г) — LiOH (ж) + H2(г), Кс = 2.21,.
протекающей при некоторой постоянной температуре, если в некоторый момент концентрации газообразных веществ составляли: [H2O] = 0.75 моль/л, [H2] = 0.15 моль/л Задача 4. Гомогенная реакция между веществами, А и В протекает по уравнению, А + 2 В > продукты. В начальный момент времени концентрация вещества, А равна 1,8 моль/л, а концентрация вещества В равна 2,8 моль/л. Константа скорости реакции равна 0,12 (размерность константы указать самостоятельно). Вычислить скорость химической реакции в начальный момент и в тот момент, когда в реакцию вступит 35% вещества В.
Задача 5. Напишите выражение для константы равновесия гомогенной системы СН4 + СО2 2СО + 2Н2.
Как следует изменить температуру и давление, чтобы повысить выход водорода? Реакция образования водорода эндотермическая.
Вариант 9.
Задача 1. Во сколько раз увеличится скорость (константа скорости) химической реакции при повышении температуры на 40 оС, если температурный коэффициент реакции равен 2?
Задача 2. В гомогенных химических системах при постоянном давлении, объёме и температуре установилось состояние равновесия. На основании закона действующих масс составьте выражения для константы равновесия. По данным значениям Кс укажите, реагенты или продукты будут преобладать в равновесной смеси веществ.
- 4NH3 +5O2 — 4NO + 6H2O, Kc=0.008
- 2C2H6 + 7O2 — 4CO2 + 6H2O, Kc=145
- 6HF + N2 — 2NF3 + 3H2, Kc=1
- 2NH3 + 3Cl2 — N2 + 6HCl, Kc=106
- 2CH4 + 3O2 + 2NH3 — 2HCN + 6H2O, Kc=1
- 2H2S + 3O2 — 2SO2 + 2H2O, Kc=3Ч105.
Задача 3. Определите значения (в моль/л) равновесных концентраций газообразных веществ для реакции.
Fe2O3(тв) +3СО (г) — 2Fe (тв) + 3CO2(г), Кс = 0.125,.
протекающей при некоторой постоянной температуре, если в некоторый момент концентрации газообразных веществ составляли: [CO] = 0.5 моль/л, [CO2] = 0.1 моль/л Задача 4. Гомогенная реакция проходит в растворе по уравнению.
xA + yB > продукты. Установлено, что при увеличении в 3 раза концентрации вещества, А скорость реакции возрастает в 3 раза, а при уменьшении в 2 раза концентрации реагента В скорость реакции уменьшается в 4 раза. С учетом представленных данных вычислить скорость реакции в моль· л-1·с-1 для момента, когда концентрации обоих исходных веществ равны 1,3 моль/л (константа скорости реакции равна 6,7Ч10−6; размерность константы указать самостоятельно).
Задача 5. В гомогенной газовой системе, А + B — C + D равновесие установилось при концентрациях: [В] = 0.05 моль/л и [C] = 0.02 моль/л. Константа равновесия системы равна 0.04. Вычислите исходные концентрации веществ, А и В.
Вариант 10.
Задача 1. Предложите оптимальное изменение термодинамических параметров (температуры и давления) для увеличения выхода продуктов в системах:
SO3 (г) + NO (г) SO2 (г) + NO2 (г), H>0;
PCl5 (г) PCl3 (г) + Cl2 (г), H>0;
2CuO (тв) + СO2(г) + H2O (г) Cu2CO3(OH)2 (тв), H<0.
Задача 2. На основании принципа Ле Шателье определите, увеличится ли выход продуктов при одновременном повышении температуры и понижении давления:
С (тв) + H2O (г) — CO (г) + H2(г), ДH0 > 0.
2(NO)Cl (г) + Br2(г) — 2(NO)Br (г) + Cl2(г), ДH0 > 0.
СO (г) + 2H2(г) — CH3OH (г) + 3H2(г), ДH0 < 0.
N2O4(г) — 2NO2(г), ДH0 > 0.
- 8H2S (г) + 8I2(г) — S8(г) + 16HI (г), ДH0 > 0
- 2CO (г) + O2(г) — 2CO2(г), ДH0 < 0.
Задача 3. При некоторой температуре равновесие гомогенной газовой системы 2NO+O2−2NO2 установилось при следующих концентрациях реагирующих веществ: [NO] = 0.2 моль/л, [O2] = 0.1 моль/л, [NO2] = 0.1 моль/л. Вычислить равновесную и исходную концентрацию азота.
Задача 4. Вычислить, как изменится скорость прямой реакции.
2NO + Cl2 = 2NOCl при увеличении давления в 4 раза.
Задача 5. Реакция идёт по уравнению N2 + 3H3 = 2NH3. Концентрации участвующих в ней веществ были: [N2] = 0.80 моль/л, [H2] = 1.5 моль/л, [NH3] = 0.10 моль/л. Вычислите концентрацию водорода и аммиака, когда [N2] = 0.5 моль/л.
Вариант 11 Задача 1. Как повлияет понижение температуры и давления на равновесие следующих обратимых реакций:
COCl2 CO + Cl2, H>0;
N2O4 2NO2, H>0;
MgCO3 MgO2 + CO2, H<0;
Выразите константу равновесия. Задача 2. Предложите оптимальное изменение термодинамических параметров (температура, давление) для увеличения выхода продуктов в системах:
H2(г) + Br2(ж) — 2HBr (г), ДH0 < 0.
N2(г) + 3H2(г) — 2NH3(г), ДH0 < 0.
SO3(г) + NO (г) — SO2(г) + NO2(г), ДH0 > 0.
PCl5(г) — PCl3(г) + Сl2(г), ДH0 > 0.
СO2(г) + 2SO3(г) — CS2(г) + 4O2(г), ДH0 > 0.
2CuO (тв) + CO2(г) + H2O (г) — Cu2CO3(OH)2(тв), ДH0 < 0.
Задача 3. Константа равновесия гомогенной газовой системы.
CO + H2O — CO2 + H2.
при некоторой температуре равна 1. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации: [CO]=0.10 моль/л, [H2O]=0.40 моль/л, [CO2]=0.016 моль/л, [H2]=0.016 моль/л.
Задача 4. Определить, во сколько раз следует увеличить давление, чтобы скорость образования NO2 по реакции 2NO + O2 = 2NO2 возросла в 1000 раз?
Задача 5. Реакция идёт по уравнению H2 + I2 = 2HI. Константа скорости этой реакции при некоторой температуре равна 0.16. Исходные концентрации реагирующих веществ: [H2] = 0.04 моль/л, [I2] = 0.05 моль/л. Вычислить начальную скорость реакции и её скорость, когда [H2] = 0.03 моль/л.
Вариант 12.
Задача 1. В каком направлении будет смещаться равновесие с повышением температуры и давления для следующих обратимых реакций:
- 2NO + O2 2NO2, H<0;
- 3O2 2O3, H>0;
- 2H2O + O2 H2O2, H<0;
- 2CO + O2 2CO2, H<0;
Выразите константу равновесия.
Задача 2. На основании принципа Ле Шателье определите, увеличится ли выход продуктов при одновременном понижении температуры и давления:
С (тв) + O2(г) — CO2(г), ДH0 < 0.
H2(г) + I2(г) — 2HI (г), ДH0 > 0.
- 6HF (г) + N2(г) — 2NF3(г) + 3H2(г), ДH0 > 0
- 2O3(г) — 3O2(г), ДH0 < 0
- 2CO (г) — 2C (тв) + O2(г), ДH0 > 0
I2(г) + 5CO2(г) — I2O5(г) + 5CO (г), ДH0 > 0.
Задача 3. Вычислите константу равновесия для гомогенной газовой системы.
CO + H2O — CO2 + H2,.
если равновесные концентрации реагирующих веществ: [CO]=0.004 моль/л, [H2O]=0.064 моль/л, [CO2]=0.016 моль/л, [H2]=0.016 моль/л. Чему равны исходные концентрации воды и CO?
Задача 4. Во сколько раз увеличится скорость (константа скорости) химической реакции при повышении температуры на 40 °C, если температурный коэффициент реакции равен 2?
Задача 5. В гомогенной системе CO + Cl2 — COCl2 равновесные концентрации реагирующих веществ: [CO] = 0.2 моль/л, [Cl2] = 0.3 моль/л, [COCl2] = 1.2 моль/л. Вычислите константу равновесия системы и исходные концентрации хлора и CO.
Вариант 13.
Задача 1. Как изменится скорость химической реакции.
2Fe + 3 Cl2 = 2FeCl3,.
если давление в системе увеличить в 6 раз? Выразите закон действия масс для данного уравнения. Задача 2. На основании принципа Ле Шателье определите, в каком направлении сместится равновесие в следующих системах при повышении давления и постоянной температуре:
2Fe (тв) + 3H2O (г) — Fe2O3(г) + 3H2(г) С3H8(г) + 5O2(г) — 3СO2(г) + 4H2O (г) СO2(г) + 2N2(г) — С (тв) + 2N2O (г).
CO (г) + Cl2(г) — СCl2O (г).
CH4(г) + 4S (тв) — СS2(г) + 2H2S (г).
N2H4(г) + O2(г) — N2(г) + 2H2O (г) Задача 3. Константа скорости реакции разложения N2O, протекающей по уравнению.
2N2O = 2N2 + O2,.
равна 5Ч104. Начальная концентрация [N2O]=6 моль/л. Вычислите начальную скорость реакции и её скорость, когда разложится 50% N2O.
Задача 4. Реакция протекает при 80 °C с некоторой скоростью. До какой температуры следует понизить температуру в реакционной смеси для уменьшения скорости реакции в 27 раз, если температурный коэффициент этой реакции равен 3?
Задача 5. В гомогенной системе А+2B-C равновесные концентрации реагирующих газов: [А] = 0.06 моль/л, [В] = 0.12 моль/л, [C] = 0.216 моль/л. Вычислите константу равновесия системы и исходные концентрации веществ, А и В.
Вариант 14.
Задача 1. Во сколько раз необходимо увеличить для реакции.
2H2S + SO2 = 3S + 2H2O.
концентрацию сероводорода или оксида серы (IV), чтобы в обоих случаях скорость реакции возросла в 9 раз?
Задача 2. На основании принципа Ле Шателье определите, в каком направлении сместится равновесие в следующих системах при повышении температуры и постоянном давлении:
- 2NO (г) + O2(г) — 2NO2(г), ДH0 < 0
- 2SO3(г) — 2SO2(г) + O2(г), ДH0 > 0
C (тв) + CO2(г) — 2СO (г), ДH0 > 0.
2NH3(г) — N2(г) + 3H2(г), ДH0 > 0.
C (тв) + 2Cl2(г) — CСl4(г), ДH0 < 0.
C (тв) + 2N2O (г) — СO2(г) + 2N2(г), ДH0 < 0.
Задача 3. В гомогенной газовой системе, А + B — C + D равновесие установилось при концентрациях: [В] = 0.05 моль/л и [C] = 0.02 моль/л. Константа равновесия системы равна 0.04. Вычислите исходные концентрации веществ, А и В.
Задача 4. Чему равен температурный коэффициент реакции, если при увеличении температуры на 50 °C скорость реакции возросла в 32 раза?
Задача 5. Вычислите константу равновесия для гомогенной газовой системы.
CO + H2O — CO2 + H2,.
если равновесные концентрации реагирующих веществ: [CO]=0.004 моль/л, [H2O]=0.064 моль/л, [CO2]=0.016 моль/л, [H2]=0.016 моль/л. Чему равны исходные концентрации воды и CO?
Вариант 15.
Задача 1. Напишите выражение константы равновесия для процесса:
Fe (тв) + H2O (г) = FeO (тв) + H2 (г).
Изменится ли состояние равновесия при: а) увеличении в системе количества железа; б) при изменении давления?
Задача 2. Предложите оптимальное изменение термодинамических параметров (температура, давление) для увеличения выхода продуктов в системах:
H2(г) + Br2(ж) — 2HBr (г), ДH0 < 0.
N2(г) + 3H2(г) — 2NH3(г), ДH0 < 0.
SO3(г) + NO (г) — SO2(г) + NO2(г), ДH0 > 0.
PCl5(г) — PCl3(г) + Сl2(г), ДH0 > 0.
СO2(г) + 2SO3(г) — CS2(г) + 4O2(г), ДH0 > 0.
2CuO (тв) + CO2(г) + H2O (г) — Cu2CO3(OH)2(тв), ДH0 < 0.
Задача 3. В гомогенной системе А+2B-C равновесные концентрации реагирующих газов: [А] = 0.06 моль/л, [В] = 0.12 моль/л, [C] = 0.216 моль/л. Вычислите константу равновесия системы и исходные концентрации веществ, А и В. Задача 4. Две реакции при температуре 298 К характеризуются одинаковыми константами скорости реакции. При повышении температуры до 328 К константа скорости второй реакции в восемь раз превосходит константу скорости первой реакции. Вычислить, в каком отношении находятся температурные коэффициенты этих двух реакций. Задача 5. Константа скорости реакции разложения N2O, протекающей по уравнению 2N2O = 2N2 + O2, равна 5Ч104. Начальная концентрация [N2O]=6 моль/л. Вычислите начальную скорость реакции и её скорость, когда разложится 50% N2O.