Вопросы для подготовки к экзамену

Составьте электронную формулу атомов железа, графически укажите валентные электроны в нормальном и возбужденном состояниях. Какие степени окисления может проявлять атом железа? Приведите примеры оксидов и гидроксидов железа в соответствующих степенях окисления, укажите их характер. Если в момент химического равновесия 2NO + O2 2NO2 концентрации NO, O2 и NO2 соответственно равны 8 моль/л., 6… Читать ещё >
Вопросы для подготовки к экзамену (реферат, курсовая, диплом, контрольная)
- 1. Строение атома. Работы Резерфорда. Модель атома по Резерфорду. Основные элементарные частицы атома. Химический элемент. Изотопы.
- 2. Дуализм природы электрона. Понятие об орбиталях. Виды симметрии атомных орбиталей.
- 3. Квантовые числа: главное, орбитальное, магнитное, спиновое, их физический смысл и взаимосвязь.
- 4. Электронная структура многоэлектронных атомов. Принцип Паули, правил Гунда, принцип минимального запаса энергии.
- 5. Структура периодической системы химических элементов Д. И. Менделеева: -s, -p, -d, -f элементы и их место в периодической системе.
- 6. Валентные электроны атомов, элементовs, -p, -d, семейства, валентность атома в нормальном и возбужденном состоянии. Степень окисления.
- 7. Периодичность свойства химических элементов: атомные радиусы, потенциал ионизации, энергия сродства к электрону, относительная электроотрицательность атомов.
- 8. Ковалентная связь, образование и определение на примере молекулы водорода.
- 9. Обменный механизм образования ковалентной связи, пояснить на примере. Свойство насыщенности ковалентной связи.
- 10. Донорно-акцепторный механизм образования ковалентной связи.
- 11. Полярность химической связи. Направленность ковалентной связи.
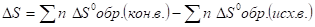
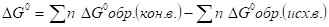
- 12. Скорость химической реакции. Гомогенные и гетерогенные реакции. Зависимость скорости реакции от концентрации и температуры.
- 13. Химическое равновесие, константа равновесия, ее вывод, физический смысл. Смещение химического равновесия. Принцип Ле-Шателье.
- 14. Теория электролитической диссоциации. Основные ее положения.
- 15. Степень электролитической диссоциации. Сильные и слабые электролиты.
- 16. Кислоты, основания, соли с точки зрения теории электролитической диссоциации.
- 17. Ионные реакции обмена в растворах электролитов.
- 18. Слабые электролиты. Диссоциация слабых электролитов. Константа диссоциации. Закон разбавления Оствальда.
- 19. Электролитическая диссоциация воды, ионное произведение воды. Водородный показатель.
- 20. Гидролиз солей.
- 21. Окислительно-восстановительные реакции. Важнейшие окислители и восстановители с точки зрения строения атома.
- 22. Электродные потенциалы и их зависимость от природы металла и концентрации электролита.
- 23. Стандартные электродные потенциалы. Ряд напряжений металлов.
- 24. Химические источники тока (гальванические элементы, аккумуляторы).
- 25. Электролиз расплавов и растворов солей.
- 26. Коррозия металлов и защита металлов от коррозии (электрохимическая коррозия, анодное и катодное покрытие, протекторная защита металлов).
- 27. Получение металлов (основные способы). Основные свойства металлов, взаимодействие металлов с кислотами.
- 28. Химия металлов: щелочные металлы — IA группы.
- 29. Щелочные металлы — IIA группы.
- 30. Вода. Жесткость воды и ее устранение.
- 31. Металлы подгруппы алюминия — III, А группы.
- 32. Алюминий. Химические свойства, амфотерность гидроксида алюминия.
- 33. Хром.
- 34. Марганец.
- 35. Металлы семейства железа.
- 36. Металлы I Б — группы/ медь, серебро, золото.
- 37. Металлы IIБ — группы/цинк, кадмий, ртуть.
- 38. Свинец.
Алгоритм ответа по химии металлов:
- 1. Положение в периодической системе, изменение свойств в группе: ОЭО потенциала ионизации.
- 2. Строение атома: а) электронная формула;
- б) графическое изображение валентных электронов, валентность;
- в) формулы оксидов и гидроксидов в устойчивых степенях окисления;
- 3. Физические свойства.
- 4. Получение металла.
- 5. Химические свойства металла, оксида, гидроксида, солей.
- 6. Применение металлов, оксидов, гидроксидов, солей.
Тесты для самоподготовки к экзамену Вариант № 1.
Часть А.
- 1. Составьте электронную формулу атомов железа, графически укажите валентные электроны в нормальном и возбужденном состояниях. Какие степени окисления может проявлять атом железа? Приведите примеры оксидов и гидроксидов железа в соответствующих степенях окисления, укажите их характер.
- 2. Если в момент химического равновесия 2NO + O2 2NO2 концентрации NO, O2 и NO2 соответственно равны 8 моль/л., 6 моль/л., 4 моль/л., то начальные концентрации исходных веществ (NO и O2) были:
- 1) 12 моль/л и 8 моль/л;
- 2) 14 моль/л и 8 моль/л;
- 3) 16 моль/л и 12 моль/л;
- 4) 32 моль/л и 24 моль/л.
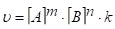
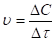
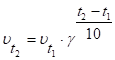
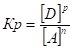
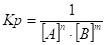
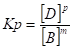
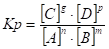
3. Окисление аммиака протекает по уравнению: Н обр. 4NH3 + 3O2 = 2N2 + 6 H2O Н x.p. = -1528 кДж
кДж/моль г г г ж (-285,84).
теплота образования аммиака (Н0 обр.(NH3)) равна:
- 1) -92,15 кДж/моль;
- 2) 92,15 кДж/моль;
- 3) 46,76 кДж/моль;
- 4) -46,76 кДж/моль.
- 4. Реакция восстановления оксида меди (II) алюминием возможна
G0 обр. 3CuO + 2Al = Al2O3 + 3Cu.
кДж/моль -129,8 -1582.
свободная энергия Гиббса (G х.р.) равна:
1) -1192 кДж;
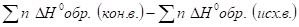
- 2) -3576 кДж;
- 3) +1192 кДж;
- 4) +3576 кДж
- 5. При взаимодействии 1 моль ортофосфорной кислоты с 1 моль гидроксидом натрия образуется:
- 1) ортофосфат натрия 3) дигидроортофосфат натрия
- 2) гидроортофосфат натрия 4) фосфат натрия
Составьте молекулярно-ионные уравнения реакций. Сумма всех коэффициентов в кратком ионном уравнении равна…
- 6. Метилоранж становится желтым при растворении в воде каждой из двух солей:
- 1) K2S и K3PO4 3) LiCl и FeSO4
- 2) KNO3 и K3PO4 4) CH3COOK и K2SO4
Составьте молекулярно-ионные уравнения реакций гидролиза.
- 7. При взаимодействии водных растворов солей сульфата алюминия и карбоната натрия, сумма коэффициентов в кратком ионном уравнении равна:
- 1) 10 2) 12 3) 13 4) 9
- 8. Кислая среда образуется при растворении в воде каждой из двух солей:
- 1) BaCl2 и AlCl3 3) CuCl2 и LiCl
- 2) K2S и K3PO4 4) NH4NO3 и Zn (NO3)2
Составьте молекулярно-ионные уравнения гидролиза, выведите константу гидролиза по первой ступени.
9. В уравнение реакции схема которой:
FeSO4 + KMnO4 + H2SO4 Fe2(SO4)3 + MnSO4 + K2SO4 + H2O.
Сумма коэффициентов перед формулами исходных веществ равна:
- 1) 20 3) 25
- 2) 18 4) 22
Дайте полное решение задания (используйте ионно-электронный метод).
- 10. Установите правильную последовательность действий при определении типа гибридизации Ц.А. в частице:
- 1. Определите тип гибридизации;
- 2. Вычислите ст. ок., Ц.А. и число неспаренных ();
- 3. Найдите Ц. А. в частице;
- 4. Укажите К. Ч. (Ц.А.) и число связей;
- 5. Графически изобразите валентные () Ц.А. в соответствующей степени окисления.
- 6. Определите валентные электроны, участвующие в образовании связей в периферийных атомах и покажите их перекрывание с ГАО Ц.А.
- 7. Изобразите структурную формулу, указывающую геометрию частицы.
Установите соответствие:
- 11. Тип гибридизации Ц.А. Частица
- 1) sp2 a) Н2О
- 2) sp3 б) ВН3
- 3) sp3d в) SCl6
- 4) sp3d2 г) CO
- 5) sp д) PCl5
Рассмотрите по алгоритму те частицы, в которых Ц.А. в sp3 и sp3d гибридизации.
12. В Г. Э.: Ag | AgNO3 | | Fe (NO3)2 | Fe.
Электроды.
| Процессы.
| |
Рассчитайте ЭДС при н.у.
Дайте полное решение заданий
13. При электролизе раствора сульфата цинка с графитовым анодом и катодом на катоде выделится:
|
| |
- 14. Рассмотрите электролиз раствора нитрата серебра, если:
- а) графитовые электроды
- б) серебряный анод
- 15. Протектором для железа может быть:
- 1) хром;
- 2) олово;
- 3) серебро;
- 4) золото.
16. Условно — графическ…
г) золото — влажный воздух.
79. Алюминий склёпан медью
Электроды:
| Металлы и заряды:
|
Выберите правильный вариант ответа.
- 80. Покрытие анодное:
- 1) цинк — медью;
- 2) медь — алюминием;
- 3) медь — золото;
- 4) алюминий — серебром.
- 81. При нарушения покрытия во влажном воздухе химизм процесса на электродах …
Дополните:
- 82. Устройство для электролиза называется …, в нем энергия…, превращается в энергию …
- 83. Анод — электрод, на котором идет процесс …, имеет заряд …, подходят частицы …
- 84. На катоде в первую очередь разряжаются частицы, р которых …
- 85. Сила тока (Ja), необходимая для электролиза вычисляется по формуле …
- 86. На аноде разряжается кислотный остаток …
- 87. Электрод — «окислитель» это …
- 88. Электролиз с растворимым анодом используется:
1) …
2) …
Установите соответствие:
89. В состав соли входит металл:
| На катоде выделяется:
| |
90. При электролизе раствора соли.
На аноде разряжается:
| Кислотный остатоканион:
|
Выберите правильный вариант.
91. Из смеси катионов: Ag+, Cu2+, Fe2+, Zn2+ в первую очередь восстановятся катионы:
|
| |
92. Для покрытия металла никелем электролиз ведут, используя:
|
| |
- 93. При электролизе раствора хлорида натрия среда раствора у катода:
- 1) кислая
- 2) нейтральная
- 3) щелочная
- 94. Кальций можно получить из хлорида кальция путем:
- 1) электролиза раствора
- 2) электролиза расплава
- 3) восстановлением водорода
- 4) термического разложения.
- 95. При электролизе раствора хлорида меди (анод медный) на аноде окислится:
- 1) хлор
- 2) кислород
- 3) водород
- 4) медь
- 96. При электролизе раствора карбоната натрия с графитовыми электродами на аноде происходит:
- 1) выделение СО2
- 2) выделение кислорода
- 3) выделение водорода
- 4) осаждение натрия.