Гальванический элемент Даниэля-Якоби

Гальванический элемент ДаниэляЯкоби (рис. 7.1), который состоит из медной и цинковой пластинок, опущенных в растворы своих солей. На поверхности цинковой пластинки устанавливается равновесие. Если при этом ЭДС положительна, то реакция возможна при стандартных условиях, так как G реакции и электрическая работа (ЭДС) связаны между собой соотношением: Для осуществления таких реакций обычно… Читать ещё >
Гальванический элемент Даниэля-Якоби (реферат, курсовая, диплом, контрольная)
Гальванический элемент ДаниэляЯкоби (рис. 7.1), который состоит из медной и цинковой пластинок, опущенных в растворы своих солей. На поверхности цинковой пластинки устанавливается равновесие.
ZnZn2+ + 2з, которому соответствует потенциал Zn. На поверхности медной пластинки устанавливается равновесие.
CuCu2+ + 2з, которому соответствует равновесный потенциал Сu.
Потенциал цинкового электрода имеет более отрицательное значение, поэтому при замыкании внешней цепи электроны будут переходить от цинка (анод) к меди (катод). В результате этого процесса равновесие на аноде (Zn) сместится вправо и в раствор перейдет дополнительное количество ионов цинка (происходит растворение анода). В то же время равновесие на медном электроде сместится влево и произойдет выделение меди на катоде. На аноде образуется избыток электронов, поэтому анод в гальванических элементах заряжен отрицательно, а катод — положительно.
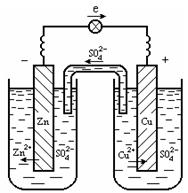
Рис. 1. Медно-цинковый гальванический элемент
Т.о. при замыкании внешней цепи возникают самопроизвольные процессы растворения цинка на цинковом электроде и выделения меди на медном электроде. Электроны от анода по внешней цели протекают к катоду. Электрическую цепь замыкает движение ионов в растворах.
Схема гальванического элемента, заменяющая рисунок, записывается следующим образом:
ZnZn2+¦Cu2+Cu .
- (А): Zn 2з = Zn2+,(окисление)
- (К): Cu2+ + 2з = Cu0,(восстановление)
Zn + Cu2+ = Zn2+ + Cu .
Суммарная реакция, протекающая в гальваническом элементе, называется токообразующей.
Причиной возникновения и протекания электрического тока в гальваническом элементе является разность электродных потенциалов (ЭДС) двух окислительно-восстановительных систем, соединенных между собой. ЭДС (о) любого гальванического элемента определяется общей формулой:
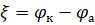
или.
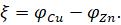
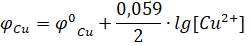
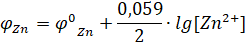
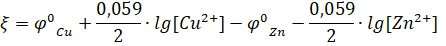
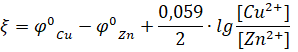
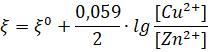
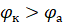
Так как о может иметь только положительное значение, то, т. е. катодом является электрод с более высоким электродным потенциалом.
При таком осуществлении окислительно-восстановительной реакции ее энергия превращается в электрическую энергию, которую можно использовать, включив во внешнюю цель устройство, потребляющее электрическую энергию (например, электронагревательный прибор, электрическую лампу и т. п.).
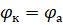
С течением времени разность потенциалов будет снижаться, т.к. концентрация ионов цинка, а следовательно, и потенциал цинкового электрода будут увеличиваться, а концентрация ионов меди и потенциал медного электрода постепенно будут снижаться. Данные процессы будут продолжаться до тех пор, пока не выровняются потенциалы электродов () или не растворится весь цинк (высадится вся медь), т. е. пока ЭДС не станет равной нулю.
Как уже было показано, электроды, а следовательно, и гальванические элементы могут быть созданы не только для реакции окисления-восстановления металлов, но и для любых веществ и окислительно-восстановительных реакций, происходящих в растворах или расплавах. Например, для реакции в растворе.
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O.
процессы окисления и восстановления можно разделить в виде полуреакций :
на аноде: 5 SO32 + H20 = SO42 + 2H+ + 2з; (0,17 В),.
на катоде: 2 MnO4 + 8H+ + 5e = Mn2+ + 4H2O (1,51 В).
2MnO4 + 5SO32 + 6H+ + 10з = 2Mn2+ + 5SO42 + 3H2O + 10з.
Токообразующая реакция:
2MnO4 + 5SO32 + 6H+ = 2Mn2+ + 5SO42 + 3H2O.
Для осуществления таких реакций обычно используют катализатор, который одновременно является проводником электронов, например платину (рис. 7.2).
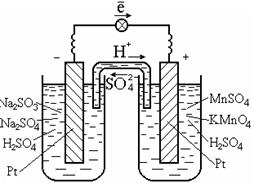
Рис. 2. Гальванический элемент на окислительно-восстановительной реакции в растворе
Схема гальванического элемента:
Pt | SO32, SO42, H+|| MnO4, Mn2+, H+| Pt .
Значения стандартных электродных потенциалов полуреакций приводятся в справочниках. ЭДС такого элемента при стандартных условиях можно определить как разность потенциалов для полуреакций восстановления (окислителя) и окисления (восстановителя).
о = 0 = 0 (MnО4/ Mn2+) 0 (SO42 / SO32) = 1,51 0,17 = 1,34 B.
Если при этом ЭДС положительна, то реакция возможна при стандартных условиях, так как G реакции и электрическая работа (ЭДС) связаны между собой соотношением:
G = n· F·о.
Таким образом, разность потенциалов на электродах можно не только непосредственно измерить, но и вычислить из чисто химических экспериментальных данных. В случае нестандартных условий потенциал электрода и ЭДС элемента рассчитывается по формуле Нернста.