Физико-химические исследования иминов на основе антрацен-9-илметилантрацена

Другим широко распространенным классом комплексонов являются производные ацетилацетона. При реакции ацетилацетона с амином 4 происходит замещение только одного атома кислорода в карбонильной группе с образованием 4-пент-3-ен-2-она (9). Для замещения обоих атомов кислорода предварительно из ацетилацетона получен его монокеталь — 1-(2-метил-1,3-диоксалан-2-ил)ацетон, который в дальнейшем при… Читать ещё >
Физико-химические исследования иминов на основе антрацен-9-илметилантрацена (реферат, курсовая, диплом, контрольная)
Одним из возможных направлений решения проблемы контроля состава окружающей среды является использование материалов, содержащих сигнальные органические молекулы. Системы, содержащие хелатирующие фрагменты, нашли широкое применение в качестве хемосенсоров, ионных жидкостей, OLED-материалов, жидких кристаллов [1−3].
При создании эффективных флуоресцентных хемосенсоров особую роль играет выбор рецепторной части ответственной за селективность создаваемого аналитического реагента. Проведенные ранее исследования продемонстрировали принципиальную возможность использования азометиновых производных в качестве эффективных флуоресцентных хемосенсоров на катионы тяжелых металлов [4,5].
Используя в качестве альдегидной основы 3-R-2-гидрокси-6,7,8,9-тетрагидродибензо[b, d]фуран-1-карбальдегиды (1−3), а в качестве аминной компоненты антрацен-9-илметилантрацена (4) синтезирована серия орто-гидроксиазометинов 5−7.
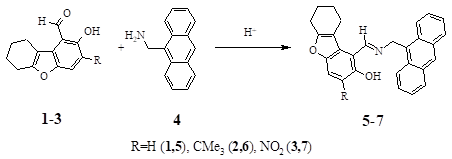
Другим широко распространенным классом комплексонов являются производные ацетилацетона [6]. При реакции ацетилацетона с амином 4 происходит замещение только одного атома кислорода в карбонильной группе с образованием 4-[(антрацен-9-илметил)амино]пент-3-ен-2-она (9). Для замещения обоих атомов кислорода предварительно из ацетилацетона получен его монокеталь — 1-(2-метил-1,3-диоксалан-2-ил)ацетон, который в дальнейшем при взаимодействии с двумя эквивалентами производного 4 образует N-(антрацен-9-илметил)-N-{3-[(антрацен-9-илметил)амино]-1-метилбут-2-илиден}амин (11).
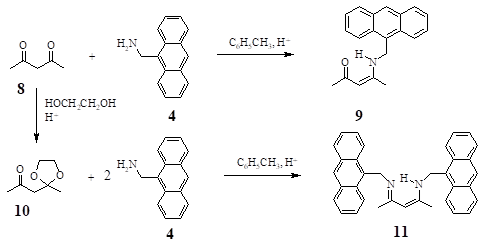
В спектрах ЯМР 1Н всех синтезированных соединений присутствуют характерные сигналы метиленовых групп связанных с антраценовым фрагментом: синглет в области 4,95−6.06 м.д. (для соединений 5−7 и 11) и дублет при 5.35 м.д. (в случае имина 9).
Оценку сенсорной способности соединений (5−7, 9, 11) проводили по данным спектров флуоресценции в области локальной флуоресценции антрацена (лмах=411−415 нм). Для этого к растворам полученных иминов (с=5Ч10-6 моль/л) добавляли расчетный пятикратный мольный избыток ацетатов металлов (Zn2+, Cd2+, Co2+, Ni2+, Cu2+, Pb2+, Hg2+) или трифторуксусной кислоты.
Согласно спектральным исследованиям, некоторые из производных (например, 6, 7, 9) в основе которых лежат широко используемые в координационной химии орто-гидроксибензальдегиды и ацетилацетон (системы, способные к образованию таутомерных комплексов хелатного типа), оказались перспективными для использования в качестве флуоресцентных хемосенсоров на катионы. Так, добавление солей Zn2+ к ацетонитрильному раствору имина 6 приводит к пятикратному увеличению интенсивности флуоресценции. Аналогичных эффект вызывает протонирование соединений 7, 9 — резкое разгорание флуоресценции в 70 и 20 раз соответственно. В случае азометинов 5, 11 также происходит изменения интенсивности флуоресценции при добавлении катионов, однако селективность определения достаточно низкая.
Таким образом, показана принципиальная возможность использования иминов ряда антрацен-9-илметиламина в качестве флуоресцентных сенсоров на катионы H+ и Zn2+.
Работа выполнена при финансовой поддержке ФЦП «Проведение центром коллективного пользования научным оборудованием » Высокие технологии" Южного федерального университета поисковых научно-исследовательских работ в области создания экологически чистых технологий получения новых активных нано- и микроструктурированных материалов для использования в современной сенсорике" (ГК № 16.552.11.7024).
Спектры ЯМР 1Н регистрировали на спектрометре Varian Unity 300 (300 МГц), внешний стандарт — ТМС. Растворитель CDCl3 или DMSO-d6. ИК спектры получали на приборе Specord 75IR (суспензия в вазелиновом масле). Электронные спектры поглощения получали на спектрофотометре Varian Cary 100, флуоресценции — на спектрофлуориметре Varian Cary Eclipse. Температуры плавления определяли в стеклянных капиллярах на приборе ПТП (М). Полноту протекания реакции и чистоту полученных соединений контролировали с помощью ТСХ (пластины Silufol U254, элюент — хлороформ, проявление парами йода во влажной камере).
Антрацен-9-метиламин (4) получен по реакции Делепина разложением уротропиновой соли с выходом 46% [7].
Общая методика получения 1-{[(антрацен-9-илметил)имино]метил}-R-6,7,8,9-тетрагидродибензо[b, d]фуран-2-олов (5−7). К раствору 0.41 г (2 ммоль) амина (4) в 5 мл 1-бутанола последовательно прибавляют несколько капель AcOН и 2 ммоль соответствующего альдегида 1−3. Нагревают смесь в течение 30 мин, охлаждают, отфильтровывают выпавший осадок. Кристаллизуют из подходящего растворителя.
хемосенсор антрацен метиламин реакция.
- 1-{[(Антрацен-9-илметил)имино]метил}-6,7,8,9-тетрагидродибензо[b, d]фуран-2-ол (5). Выход 72%. Тпл=219−220єС (1-бутанол). ИК спектр, н, см-1: 1620, 1467, 1387. Спектр ЯМР 1Н, д, м.д.: 1.52−1.90 (4H, м., 2CH2); 2.03 (2H, т., CH2); 2.60 (2H, т., CH2); 5.90 (2H, c., CH2); 6.47−8.80 (12H, м., аром. H, СН); 13.27 (1H, c., NH). Спектр флуоресценции в ацетонитриле, лmax, нм (с = 5Ч10-5 моль/л): 415.
- 1-{[(Антрацен-9-илметил)имино]метил}-3-трет-бутил-6,7,8,9-тетрагидродибензо-[b, d]фуран-2-ол (6). Выход 71%. Тпл=211−212єС (1-бутанол). ИК спектр, н, см-1: 3400, 1615, 1465, 1380, 1335. Спектр ЯМР 1Н, д, м.д.: 1.32 (9H, c., 3CH3); 1.48−2.00 (6H, м., (CH2)3); 2.55 (2H, т., CH2); 5.93 (2H, c., CH2); 7.00−8.8 (11H, м., аром. H); 14.10 (1H, c., OH). Спектр флуоресценции в ацетонитриле, лmax, нм (с = 5Ч10-5 моль/л): 414.
- 1-{[(Антрацен-9-илметил)имино]метил}-3-нитро-6,7,8,9-тетрагидродибензо[b, d]-фуран-2-ол (7). Выход 83%. Тпл=293−294єС (1-бутанол-ДМФА). ИК спектр, н, см-1: 3387, 1586, 1467, 1375. Спектр ЯМР 1Н, д, м.д.: 1.60−1.87 (4H, м., (CH2)2); 2.3 (2H, т., CH2); 2.68 (2H, т., CH2); 6.06 (2H, c., CH2); 7.46−8.82 (11H, м., аром. Н, СН); 15.05 (1H, c., OH). Спектр флуоресценции в ацетонитриле, лmax, нм (с = 5Ч10-5 моль/л): 415.
- 4-[(Антрацен-9-илметил)амино]пент-3-ен-2-он (9). Нагревают 0.41 г (2 ммоль) амина (4) и 0.23 мл (2.2 ммоль) ацетилацетона в 20 мл толуола с насадкой Дина-Старка в течение 2 часов, растворитель удаляют в вакууме, остаток кристаллизуют из 1-бутанола. Выход 0.41 г (71%). Тпл=184−185єС (1-бутанол). ИК спектр, н, см-1: 1620, 1567, 1470, 1387, 1293. Спектр ЯМР 1Н, д, м.д.: 1.88 (3H, c., CH3); 2.26 (3H, c., CH3); 5.03 (1H, c., CH); 5.35 (2H, д., CH2); 7.40−8.50 (9H, м., аром. Н); 10.93 (1H, c., NH). Спектр флуоресценции в ацетонитриле, лmax, нм (с = 5Ч10-5 моль/л): 411.
N-(Антрацен-9-илметил)-N-{3-[(антрацен-9-илметил)амино]-1-метилбут-2-или-ден]амин (11). Кипятят смесь 0.46 г (2.2 ммоль) амина (4) и 0.14 г (1 ммоль) 1-(2-метил-1,3-диоксалан-2-ил)ацетона в 10 мл толуола в течение 5−6 часов, раствор упаривают до 2−3 мл, охлаждают, выпавший осадок отфильтровывают и кристаллизуют из 1-бутанола. Выход 0.30 г (63%). Тпл=236−237єС (1-бутанол). ИК спектр, н, см-1: 3400, 1610, 1547, 1467, 1373. Спектр ЯМР 1Н, д, м.д.: 2.12 (6H, c., CH3); 4.67 (1H, c., CH); 4.95 (4H, c., CH2); 6.78−8.10 (18H, м., аром.); 11.42 (1H, c., NH). Спектр флуоресценции в ацетонитриле, лmax, нм (с = 5Ч10-5 моль/л): 414.
- 1. Брень, В. А. Флуоресцентные и фотохромные хемосенсоры / В. А. Брень // Успехи химии. 2001. Т. 70. № 12. С. 1152−1174.
- 2. Valeur, B. Design principles of fluorescent molecular sensors for cation recognition / B. Valeur, I. Leray // Coord. Chem. Rev. 2000. Vol. 205. P. 3−40.
- 3. de Silva, A.P. Luminescent Sensors and Swithes. In Handbook of Photochemistry and Photobiology (Ed. Nalwa H.S.) / A.P. de Silva, G.D. McClean, T.S. Moody, S.M. Weir. ASP, CA: Stevenson Ranch. 2003. P. 217−270.
- 4. Толпыгин, И. Е. Хемосенсоры на основе N-(2-аминофенил)-N-(9-антрилметил)амина / И. Е. Толпыгин, В. П. Рыбалкин, Е. Н. Шепеленко и др. // ЖОрХ. 2008. Т. 44. № 4. C. 562−565.
- 5. Толпыгин, И.Е., Хемосенсоры на основе N-(2-аминофенил)-N-(9-антрилметил)амина. Часть 2 / И. Е. Толпыгин, Е. Н. Шепеленко, Ю. В. Ревинский и др. // ЖОрХ. 2009. Т. 45. № 2. C. 175.
- 6. Гарновский, А. Д. Современные аспекты синтеза металлокомплексов. Основные лиганды и методы / А. Д. Гарновский, И. С. Васильченко, Д. А. Гарновский. ЛаПО: Ростов-на-Дону. 2000. 355 с.
- 7. Kristian, P. Izotiokyanaty. XIX. Synteza a infracervene spectra polynuklear nuch arylmethylizotiocyanatov / P. Kristian, E. Zavodska, K. Antos, L. Drobnica // Chemicke zvesti. 1967. Vol. 21. № 1−2. P. 57−64.