Решение проблемы сводимости химии к физике в логическом эмпиризме с точки зрения межтеоретических отношений

Итак, сводится ли теория валентности и химической связи к квантовой механике? В философии науки понятие сведения одной теории к другой анализировал Э. Нагель. При этом он исходил из «стандартной» модели научной теории (у нас ее обычно называют гипотетико-дедуктивной): научная теория есть дедуктивная система, построенная иерархически, — в ней из исходных общих предложений, представляющих научные… Читать ещё >
Решение проблемы сводимости химии к физике в логическом эмпиризме с точки зрения межтеоретических отношений (реферат, курсовая, диплом, контрольная)
Итак, сводится ли теория валентности и химической связи к квантовой механике? В философии науки понятие сведения одной теории к другой анализировал Э. Нагель [29]. При этом он исходил из «стандартной» модели научной теории (у нас ее обычно называют гипотетико-дедуктивной): научная теория есть дедуктивная система, построенная иерархически, — в ней из исходных общих предложений, представляющих научные законы высшей общности (их можно назвать аксиомами или постулатами), следуют предложения средней общности, а из них предложения, выражающие факты. Скажем, из законов Ньютона следует предложение средней общности: «наибольшая дальность полета камня, брошенного под углом к горизонту, достигается при угле бросания в 45°». Из этого предложения в свою очередь дедуктивно следуют фактофиксирующие предложения, описывающие отдельные бросания.
Согласно Э. Нагелю редукция теории состоит в дедуктивном выводе исходных положений редуцируемой (сводимой) теории из той теории, к которой осуществляется редукция. Исходные положения редуцируемой теории, таким образом, становятся положениями средней общности в редуцируемой теории.
Нагель также подчеркивал важный момент в редукции теорий. Эта редукция не может быть осуществлена без дополнительных построений. Необходимы «правила соответствия» (их называют также мостиковыми положениями), связывающие ключевые термины редуцируемой теории и терминологию той теории, к которой осуществляется редукция. О логической форме этих «правил соответствия» в логическом эмпиризме шли споры. Однако сам факт необходимости правил никто не оспаривал.
Э. Нагель приводит простой пример редукции теорий: сведение феноменологического закона Бойля — Мариотта к кинетической теории газов. Он фактически воспроизводит тот вывод этого закона, который имеется в «Фейнмановских лекциях, но физике». Он подчеркивает, что этот вывод предполагает «правило соответствия», связывающее температуру газа со средней кинетической энергией молекул.
Редукция химической теории валентности и межатомных связей к квантовой механике протекает в принципе по той же схеме. Однако есть существенная оговорка. Эта редукция осуществляется с применением приближенных методов. Точное решение уравнения Шрёдингера возможно лишь для простейшей молекулярной системы — молекулярного иона водорода, да и то в приближении неподвижных ядер. Но химия здесь не находится в особых условиях. Скажем, физика твердого тела также выводится из квантовой механики при применении приближенных методов. С учетом сказанного можно согласиться с мнением о том, что «квантовая механика сводит проблемы химии к задачам прикладной математики» [24, с. 6].
Итак, развитие квантовой химии может быть понято как приблизительная дедукция химических законов из законов квантовой механики[1]. Каковы же правила соответствия, которые обеспечивают эту дедукцию? Уравнение Шрёдингера (фундаментальный закон квантовой механики) связывает энергию микросистемы с ее строением, записанным в виде дифференциального оператора (гамильтониана), входящего в левую часть этого уравнения. Химическая связь в доквантовой химии объяснялась за счет образования электронных пар (ковалентная связь) или за счет притяжения разноименно заряженных ионов. Применение квантовой механики привело к энергетической трактовке химической связи. «Теория валентности представляет собой теорию вычисления энергии молекулы… Формулируя в самом общем виде, можно сказать, что причина образования молекулы из двух атомов заключается в понижении полной энергии при сближении атомов» .
В несколько иных терминах: «электронная структура и свойства молекулы в любом из ее стационарных состояний могут быть в принципе определены из решения стационарного уравнения Шрёдингера… Волновая функция (или функция состояния) 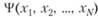 , которая описывает электронное состояние молекулы, должна обладать определенными математическими свойствами. В частности, она должна быть „квадратично интегрируемой“… Полная энергия молекулы должна быть отрицательной для химически связанной молекулы, и она также должна быть меньше суммы энергий отдельных атомов, из которых построена молекула, если молекула стабильна по отношению к диссоциации на атомы» .
, которая описывает электронное состояние молекулы, должна обладать определенными математическими свойствами. В частности, она должна быть „квадратично интегрируемой“… Полная энергия молекулы должна быть отрицательной для химически связанной молекулы, и она также должна быть меньше суммы энергий отдельных атомов, из которых построена молекула, если молекула стабильна по отношению к диссоциации на атомы» .
И далее: «Химическую связь можно объяснять как результат концентрирования электронной плотности в тех или иных областях в молекуле с результирующим понижением полной потенциальной энергии молекулы, что полностью соответствует интуитивным представлениям элементарной теории валентности» .
Квантовая химия имеет сложную структуру. В ее основе лежат фундаментальные положения квантовой механики — уравнение Шрёдингера, принцип суперпозиции, соотношения неопределенностей. Кроме этих положений, квантовая химия использует ряд общих дополнительных допущений, например гипотезу спина электрона. Далее идут гипотезы, определяющие ту или иную версию квантовой химии[2]. На заре квантовых расчетов в химии популярность получила версия, именуемая теорией валентных связей. Здесь принималось допущение, свойственное доквантовым электронным теориям, — химическая связь образуется за счет образования электронных пар (построенных из двух электронов с противоположными спинами). Что значит это допущение в квантовой химии? Это значит, что волновая функция молекулы строится на основе волновых функций, описывающих пары электронов, ответственные за образование химических связей в этой молекуле.
Несколько позже получило распространение одноэлектронное приближение, называемое теорией молекулярных орбиталей. Здесь волновая функция молекулы (или группы электронов, ответственной за образование химической связи) берется в виде произведения одноэлектрониых волновых функций. При этом одноэлектронные волновые функции, удовлетворяющие уравнению Шрёдингера для атома, называются атомными орбиталями (иногда — орбитами), а одноэлектронные волновые функции для молекулы — соответственно, молекулярными орбиталями.
Каждая из этих версий может трактоваться как отдельная гипотетикодедуктивная теория: к фундаментальным положениям квантовой механики добавляется еще одно положение, справедливое только в рамках данной версии. Из этой совокупности дедуктивно следуют положения, описывающие факты. Скажем, из уравнения Шредингера, записанного для молекулы водорода, и гипотезы о том, что химическая связь образуется за счет возникновения электронной пары, следует утверждение, касающееся энергии связи в этой молекуле, утверждение, соответствующее эмпирическим данным.
В этом собственно состоял первый (или один из первых) квантово-механический расчет в химии — расчет, выполненный Гейтлером и Лондоном в 1927 г.
Мы, однако, не учли еще другие факторы, усложняющие структуру квантовой химии. Каждая из названных версий (теорий) имеет две подверсии (или подтеории): расчетную (количественную) и наглядную (качественную). Расчетная — это решение приближенных уравнений и оценка энергии связи и других параметров молекулы. При этом приближенные расчеты тоже различаются степенями приближения, бывают более или менее строгими.
Наглядная квантовая химия — это диаграммы и формулы, а также понятия, выраженные не на языке математики, а на обычном разговорном языке (его также называют естественным языком, отличая от искусственного — языка математики, впрочем, различение искусственных и естественных языков тоже условно).
Только что речь шла о расчете энергии связи молекулы водорода, выполненного Гейтлером и Лондоном в рамках теории валентных связей. Эта теория известна и своим наглядным вариантом, названным теорией резонанса (эта теория упоминалась в предыдущем параграфе: в начале 1950;х гг. в СССР проходила целая «антирезонансная кампания»). Теорию резонанса можно трактовать как теорию, развивающую классическую химическую символику. Еще в доквантовой химии использовалось многоструктурное изображение химического строения молекул. Например, строение молекулы бензола изображалось в виде двух структур Кеккуле (схема 18.4.1).
Схема 18.4.1. Строение молекулы бензола в виде двух структур Кеккуле.
В теории резонанса многоструктурное представление химического соединения опирается на квантово-механический принцип суперпозиции, согласно которому всякое стационарное состояние может рассматриваться как суперпозиция (наложение) базисных состояний. Обычное устойчивое состояние любой молекулы является стационарным. В теории резонанса в качестве базисных состояний принимаются гипотетические состояния, изображаемые классическими структурными формулами (или доквантовыми электронными формулами). Причем предполагается, что эти состояния могут вносить разный «вклад» в реальное строение химического соединения. В принципе, чем больше классических структурных формул может быть написано для данной молекулы, тем выше ее стабильность.
Теория молекулярных орбиталей также известна в двух версиях. Ее количественная (расчетная) версия известна как теория Хартри — Фока. Это самая эффективная теория расчета молекулярных структур, фактически вытеснившая расчеты по методу валентных связей.
Теория молекулярных орбиталей (которая сама есть «подтеория» квантовой химии) нередко применяется в версии «молекулярная орбиталь — линейная комбинация атомных орбиталей» или сокращенно — МО ЛКАО. Речь идет о том, что волновые функции, представляющие состояния электронов в молекуле, строятся как линейные комбинации волновых функций, представляющих состояния электронов атомов, входящих в молекулу.
МО ЛКАО, однако, существует как в расчетном, так и наглядном (качественном) вариантах. Этот последний состоит в построении диаграмм, изображающих, как молекула строится из атомов, точнее как состояния электронов молекулы слагаются из электронных состояний атомов. На схеме 18.4.2 приведена сложная молекулярная (другое название — корреляционная) диаграмма, изображающая комплексное соединение — ферроцен, где иономкомплексообразователем служит железо, а лигандами — молекулы бензола Не вникая далее в структуру квантовой химии, заметим, что идейной базой этой области знания служит принцип сводимости химической теории межатомной связи и валентности к квантовой механике. Это следующий принцип: в химическом взаимодействии и химической связи нет ничего, кроме электромагнетизма. И электромагнитное взаимодействие подчиняется законам квантовой механики.
- [1] Отличие линии, проведенной в параграфе 18.2, основанной на подходе, описанном в гл. 9, состоит, во-первых, в том, что в основу кладутся не законы, а объекты, во-вторых, в том, что построение моделей — действие, отличное от дедукции (примеч. А. Л.)
- [2] По сути «версии» — это различные квантовомеханические модели и связанные с ними приближенные методы расчета (примеч. А. Л).