Типы протолитических реакций
Реакция переноса протона между кислотой и основанием называется нейтрализацией. Если раствор содержит сильную кислоту, то протоны полностью перешли к молекулам воды, и в нейтрализации участвует гидроксоний. Напишем реакции нейтрализации сильной кислоты с сильным основанием (КОН), слабым основанием (NII3) и слабой кислоты со слабым основанием: Соль, образованная сильным основанием и сильной… Читать ещё >
Типы протолитических реакций (реферат, курсовая, диплом, контрольная)
Перенос протона между молекулами приводит к появлению электрически заряженных частиц, т. е. ионов. Такие протолитические реакции называются реакциями ионизации. К реакциям этого типа относится перенос протона от молекул кислот к молекулам воды.
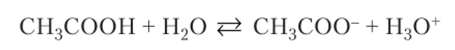
или перенос протона от молекулы воды к молекуле основания.
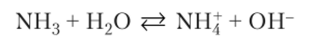
Реакция переноса протона между кислотой и основанием называется нейтрализацией. Если раствор содержит сильную кислоту, то протоны полностью перешли к молекулам воды, и в нейтрализации участвует гидроксоний. Напишем реакции нейтрализации сильной кислоты с сильным основанием (КОН), слабым основанием (NII3) и слабой кислоты со слабым основанием:
- 1) ОН- + Н30~ = 2Н20; при стехиометрических количествах кислоты и щелочи раствор становится нейтральным;
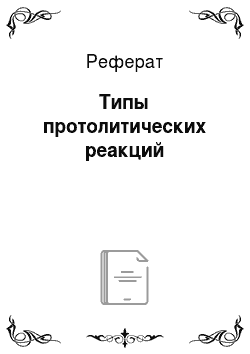
- 2) NH3 + Н30+ NHJ + Н20; при стехиометрических количествах кислоты и основания среда после нейтрализации кислая, так как остаются не вступившие в реакцию ионы Н30+;
- 3) СН3СООН + NH3 СН3СОО~ + NHJ. Реакция в прямом направлении между молекулярными кислотой и основанием считается нейтрализацией, а обратная реакция между ионными кислотой и основанием — гидролизом. Константа равновесия протолитической реакции между слабой кислотой и слабым основанием вычисляется как отношение Ка кислоты слева в уравнении и кислоты справа:
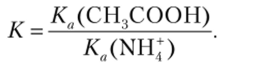
Константы можно найти в табл. 14.4 и произвести вычисления.
Гидролиз. Ионы растворенных солей могут участвовать в протолитических реакциях, если они производятся от слабых кислот и оснований. Эти реакции представляют собой частный случай гидролиза, т. е. разложения веществ водой.
Протолитические реакции ионов солей с молекулами воды называются
реакциями гидролиза солей.
Разные типы солей создают в растворах нейтральную, щелочную или кислую среду, что зависит от характера гидролиза.
Пример 14.6. Представим себе, что взяты в виде кристаллов или белых порошков четыре соли: гексагидрат хлорида алюминия Л1С13*6Н20, карбонат натрия Na2C03, хлорид натрия NaCl и сульфид алюминия Al2S3, и по отдельности растворены в воде. Первые три соли образуют бесцветные растворы, а четвертая — мутную смесь с запахом сероводорода. Эта соль полностью разлагается водой:
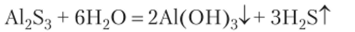
Добавлением лакмуса во все эти растворы обнаруживается, что в них разная среда. В растворе А1С13 pH < 7, в растворе Na2C03 pH > 7, а в растворе NaCl pH = = 7. Соли А1С13 и Na2C03 не претерпели полного разложения водой, но в их растворах установились равновесия обратимого гидролиза, что и привело к изменению реакции среды. Хлорид натрия не повлиял на среду. Эта соль вообще не гидролизуется. Разложившийся сульфид алюминия незначительно повлиял на среду, потому что образовались слабые электролиты.
Обратимый гидролиз характеризуют степенью гидролиза h, т. е. отношением количества или концентрации гидролизованного вещества к соответствующей общей величине:

Катион как частица с недостатком электронов имеет свободные орбитали и проявляет кислотные (акцепторные) свойства. Он может образовать связь с ионом ОН", имеющимся в водном растворе. Связывание этого иона, входящего в состав воды, сопровождается смещением равновесия диссоциации воды вправо и появлением избыточных ионов водорода. В растворе возникает кислая среда:
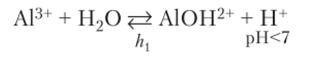
Характер среды указан под ионами водорода, которые определяют среду. Реакция гидролиза может быть написана в молекулярной форме:
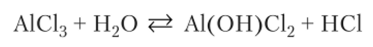
Продуктами первой ступени гидролиза оказались основная соль и сильная кислота. Катион основной соли А10Н2+ гидролизуется далее, но вторая ступень гидролиза уже не оказывает существенного влияния на pH раствора.
Гидролиз А13+ можно представить как протолитическую реакцию, если учесть, что катион гидратирован и его заряд способствует потере протона молекулой воды, связанной с катионом:
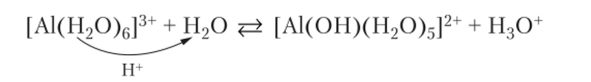
В такой форме уравнение ближе к реальному процессу гидролиза.
При гидролизе хлорида алюминия ион С1″ не реагирует с водой, так как представляет собой остаток сильной кислоты, не образующий молекул НС1 в растворе. Иначе ведет себя анион слабой угольной кислоты в растворе карбоната натрия. Эта отрицательно заряженная частица имеет валентные электронные пары и связывает протон, даваемый молекулой воды. Таким образом, анион ведет себя как основание. Следствием этого оказывается повышение концентрации ОН" и возникновение щелочной среды:
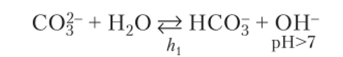
Реакция гидролиза в молекулярной форме:
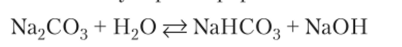
Продукты гидролиза соли слабой многоосновной кислоты — кислая соль и щелочь. По второй ступени гидролиз идет в незначительной степени и практически не влияет на pH раствора:
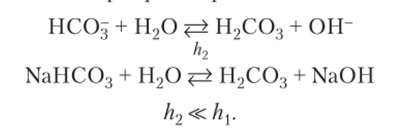
На примере гидролиза карбонат-иона видно, что продукт гидролиза на первой стадии ион НС03" — частица с очень слабыми кислотными свойствами, а на второй стадии — значительно более сильная угольная кислота. Очевидно, что имеется обратное соотношение между силой кислоты и способностью ее анионов к гидролизу: чем сильнее кислота, тем в меньшей степени гидролизуется ее соль при прочих равных условиях.
Соль, образованная сильным основанием и сильной кислотой, не гидролизуется, так как ее ионы не соединяются в растворе с ионами воды. Напротив, соли, состоящие из катионов слабых оснований и анионов слабых кислот, гидролизуются наиболее сильно. В растворе ацетата меди Си (СН3СОО)2 ионы меди связывают ионы ОН", а ацетат-ионы — Н+:
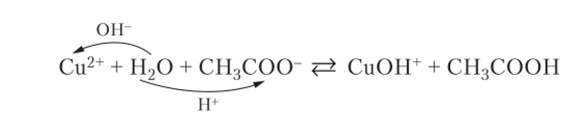
В результате этой реакции в растворе не возникает существенного различия в концентрациях ионов Н~ и ОН-. Среда остается приблизительно нейтральной, но степень гидролиза солей этого типа наиболее велика. Некоторые из них, образованные трехзарядными катионами и анионами слабых газообразных кислот (Al2S3, Fe2(C03)3), полностью разлагаются водой. Сульфид алюминия в твердом состоянии получается соединением простых веществ, а карбонат железа (Ш) в твердом состоянии вообще не известен. При смешивании растворов, содержащих соль железа (1П) и карбонат, образуются углекислый газ и гидроксид железа (Ш) вследствие полного гидролиза:
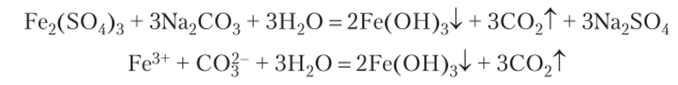
Реакция в ионной форме не отличается от гидролиза карбоната железа (Ш), если бы можно было взять эту соль в кристаллическом состоянии и растворить ее.
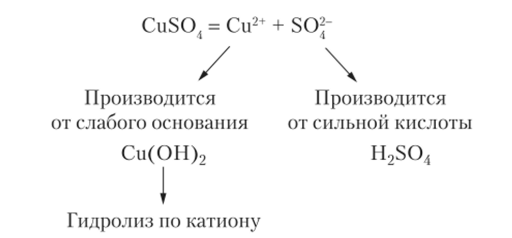
Пример 14.7. Рассмотрим, как написать реакцию гидролиза произвольно взятой соли. Пусть это будет сульфат меди CuS04.
Решение. Сначала определяем тип соли и характер гидролиза:
Пишем реакцию выбранного иона Си2+ с одной молекулой воды и указываем pH: 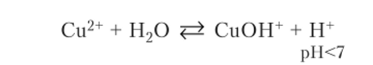
Пишем реакцию в молекулярной форме: