Реакционная и субстратная специфичность

Примерами абсолютной специфичности могут также служить фермент сахароза (инвертаза), расщепляющая только дисахарид сахарозу, мальтоза, действующая лишь на мальтозу, а лактаза — только на лактозу. Указанные выше дисахариды — мальтоза, лактоза и сахароза, хотя и имеют одинаковую эмпирическую формулу С12Н22О11, расщепляются только под влиянием трех различных ферментов, так как различаются… Читать ещё >
Реакционная и субстратная специфичность (реферат, курсовая, диплом, контрольная)
Действие большинства ферментов высокоспецифично. Понятие специфичности относится не только к типам каталитических реакций (реакционная специфичность), но и к природе соединений — субстратов (субстратная специфичность).
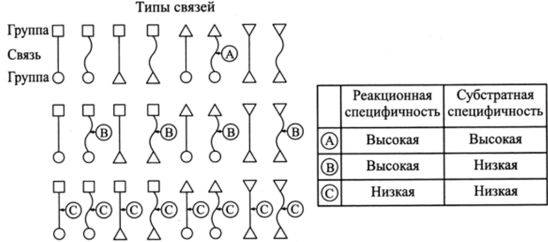
Рис. 4.1. Схемы воздействия ферментов на разные типы связей.
В качестве примера на рис. 4.1 приведены ферменты, расщепляющие химическую связь. Высокоспецифичные ферменты (тип А) катализируют расщепление только одного типа связи в субстратах определенной структуры, ферменты типа В обладают ограниченной реакционной специфичностью, но широкой субстратной специфичностью. Ферменты типа С (с низкой реакционной и субстратной специфичностью) встречаются редко.
Строгой стереоспецифичностью обладают очень многие ферменты. Так, лактатдегидрогеназа специфична к L-лактату, глутачатдегидрогеназа — к L-глутамату, а оксидаза D-аминокислот — к D-аминокислотам.
Различают абсолютную, относительную (групповую) и стереохимическую специфичность. Большинство ферментов обладает абсолютной специфичностью, т. е. ускоряют какую-либо одну реакцию. Среди ферментов, отличающихся абсолютной специфичностью, можно назвать аспартазу, катализирующую обратимое присоединение аминогруппы по двойной связи фумарата, ведущее к образованию L-аспартата:
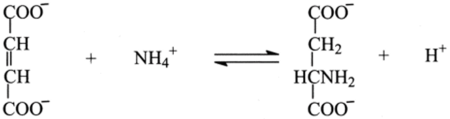
Действие аспартазы строго стереоспецифично: аспартаза не присоединяет аминогруппу ни к метилфумаровой кислоте, ни к эфирам или амидам фумаровой кислоты, ни к монокарбоновым а-, p-ненасыщенным жирным кислотам. Точно так же она не дезаминирует аминомалоновую кислоту, глутамат и различного рода монокарбоновые а-аминокислоты, не дезаминирует Dаспартат и не присоединяет аминогруппу к малеату, представляющему собой цис-изомер фумарата.
Примерами абсолютной специфичности могут также служить фермент сахароза (инвертаза), расщепляющая только дисахарид сахарозу, мальтоза, действующая лишь на мальтозу, а лактаза — только на лактозу. Указанные выше дисахариды — мальтоза, лактоза и сахароза, хотя и имеют одинаковую эмпирическую формулу С12Н22О11, расщепляются только под влиянием трех различных ферментов, так как различаются по структуре и составу входящих в них моносахаридов.
Примером относительной (групповой) специфичности может служить действие фермента пепсина. Этот фермент расщепляет.
самые различные белковые вещества пищи: белки мяса, молока, растений. Попадая в желудок, белковые вещества расщепляются пепсином независимо от качества и количества входящих в них аминокислот благодаря тому, что аминокислоты соединены пептидной связью, которую и расщепляет пепсин. Поэтому действие пепсина относительно специфично.
Примером стереохимической специфичности служат ферменты, расщепляющие какой-либо изомер, а или р; к ним относятся аи fi-гликозидазы.
Термолабильность ферментов и влияние на их действие PH среды
Под термолабильностью ферментов понимают их неустойчивость при высокой температуре. Инактивирование исследуемого раствора при нагревании до 100 °C является одним из доказательств того, что вещество, содержащееся в растворе, является ферментом. Термолабильность фермента обусловлена наличием в его молекуле белковой части (апофермента, апоэнзима).
Активность ферментов зависит от кислотности (pH) среды: одни ферменты способны ускорять химическую реакцию, если среда кислая, другие — если щелочная, третьи — если среда нейтральная. Каждый фермент имеет оптимум pH, при котором он наиболее активен. Так, оптимум pH пепсина — 1,5…2,0, трипсина — 7,0…8,0, амилазы — 6,8…7,2, липазы — 7,0…7,5, тканевой протеазы — 4,7…5,0.
Благодаря тому, что каждый фермент проявляет свое действие при определенном pH, в клетках и тканях организма возможно сохранение строгой последовательности химических превращений различных веществ.