Метаболизм аминокислот и нуклеотидов

Глутаматдегидрогеназа — ключевой фермент дезаминирования, участвующий в окислении многих аминокислот. Она аллостерически ингибируется АТР и GTP (их можно назвать индикаторами высокого уровня энергии: запасов много — «топлива» не нужно) и активируется ADP и GDP (увеличение их содержания говорит о том, что запасы «топлива» иссякают). Однако даже при длительном употреблении пищи, богатой… Читать ещё >
Метаболизм аминокислот и нуклеотидов (реферат, курсовая, диплом, контрольная)
Основным источником аминокислот в организме являются белки пищи. В организме взрослого человека метаболизм азота в целом сбалансирован, т. е. количества поступающего и выделяемого белкового азота примерно равны. Если выделяется только часть вновь поступающего азота, баланс положителен. Это наблюдается, например, при росте организма. Отрицательный баланс встречается редко, главным образом как следствие заболеваний.
ПУТИ И ЭНЕРГЕТИКА МЕТАБОЛИЗМА АМИНОКИСЛОТ В ТКАНЯХ ЖИВОТНЫХ
Метаболизм аминокислот включен в общую схему метаболизма организма (рис. 15.1). Переваривание пищевых белков осуществляется под действием протеолитических ферментов (пептидгидролазы, пептидазы, протеазы) и начинается в желудке, а завершается в тонком кишечнике (табл. 15.1).
Некоторые протеолитические ферменты пищеварительного тракта
Таблица 15.1
Профермент. | Место синтеза. | Место активации и активатор | Расщепляемые пептидные связи. |
Пепсиноген. | Слизистая оболочка желудка. | Полость желудка Отщепление N-концевого пептида от пепсиногена под влиянием НС1 и пепсина. | х-Туг; x-Phe; |
Окончание табл. 15.1
Профермент. | Место синтеза. | Место активации и активатор | Расщепляемые пептидные связи. |
Трипсиноген. | Поджелудочная железа. | Полость тонкой кишки Отщепление N-концевого гексапептида от трипсиногена при участии энтерпептидазы, выделяемой клетками кишечника, с последующим автокатализом под действием трипсина. |
|
Химотрип; синоген. | Поджелудочная железа. | Полость тонкой кишки Активируется под влиянием трипсина. |
|
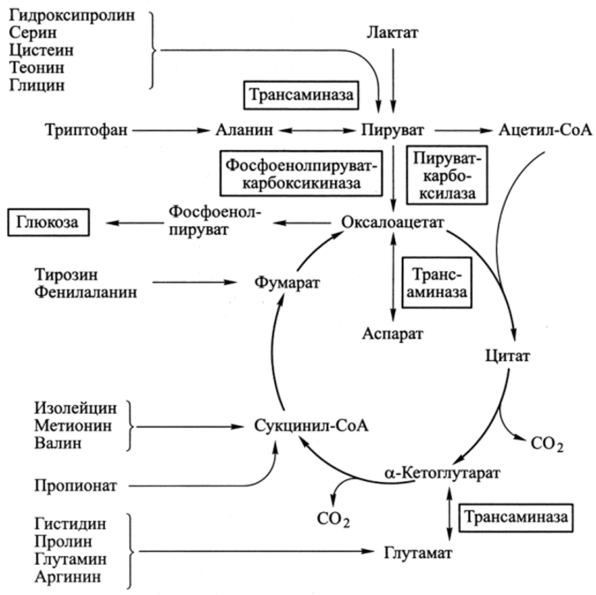
Рис. 15.1. Аминокислоты в общей схеме метаболизма организма
Свободные аминокислоты всасываются, поступают в воротную вену и доставляются кровотоком в печень, в клетках которой включаются в различные пути метаболизма, главным из которых является синтез собственных белков. Катаболизм аминокислот в основном происходит в печени.
Какой-либо специальной формы хранения аминокислот в организме не существует, поэтому резервными для аминокислот веществами служат все функциональные белки, но основными являются белки мышц (их больше всего), однако при их интенсивном использовании, например при глюконеогенезе в печени, наблюдается мышечная атрофия.
Из 20 аминокислот, входящих в состав белков, половину человек получает только из пищевых продуктов. Их называют незаменимыми, так как организм их не синтезирует или их синтез включает особенно много стадий и требует большого числа специализированных ферментов, кодируемых многими генами. Иными словами, их синтез чрезвычайно «дорог» для организма. Абсолютно незаменимыми для человека являются лизин, фенилаланин и триптофан.
Ниже представлена классификация аминокислот по способности организма к их синтезу.
Незаменимые аминокислоты | Заменимые аминокислоты |
Аргинин (нужен только в период роста). | Аланин. |
Г истидин. | Аспаргин. |
Изолейцин. | Аспаргиновая кислота. |
Лейцин. | Цистеин. |
Лизин. | Глутаминовая кислота. |
Метионин. | Глутамин. |
Фенилаланин. | Глицин. |
Треонин. | Пролин. |
Триптофан. | Серин. |
Валин. | Тирозин. |
Результатом недополучения в пищевом рационе хотя бы одной незаменимой аминокислоты является патологическое состояние, называемое квашиоркором. Его проявлениями являются истощение, апатия, недостаточный рост, а также снижение сывороточных белков в крови. Последнее приводит к снижению онкотического давления крови, что является причиной отеков. От квашиоркора особенно страдают дети, так как растущему организму необходимо синтезировать много белков.
Однако даже при длительном употреблении пищи, богатой полноценными белками, организм не может отложить про запас незаменимые аминокислоты. Избыток аминокислот (не использованных в синтезе белка и на другие специфические нужды) расщепляется для производства энергии или создания энергетических запасов (жиров и гликогена).
Основные направления метаболических путей, по которым происходит поступление аминокислот в организм и дальнейшие их превращения в организме, приведены на рис. 15.2.
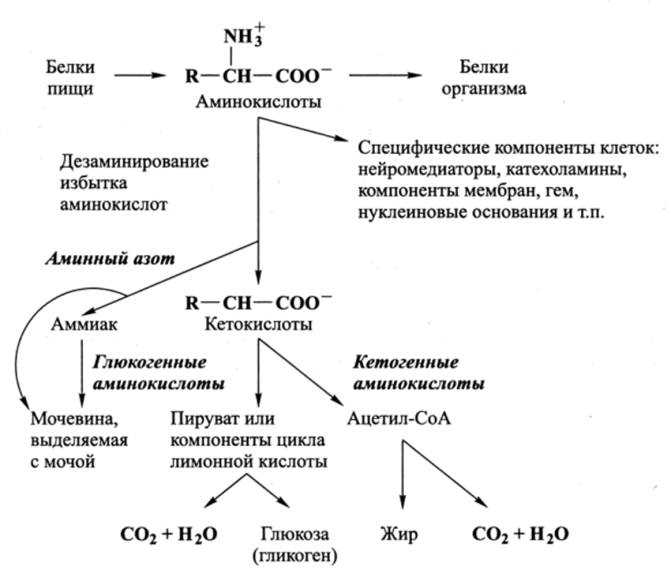
Рис. 15.2. Общая схема метаболизма аминокислот.
Одной из важнейших в метаболизме аминокислот является глутаминовая кислота (глутамат), дезаминирование которой катализируется глутаматдегидрогеназой. Глутамат выступает восстановителем либо NAD+, либо NADP+, причем при физиологических значениях pH группа NH3 протонирована и находится в ионизированной форме (NH/):
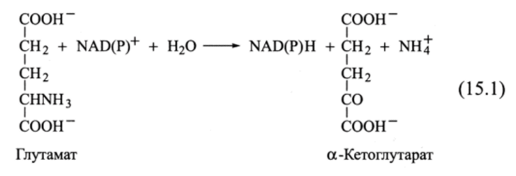
Глутаматдегидрогеназа — ключевой фермент дезаминирования, участвующий в окислении многих аминокислот. Она аллостерически ингибируется АТР и GTP (их можно назвать индикаторами высокого уровня энергии: запасов много — «топлива» не нужно) и активируется ADP и GDP (увеличение их содержания говорит о том, что запасы «топлива» иссякают).
а-Кетогпутарат участвует в цикле лимонной кислоты, что делает возможным, с одной стороны, окисление глутаминовой кислоты (уже после дезаминирования) до Н20 и С02, а с другой стороны, а-кетоглутарат может превращаться в оксалоацетат, что свидетельствует об участии глутаминовой кислоты в синтезе глюкозы. Аминокислоты, которые могут участвовать в синтезе глюкозы, называются глюкогенными.
Для других аминокислот (кетогенных) не имеется соответствующих ферментов — дегидрогеназ. Дезаминирование большинства из них основано на переносе аминогруппы с аминокислоты на а-кетоглутарат, в результате которого образуется соответствующая кетокислота и глутамат, который далее дезаминируется глутаматдегидрогеназой, т. е. процесс протекает в две стадии.
Первая стадия называется трансаминированием, вторая — дезаминированием. Стадия трансаминирования может быть представлена следующим образом:
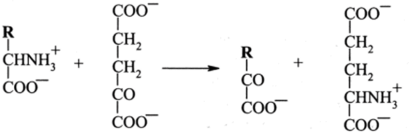
Суммарную реакцию можно представить как.
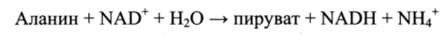
По меньшей мере, у 11 аминокислот (аланина, аргинина, аспаргина, тирозина, лизина, аспаргиновой кислоты, цистеина, лейцина, фенилаланина, триптофана и валина) в результате ферментативной реакции трансаминирования отщепляется а-аминогруппа аминокислоты, которая переносится на а-углеродный атом одной из трех а-кетокислот (пировиноградной, щавелевоуксусной или акетоглутаровой).
Например, для аланина дезаминирование протекает по схеме.
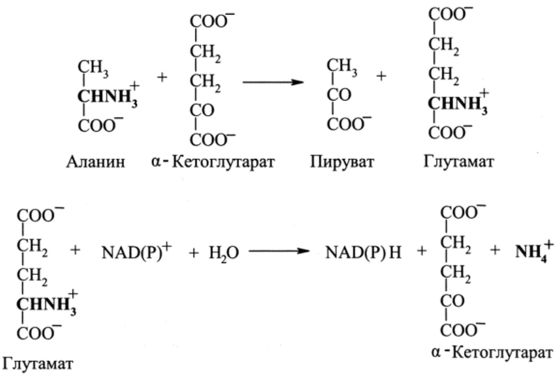
Известны две наиболее важные трансаминазы — аланинтрансаминаза и глутаматтрансаминаза. Реакции, катализируемые трансаминазами, легко обратимы, и их константы равновесия близки к единице.
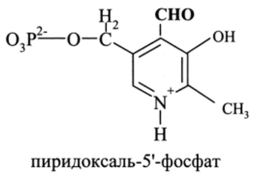
В активных центрах всех трансаминаз имеется кофермент пиридоксаль-5 '-фосфат (ПФ), участвующий во многих ферментатив-ных превращениях аминокислотяы в качестве электрофильного интермедиата:
Активной группой пиридоксаль-5'-фосфата служит альдегидная группаСНО. Функция кофермента в составе фермента (ЕПФ) заключается в том, чтобы сначала принять аминогруппу от аминокислоты (акцептирование), а затем передать ее кетокислоте (донорство) (реакция трансдезаминирования):
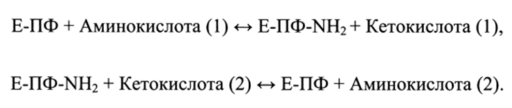
а-Кетоглутарат и глутамат широко участвуют в метаболическом потоке азота, который отражает глутаматный путь трансформации аминокислот.
Рассмотренный путь трансдезаминирования является наиболее общим для аминокислот, однако некоторые из них отдают свою аминогруппу иначе (реакция дезаминирования).
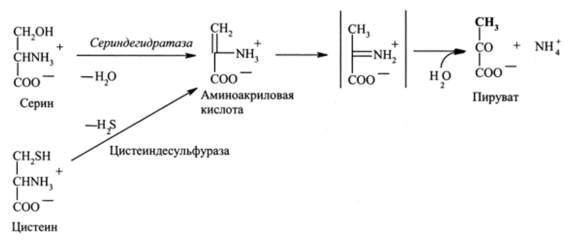
Серин дезаминируется в реакции дегидратации, катализируемой специфической дегидрогеназой.
Цистеин (содержит тиольную группу вместо гидроксильной у серина) дезаминируется после отщепления H2S (процесс идет в бактериях). В обеих реакциях продуктом является пируват:
Гистидин дезаминируется с образованием уроканиновой кислоты, которая в серии последующих реакций превращается в аммиак, С |-фрагмент, присоединенный к тетрагидрофолиевой кислоте, и глутаминовую кислоту.
Физиологически важный путь превращений гистидина связан с его декарбоксилированием и образованием гистамина:
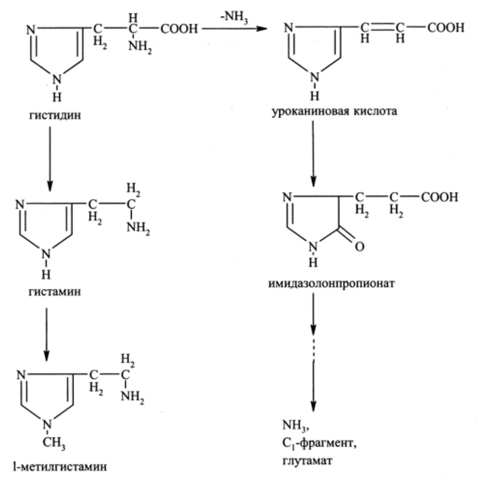
Дезаминирование гистидина катализируется гистидазой, содержащейся в печени и в коже; уроканиновая кислота превращается в имидазолонпропионовую кислоту при действии уроканиназы, которая содержится только в печени. Оба эти фермента появляются в крови при заболеваниях печени, и измерение их активности используется для диагностики.