Второй закон термодинамики

Для формулировки второго закона термодинамики необходимо ввести понятия обратимого и необратимого процессов. Термодинамически обратимым процесс называется тогда, когда при переходе из начального состояния в конечное все промежуточные состояния оказываются равновесными. Соответственно процесс называется термодинамически необратимым, если хоть одно промежуточное состояние неравновесно. Обратимый… Читать ещё >
Второй закон термодинамики (реферат, курсовая, диплом, контрольная)
Организм совершает работу, затрачивая внутреннюю энергию, запасенную в виде энергии химического взаимодействия составляющих его веществ. Наиболее общим методом экспериментального определения эффективности затрат внутренней энергии организмом являются калориметрические измерения, применяемые физиологами. Теоретические оценки затрат осуществляются на основе второго закона термодинамики. Этот закон накладывает строгие ограничения на эффективность преобразования энергии в работу и, кроме того, позволяет ввести критерии возможности самопроизвольного протекания того или иного процесса. Процесс называется самопроизвольным, если он осуществляется без какихлибо воздействий извне.
Для формулировки второго закона термодинамики необходимо ввести понятия обратимого и необратимого процессов. Термодинамически обратимым процесс называется тогда, когда при переходе из начального состояния в конечное все промежуточные состояния оказываются равновесными. Соответственно процесс называется термодинамически необратимым, если хоть одно промежуточное состояние неравновесно.
Обратимый процесс можно осуществить лишь при достаточно медленном изменении параметров системы. Скорость изменения параметров должна быть такой, чтобы возникающие в ходе процесса отклонения от равновесия были пренебрежимо малы. Обратимые процессы являются предельным случаем реальных процессов, происходящих в природе и осуществляемых в промышленных условиях и лабораториях.
Максимальная работа Wmax, которая может быть получена при данной убыли внутренней энергии (АЕ) в процессе перехода из начального состояния в конечное, достигается лишь в том случае, если этот процесс обратимый. В соответствии с (11.1) при этом выделяется минимальная теплота Qml":

Максимально достижимый коэффициент полезного действия, характеризующий эффективность затрат внутренней энергии системы, можно представить следующим образом:
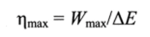
или, учитывая (11.5),.
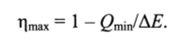
Величину Qmi" определяют на основе второго закона термодинамики с помощью термодинамической функции состояния, называемой энтропией. Понятие энтропия ввел немецкий физик Клаузиус.
Энтропия представляет собой функцию состояния, приращение которой AS равно теплоте Qmm, подведенной к системе в обратимом изотермическом процессе, деленной на абсолютную температуру Т, при которой осуществляется процесс:
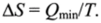
Из приведенного уравнения следует, что если известна теплота Qmin, подводимая к системе или отводимая от нее при протекании в изотермических условиях какого-либо физического или химического процесса, можно рассчитать изменение энтропии при этом процессе. Эта теплота может быть определена с помощью калориметрических измерений. Таким образом, изменение энтропии, так же как и двух других функций состояния системы — внутренней энергии и энтальпии, представляет собой экспериментально определяемую величину.
Физический смысл энтропии становится ясным при рассмотрении с молекулярно-кинетической точки зрения процессов, протекающих в изолированных системах. Изучение различных изолированных систем показывает, что самопроизвольные процессы всегда связаны с ростом числа микросостояний системы, названных термодинамической вероятностью и Энтропия является мерой разупорядоченности системы и равна числу способов (микросостояний), которыми можно реализовать данное макросостояние системы при данной энергии. Австрийским физиком Больцманом понятие энтропии было определено как.
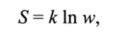
где к — постоянная Больцмана, равная 1,38−1 (Г23Дж/К.
Уравнение Больцмана позволяет рассчитать энтропию системы по числу возможных ее микросостояний.
Оказывается, что в изолированной системе самопроизвольно могут идти только такие процессы, при которых энтропия увеличивается (AS > 0); в состоянии равновесия энтропия постоянна (AS = 0).
Для неизолированных (закрытых и открытых) систем изменение энтропии, как и изменение внутренней энергии, уже не является критерием самопроизвольности.
Как уже упоминалось ранее, биообъекты с точки зрения термодинамики всегда являются открытыми системами, в которых р = const; Т= const, Xj = const (xj — содержание различных веществ), т. е. процессы протекают в изобарно-изотермических условиях.
Критерием направленности самопроизвольного процесса для открытых и закрытых систем является функция состояния системы — термодинамический потенциал, носящий название энергии Гиббса (G).
Изменение энергии Гиббса связано с термодинамическими функциями системы Я и 5 уравнением:
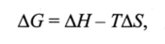
где АН — приращение энтальпии; AS — приращение энтропии; Т — абсолютная температура.
В литературе по биологии величину AG выражают в калориях, в других областях науки более распространено выражение ее в джоулях (1 кал = 4,184 Дж).
Таким образом, второй закон термодинамики можно сформулировать следующим образом: в изобарно-изотермических условиях в системе самопроизвольно могут осуществляться только те процессы, в результате которых энергия Гиббса системы уменьшается. В состоянии равновесия энергия Гиббса не изменяется:
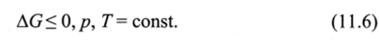
Исходя из выражений (11.1 и 11.6) для первого и второго законов термодинамики следует, что.
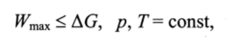
т. е. работа, совершаемая системой в изобарно-изотермических условиях, меньше или равна убыли энергии Гиббса (A G) этой системы.
Применительно к биологии полезная работа — это мышечное сокращение, химический синтез в клетке, преодоление осмотических и электрических сил. Приращение энергии Гиббса в ходе любого процесса — важнейший термодинамический параметр. Для химических процессов можно сформулировать следующее общее правило: химическая реакция протекает лишь в том случае, когда AG < 0, т. е. когда энергия Гиббса продуктов реакции меньше, чем исходных веществ.