Задачи для расчетной работы

Перерисуйте нужную вам диаграмму плавкости (табл. 5.18, рис. 5.30−5.41), укажите все области и характерные точки на этой диаграмме. Проанализируйте процесс охлаждения системы первоначального состава ф,. Изобразите кривые охлаждения системы составов ф2, ф'2, ф" и ф" ' от температуры, при которой системы в жидком состоянии до температуры, при которой в системе твердое состояние. Поясните, что… Читать ещё >
Задачи для расчетной работы (реферат, курсовая, диплом, контрольная)
Задачи 5.1.1−5.1.20
Для равновесия «твердое вещество А — насыщенный пар вещества А» известны значения давлений насыщенного пара pt и р2 при температурах системы соответственно Т и Тг (табл. 5.3). Определите величину мольной энтальпии сублимации вещества А.
Таблица 5.3
Данные для задач 5.1.1−5.1 20
№ задачи. | Вещество А | Па. | Г, К. | р2, Па. | Т, К. |
5.1.1. | Муравьиная кислота. | 1,413. | 2,372. | ||
5.1.2. | Ацетон. | ||||
5.1.3. | Циклогексан. | ||||
5.1.4. | Четыреххлористый углерод. | ||||
5.1.5. | Муравьиная кислота. | 1,706. | 2,372. | ||
5.1.6. | Ацетон. | ||||
5.1.7. | Циклогексан. | ||||
5.1.8. | Четыреххлориетый углерод. | ||||
5.1.9. | Метанол. | ||||
5.1.10. | Муравьиная кислота. | 1,879. | 2,372. | ||
5.1.11. | Ацетон. | ||||
5.1.12. | Циклогексан. | ||||
5.1.13. | Четыреххлористый углерод. | ||||
5.1.14. | Метанол. | ||||
5.1.15. | Муравьиная кислота. | 2,066. | 2,372. | ||
5.1.16. | Ацетон. | ||||
5.1.17. | Циклогексан. | ||||
5.1.18. | Четыреххлористый углерод. | ||||
5.1.19. | Метанол. | ||||
5.1.20. | Метанол. |
Задачи 5.2.1−5.2.20
Таблица 5.4
№ задачи. | Условие задачи. |
5.2.1. | Удельная теплота испарения амилового спирта С5НпОН при температуре кипения 138 °C и давлении 1,013 • 105 Па равна 592 кДж/кг. Определить давление при 140 °C. |
5.2.2. | Под каким давлением будет кипеть диэтиламин при 20 °C, если его нормальная температура кипения 58 °C, а теплота парообразования 27,844 кДж/моль? |
5.2.3. | Температура кипения жидкого метанола при 0,267 • 105 Па равна 34,7 °С, а при давлении 0,533 • 105 Па равна 49,9 °С. Вычислить температуру кипения при нормальном давлении. |
5.2.4. | Давление пара этанола при температурах 70 °C и 80 °C соответственно равно 0,750 • 10 5 Па и 1,082 • 105 Па. Рассчитать удельную теплоту испарения. |
5.2.5. | Давление пара бензола при температурах 20 °C и 30 °C соответственно равно 0,1 • 10s Па и 0,157 • 105 Па. Рассчитать мольную теплоту испарения. |
5.2.6. | Температура кипения бутанола под давлением 1,013 • 105 Па равна 117,8 °С и удельная теплота испарения 591,2 кДж/кг. Какая температура кипения бутанола при давлении 1,000 • 105 Па? |
5.2.7. | Удельная теплота испарения диэтилового эфира 360,2 кДж/кг при температуре кипения 34,66 °С под давлением 1,013 • 105 Па. Определить давление пара при 36,5 °С. |
5.2.8. | Давление пара СС14 равно 0,828 • 105 Па при 70 °C и 1,122 • 105 Па при 80 °C. Рассчитать мольную теплоту испарения четыреххлористого углерода. |
5.2.9. | Давление пара этиламина при 5,8 °С и 162 °C соответственно равно 0,642 • 10s Па и 1,000 • 105 Па. Рассчитать мольную теплоту испарения этиламина. |
5.2.10. | Давление пара четыреххлористого углерода 0,828 105 Па при 70 °C, теплота испарения 1 кмоль СС14 30 781,688 кДж/кмоль. Рассчитать нормальную температуру кипения. |
Данные для задач 5.2.1−5.2.20
№ задачи. | Условие задачи. |
5.2.11. | Определить давление насыщенного пара четыреххлористого углерода при 60 °C, если СС14 кипит при 75 °C и 1,013 105 Па и мольная теплота парообразования равна 30 833 Дж/моль. |
5.2.12. | Давление пара этилового эфира при 0 °C равно 0,246 • 105 Па, а при 10 °C 0,3 83 1 05 Па. Определить мольную теплоту испарения этилового эфира. |
5.2.13. | Давление пара этилового эфира при 20 °C равно 0,577 • 105 Па, а при 30 °C 0,846 • 105 Па. Определить мольную теплоту испарения этилового эфира. |
5.2.14. | Давление пара этилового эфира при 10 °C равно 0,382 • 10 5 Па, а при 20 °C 0,577 • 105 Па. Определить мольную теплоту испарения этилового эфира. |
5.2.15. | Определить нормальную температуру кипения этилового эфира, если давление его паров при 30 °C равно 0,846 • 105 Па, а мольная теплота испарения 28 367,52 Дж/моль. |
5.2.16. | Давление пара хлороформа при 50 °C равно 0,713 • 105 Па, мольная теплота испарения хлороформа 30 836 Дж/моль. Определить нормальную температуру кипения хлороформа. |
5.2.17. | Давление пара хлороформа при 20 °C равно 0,215 • 105 Па, а при 30 °C 0,331 • 105 Па. Определить мольную теплоту испарения хлороформа. |
5.2.18. | Давление пара хлороформа при 30 °C равно 0,331 • 10- Па, а при 40 °C равно 0,492 10 5 Па. Рассчитать мольную теплоту испарения хлороформа. |
5.2.19. | Давление пара хлороформа при 40 °C равно 0,492 • 105 Па, а при 50 °C равно 0,713 • 105 Па. Вычислить мольную теплоту испарения хлороформа. |
5.2.20. | Давление пара эгиламина при -5,6 °С и +5,8 °С соответственно равно 0,376 • 10* Па и 0,641 • 105 Па. Определить мольную теплоту испарения этиламина. |
По известным значениям давлений насыщенного пара над жидким веществом A ру и р2 при температурах Г, и Т2 (табл. 5.5) определите величину мольной энтальпии испарения вещества/!.
Данные для задач 5.3.1.-5.3.20
Таблица 5.5
№ задачи. | Вещество А | р, Па. | Г, К. | Р2, Па. | Г, К. |
5.3.1. | Муравьиная кислота. | ||||
5.3.2. | Ацетон. | ||||
5.3.3. | Вода. | ||||
5.3.4. | Тетрахлорметан. | ||||
5.3.5. | Метанол. | ||||
5.3.6. | Муравьиная кислота. | ||||
5.3.7. | Ацетон. | ||||
5.3.8. | Циклогексан. | 6931,6. | 285,2. | 7731,4. | 287,5. |
5.3.9. | Тетрахлорметан. | ||||
5.3.10. | Метанол. | ||||
5.3.11. | Муравьиная кислота. | ||||
5.3.12. | Ацетон. | ||||
5.3.13. | Циклогексан. | 6198,6. | 382,3. | 7731,4. | 287,5. |
5.3.14. | Тетрахлорметан. | 253,2. | |||
5.3.15. | Метанол. | ||||
5.3.16. | Муравьиная кислота. | 281,4. | |||
5.3.17. | Ацетон. | ||||
5.3.18. | Циклогексан. | 5798,6. | 7731,4. | 287,5. | |
5.3.19. | Вода. | ||||
5.3.20. | Метанол. |
При температуре тройной точки для вещества А известны мольные энтальпии испарения Ай0,исп и возгонки Дйово'г, а также плотности масс твердого ротв и жидкого рож вещества. Нормальная температура плавления вещества А равна Т. Полагая, что мольная энтальпия плавления и температурный коэффициент dp/dT постоянны, определите температуру плавления вещества при давлении р (табл. 5.6).
Таблица 5.6
Данные для задач 5.4.1−5.4.20
№ задачи. | Л | ДЛОИСП,. кДж/моль. | А Л°", кДж/моль. | р°.™. кг/м3 | Р°‘ж,. кг/м3 | Г, К. | Р- ю— Па. |
5.4.1. | Zn. | 121,4. | 128,4. | 692,6. | |||
5.4.2. | Си. | 320,9. | 333,9. | ||||
5.4.3. | Ag. | 255,4. | 266,7. | ||||
5.4.4. | К. | 87,7. | 89,9. | 336,7. | |||
5.4.5. | Bi. | 174,2. | 185,0. | 544,5. | |||
5.4.6. | KF. | 180,4. | 206,8. | ||||
5.4.7. | I,. | 45,3. | 60,8. | 386,7. | |||
5.4.8. | Вг,. | 32,2. | 42,7. | ||||
5.4.9. | СН3СООН. | 29,7. | 41,2. | 289,8. | |||
5.4.10. | NH,. | 24,1. | 31,8. | 195,5. | |||
5.4.11. | Zn. | 121,4. | 128,4. | 692,6. | |||
5.4.12. | Си. | 320,9. | 333,9. | ||||
5.4.13. | Ag. | 255,4. | 266,7. | ||||
5.4.14. | К. | 87,7. | 89,9. | 336,7. | |||
5.4.15. | Bi. | 174,2. | 185,0. | 544,5. | |||
5.4.16. | KF. | 180,4. | 206,8. | ||||
5.4.17. | 12 | 45,3. | 60,8. | 386,7. | |||
5.4.18. | Вг2 | 32,2. | 42,7. | ||||
5.4.19. | СН^СООН. | 29,7. | 41,2. | 289,8. | |||
5.4.20. | NH,. | 24,1. | 31,8. | 195,5. |
Задачи 5.5.1−5.5.20
Дана зависимость давлений насыщенного пара над твердым и жидким веществами мольной массы М (табл. 5.7). Определите координаты тройной точки, значения мольных энтальпий возгонки и испарения этого вещества. Определите теплоту плавления вещества, располагая данными о плотностях массы вещества в твердом ротв и жидком р°'ж состояниях при температуре тройной точки. Вычислите мольные энтропию и энергию Гиббса плавления вещества.
Данные для задач 5.5.1−5.5.20
Таблица 5.7.
№. задачи. | Условия. | Давление насыщенного пара над твердым и жидким веществами при разных температурах. | ||||||
5.5.1. | М = 0,046 кг/моль р°.Тв — 1240 кг/м3 р°.ж = 1290 кг/м3 | Над твердым веществом. | Г, К. | |||||
Р, Па. | ||||||||
Над жидким веществом. | Г, К. | |||||||
р, Па. | ||||||||
5.5.2. | М— 0,058 кг/моль ро. г" = 822 кг/м3 ро ж = 812 кг/м3 | Над твердым веществом. | Г, К. | |||||
Р, Па. | ||||||||
Над жидким веществом. | Г, К. | |||||||
Р, Па. | ||||||||
5.5.3. | М = 0,064 кг/моль ро гв = 1600 кг/м3 р°* =1560 кг/м3 | Над твердым веществом. | Г, К. | |||||
Р, Па. | ||||||||
Над жидким веществом. | Г, к. | |||||||
ру Па. | ||||||||
5.5.4. | М = 0,032 кг/моль ро. тв = 837 кг/м3 ро. ж _ 825 кг/м3 | Над твердым веществом. | Г, К. | |||||
Р, Па. | 694,5. | |||||||
Над жидким веществом. | Г, К. | |||||||
Р, Па. | ||||||||
№. задачи. | Условия. | Давление насыщенного пара над твердым и жидким веществами при разных температурах. | ||||||
5.5.5. | М = 0,034 кг/моль рол" =1010 кг/м3 рож = 980 кг/м3 | Над твердым веществом. | Г, К. | |||||
Р. Па. | ||||||||
Над жидким веществом. | Г, К. | |||||||
р, Па. | ||||||||
5.5.6. | М = 0,081 кг/моль р°'тв = 1625 кг/м3 р°.ж =1610 кг/м3 | Над твердым веществом. | Г, К. | 185,5. | ||||
Р, Па. | ||||||||
Над жидким веществом. | Г, К. | |||||||
Р, Па. | ||||||||
5.5.7. | М = 0,084 кг/моль ролв = 796 кг/м3 р°.ж = 788 кг/м3 | Над твердым веществом. | Г, К. | |||||
р, Па. | ||||||||
Над жидким веществом. | Г, К. | |||||||
р, Па. | ||||||||
5.5.8. | М= 0,127 кг/моль ротв = 2970 кг/м3 р°.ж = 2850 кг/м3 | Над твердым веществом. | Г, К. | |||||
Р. Па. | ||||||||
Над жидким веществом. | Г, К. | |||||||
Р, Па. | ||||||||
5.5.9. | М= 0,122 кг/моль ро.тв =цо5 кг/м3 ро.* =Ю95 кг/м3 | Над твердым веществом. | Г, К. | |||||
Р, Па. | ||||||||
Над жидким веществом. | Г, К. | |||||||
р, Па. | ||||||||
5.5.10. | М= 0,152 кг/моль ролв =985 КГ/М3. ро, ж _ 977 кг/мз. | Над твердым веществом. | Г, К. | |||||
р, Па. | ||||||||
Над жидким веществом. | Г, К. | |||||||
Р* Па. | ||||||||
№. задачи. | Условия. | Давление насыщенного пара над твердым и жидким веществами при разных температурах. | ||||||
5.5.11. | М= 0,027 кг/моль ре.™ = 718 кг/м3 р°.ж = 709 кг/м3 | Над твердым веществом. | Г, К. | |||||
Р, Па. | ||||||||
Над жидким веществом. | Г, к. | |||||||
р, Па. | ||||||||
5.5.12. | М= 0,030 кг/моль ро. тв = 1272 кг/м3 ро ж = 1260 кг/м3 | Над твердым веществом. | Г, К. | ПО. | ||||
Р, Па. | ||||||||
Над жидким веществом. | Г, К. | |||||||
р, Па. | ||||||||
5.5.13. | М = 0,018 кг/моль ролв = 918 кг/м3 ро. ж = | ооо кг/м3 | Над твердым веществом. | Г, К. | |||||
р, Па. | ||||||||
Над жидким веществом. | Г, К. | |||||||
Р, Па. | ||||||||
5.5.14. | М = 0,0835 кг/моль po rR = 3330 кг/м3 ро. ж = 2150 кг/м3 | Над твердым веществом. | Г, К. | 115,6. | ||||
Р, Па. | ||||||||
Над жидким веществом. | Г, К. | |||||||
р, Па. | ||||||||
5.5.15. | М= 0,1275 кг/моль ротв =1145 кг/м3 ро ж = 982 кг/м3 | Над твердым веществом. | Г, К. | |||||
Р, Па. | ||||||||
Над жидким веществом. | Г, к. | |||||||
р, Па. | ||||||||
5.5.16. | М = 0,154 кг/моль р°.гв = 15зо кг/м3 ро. ж — 1550 Кг/м3 | Над твердым веществом. | Г, К. | |||||
Р, Па. | ||||||||
Над жидким веществом. | Г, К. | |||||||
р, Па. | ||||||||
№ задачи | Условия | Давление насыщенного пара над твердым и жидким веществами при разных температурах | ||||||
5.5.17 | М = 0,174 кг/моль р°лв — 954 кг/мз р°.ж = 94g кг/мз. | Над твердым веществом | Г, К | |||||
Р, Па | ||||||||
Над жидким веществом | Г, К | |||||||
р, Па | ||||||||
5.5.18 | М = 0,254 кг/моль рогв = З960кг/м3 р°*ж = 3900 кг/м3 | Над твердым веществом | Г, К | |||||
Р, Па | ||||||||
Над жидким веществом | Г, К | |||||||
Р, Па | ||||||||
5.5.19 | М = 0,052 кг/моль ро тв = 3010 кг/м3 рож = 2955 кг/м3 | Над твердым веществом | Г, К | |||||
р, Па | ||||||||
Над жидким веществом | Г, К | |||||||
р- Па | 0,834 | 0,860 | 0,969 | 1,00. | 1,04 | |||
5.5.20 | М = 0,044 кг/моль ро тв = 1542 кг/м3 ро, ж =i5]Q кг/м3 | Над твердым веществом | Г, К | |||||
рЮ-5, Па | 0,5 | 0,92 | 1,7 | 4,02 | 6,5 | |||
Над жидким веществом | Г, К | |||||||
рл о-; Па | 6,5 | 7,5 | 8,2. | 9,1 | 10,16 | |||
При температуре Т давление насыщенного пара над чистой водой равно р. Рассчитать и выразить в Па давление насыщенного пара при той же температуре над раствором, содержащим т{ г воды и /и, г вещества А (табл. 5.8). Раствор можно считать идеальным.
Данные для задач 5.6.1−5.6.20
Таблица 5.8
№ задачи. | Вещество А | Г, К. | /7, ММ рт. СТ. | т, г. | т2, г. |
5.6.1. | Глюкоза С9Н|209 | 23,75. | |||
5.6.2. | Мочевина (NH,), CO. | 23,75. | |||
5.6.3. | Тиомочевина CH4N, S. | 23,75. | |||
5.6.4. | Глюкоза С9Н|209 | 17,53. | |||
5.6.5. | Мочевина (NH,), CO. | 17,53. | |||
5.6.6. | Тиомочевина CH4N, S. | 17,53. | |||
5.6.7. | Глюкоза С9Н|209 | 12,78. | |||
5.6.8. | Мочевина (NH,), CO. | 12,78. | |||
5.6.9. | Тиомочевина CH4N, S. | 12,78. | |||
5.6.10. | Глюкоза С9Н|209 | 23,75. | ПО. | ||
5.6.11. | Мочевина (NH,), CO. | 23,75. | ПО. | ||
5.6.12. | Тиомочевина CH4N, S. | 23,75. | ПО. | ||
5.6.13. | Глюкоза С9Н|209 | 17,53. | ПО. | ||
5.6.14. | Мочевина (NH,), CO. | 17,53. | ПО. | ||
5.6.15. | Тиомочевина CH4N, S. | 17,53. | ПО. | ||
5.6.16. | Глюкоза С9Н|209 | 12,78. | ПО. | ||
5.6.17. | Мочевина (N11,), СО. | 12,78. | ПО. | ||
5.6.18. | Тиомочевина CH4N, S. | 12,78. | ПО. | ||
5.6.19. | Глюкоза С9Н|209 | 23,75. | |||
5.6.20. | Мочевина (N11,), СО. | 23,75. |
При давлении 1,013? 105 Па определить температуру кипения раствора нелетучего вещества (2-й компонент) с мольной долей N* в веществе А (растворитель или 1-й компонент раствора). Температура кипения чистого вещества А равна 7J°, а его мольная энтальпия испарения равна АЛ,°, ИСП (табл. 5.9).
Данные для задач 5.7.1−5.7.20
Таблица 5.9
№ задачи. | Вещество А | т;, к. | Д/71°', сп, кДж/моль. | N* |
5.7.1. | С8Н)0 /7-КСИЛОЛ. | 411,5. | 36,01. | 0,01. |
5.7.2 | СН О метанол. | 337,77. | 35,29. | 0,01. |
5.7.3. | С3Н60 ацетон. | 329,28. | 29,107. | 0,01. |
5.7.4. | CSH10 о-ксилол. | 417,56. | 36,84. | 0,01. |
5.7.5. | С8Н1(|л/-ксилол. | 412,23. | 36,38. | 0,01. |
5.7.6. | С.Н.О этанол. 2 6. | 351,47. | 39,3. | 0,01. |
5.7.7. | С^Н80 пропанол. | 370,35. | 41,248. | 0,01. |
5.7.8. | С4Н1(|0 бутанол. | 390,83. | 43,17. | 0,01. |
5.7.9. | С.Нр пентан. | 309,22. | 25,797. | 0,01. |
5.7.10. | CJHL гексан. | 341,89. | 24,872. | 0,01. |
5.7.11. | С8Н1(| /7-КСИЛОЛ. | 411,5. | 36,01. | 0,02. |
5.7.12. | СН, 0 метанол. | 337,77. | 35,29. | 0,02. |
5.7.13. | С^Н60 ацетон. | 329,28. | 29,107. | 0,02. |
5.7.14. | С8Н)(1 0-ксилол. | 417,56. | 36,84. | 0,02. |
5.7.15. | С8Н10 л/-ксилол. | 412,23. | 36,38. | 0,02. |
5.7.16. | С2Н60 этанол. | 351,47. | 39,3. | 0,02. |
5.7.17. | С, Н80 пропанол. | 370,35. | 41,248. | 0,02. |
5.7.18. | С4Н10О бутанол. | 390,83. | 43,17. | 0,02. |
5.7.19. | С5Нр пентан. | 309,22. | 25,797. | 0,02. |
5.7.20. | СН, гексан. 6 14. | 341,89. | 24,872. | 0,02. |
Задачи 5.8.1−5.8.20
На основании экспериментальных данных (табл. 5.10) о парциальных давлениях паров над системой (ргр2) постройте график зависимости парциальных и общего давления (р) над системой от мольной доли 2-го компонента N2Ж. Определите, имеются ли отклонения от закона Рауля (положительные или отрицательные, существенные или незначительные) и вычислите коэффициенты активности каждого компонента раствора при следующих составах N* = 0,3; 0,5; 0,7.
Данные для задач 5.8.1−5.8.20
Таблица 5.10
№ задачи. | Данные для построения графических зависимостей. | ||||||
5.8.1. | Система «вода (1-й компонент) — метанол (2-й компонент)». | ||||||
ЛГ*. | 0,2. | 0,4. | 0,6. | 0,8. | |||
рх • КГ4, Па. | 0,316. | 0,273. | 0,207. | 0,147. | 0,087. | 0,000. | |
р2 • ЮЛ Па. | 0,000. | 0,453. | 0,813. | 1,120. | 1,400. | 1,687. | |
5.8.2. | Система «вода (1-й компонент) — ацетон (2-й компонент)». | ||||||
ЛГ*. | 0,2. | 0,4. | 0,6. | 0,8. | |||
рх • ЮЛ Па. | 0,316. | 0,267. | 0,253. | 0,220. | 0,149. | 0,000. | |
р2- 10 Па. | 0,000. | 1,879. | 2,253. | 2,479. | 2,706. | 3,056. | |
5.8.3. | Система «хлороформ (1-й компонент) — ацетон (2-й компонент)». | ||||||
N2 | 0,2. | 0,4. | 0,6. | 0,8. | |||
/?, • Ю4, Па. | 0,56. | 1,36. | 2,44. | 3,6. | 4,586. | ||
р2- ЮЛ Па. | 3,906. | 1,973. | 1,093. | 0,453. | |||
5.8.4. | Система «вода (1 -й компонент) — 1,4-диоксан (2-й компонент)». | ||||||
N* | 0,2. | 0,4. | 0,6. | 0,8. | |||
рх • ЮЛ Па. | 0,316. | 0,287. | 0,260. | 0,231. | 0,189. | 0,000. | |
р2- ЮЛ Па. | 0,000. | 0,287. | 0,369. | 0,407. | 0,441. | 0,492. | |
5.8.5. | Система «этанол (1-й компонент) — бензол (2-й компонент)». | ||||||
N* | 0,2. | 0,4. | 0,6. | 0,8. | |||
р, • 10 Па. | 0,596. | 0,500. | 0,447. | 0,407. | 0,343. | 0,000. | |
рг — 10 4, Па. | 0,000. | 0,600. | 0,806. | 0,897. | 0,949. | 0,990. | |
5.8.6. | Система «ацетон (1-й компонент) — диэтиловый эфир (2-й компонент)». | ||||||
N* | 0,2. | 0,4. | 0,6. | 0,8. | |||
р, • 10 4, Па. | 3,769. | 3,132. | 2,533. | 1,933. | 1,200. | 0,000. | |
р2— 10 4, Па. | 0,000. | 2,666. | 4,399. | 5,838. | 7,131. | 8,611. | |
5.8.7. | Система «хлороформ (1-й компонент) — диэтиловый эфир (2-й компонент)». | ||||||
К | 0,2. | 0,4. | 0,6. | 0,8. | |||
р, • 10 Па. | 1,933. | 1,48. | 0,92. | 0,46. | 0,165. | ||
р2— 10 4, Па. | 0,46. | 1,287. | 2,666. | 4,093. | 5,333. | ||
5.8.8. | Система «диэтиловый эфир (1-й компонент) — хлороформ (2-й компонент)». | ||||||
К | 0,2. | 0,4. | 0,6. | 0,8. | |||
р, • 10 Па. | 0,165. | 0,46. | 0,92. | 1,48. | 1,933. | ||
р2— 10 4, Па. | 5,333. | 4,093. | 2,666. | 1,287. | 0,46. | ||
5.8.9. | Система «ацетон (1-й компонент) — сероуглерод (2-й компонент)». | ||||||
N* | 0,2. | 0,4. | 0,6. | 0,8. | |||
р, • 10 4, На. | 4,586. | 3,866. | 3,4. | 3,066. | 2,533. | ||
р2— 10 4, Па. | 3,733. | 5,04. | 5,666. | 6,133. | 6,826. | ||
5.8.10. | Система «ацетон (1-й компонент) — хлороформ (2-й компонент)». | ||||||
т | 0,2. | 0,4. | 0,6. | 0,8. | |||
р, • 10 4, Па. | 4,586. | 3,6. | 2,44. | 1,36. | 0,56. | ||
р2 • 10 4, Па. | 0,453. | 1,093. | 1,973. | 3,906. | |||
5.8.11. | Система «ацетон (1-й компонент) — сероуглерод (2-й компонент)». | ||||||
N* | 0,2. | 0,4. | 0,6. | 0,8. | |||
р, • 10 4, Па. | 4,586. | 3,866. | 3,4. | 3,066. | 2,533. | ||
р2 ? 10 Па. | 3,733. | 5,04. | 5,666. | 6,133. | 6,826. | ||
5.8.12. | Система «ацетон (1-й компонент) — хлороформ (2-й компонент)». | ||||||
N? | 0,2. | 0,4. | 0,6. | 0,8. | |||
р( • 10 4, Па. | 4,586. | 3,6. | 2,44. | 1,36. | 0,56. | ||
р2 ? 10 4, Па. | 0,453. | 1,093. | 1,973. | 3,906. | |||
5.8.13. | Система «хлороформ (1-й компонент) — ацетон (2-й компонент)». | ||||||
Л? | 0,2. | 0,4. | 0,6. | 0,8. | |||
р, ? 10 4, Па. | 0,56. | 1,36. | 2,44. | 3,6. | 4,586. | ||
р, • 10 4, Па. | 3,906. | 1,973. | 1,093. | 0,453. | |||
5.8.14. | Система «диэтиловый эфир (1-й компонент) — ацетон (2-й компонент)». | ||||||
N* | 0,2. | 0,4. | 0,6. | 0,8. | |||
р, • 10 4, Па. | 8,611. | 7,131. | 5,838. | 4,399. | 2,666. | 0,000. | |
р2 • КГ4, Па. | 0,000. | 1,200. | 1,933. | 2,533. | 3,132. | 3,769. | |
5.8.15. | Система «бензол (1 -й компонент) — этанол (2-й компонент)». | ||||||
N* | 0,2. | 0,4. | 0,6. | 0,8. | |||
р( • 10 4, Па. | 0,990. | 0,949. | 0,897. | 0,806. | 0,600. | 0,000. | |
р, • 10 4, Па. | 0,000. | 0,343. | 0,407. | 0,447. | 0,500. | 0,596. | |
5.8.16. | Система «вода (1-й компонент) — метанол (2-й компонент)». | ||||||
Щ | 0,2. | 0,4. | 0,6. | 0,8. | |||
р,? 10 4, Па. | 0,316. | 0,273. | 0,207. | 0,147. | 0,087. | 0,000. | |
р, • 10 4, Па. | 0,000. | 0,453. | 0,813. | 1,120. | 1,400. | 1,687. | |
5.8.17. | Система «вода (1-й компонент) — ацетон (2-й компонент)». | ||||||
N* | 0,2. | 0,4. | 0,6. | 0,8. | |||
/7, • ЮЛ Па. | 0,316. | 0,267. | 0,253. | 0,220. | 0,149. | 0,000. | |
/?2* ЮЛ Па. | 0,000. | 1,879. | 2,253. | 2,479. | 2,706. | 3,056. | |
5.8.18. | Система «хлороформ (1-й компонент) — ацетон (2-й компонент)». | ||||||
N* | 0,2. | 0,4. | 0,6. | 0,8. | |||
/?, • ЮЛ Па. | 0,56. | 1,36. | 2,44. | 3,6. | 4,586. | ||
р2 • КГ4, Па. | 3,906. | 1,973. | 1,093. | 0,453. | |||
5.8.19. | Система «вода (1-й компонент) — 1,4-диоксан (2-й компонент)». | ||||||
N* | 0,2. | 0,4. | 0,6. | 0,8. | |||
/7, • ЮЛ Па. | 0,316. | 0,287. | 0,260. | 0,231. | 0,189. | 0,000. | |
р2 • ЮЛ Па. | 0,000. | 0,287. | 0,369. | 0,407. | 0,441. | 0,492. | |
5.8.20. | Система «этанол (1-й компонент) — бензол (2-й компонент)». | ||||||
N* | 0,2. | 0,4. | 0,6. | 0,8. | |||
/7, • ЮЛ Па. | 0,596. | 0,500. | 0,447. | 0,407. | 0,343. | 0,000. | |
р2 • ЮЛ Па. | 0,000. | 0,600. | 0,806. | 0,897. | 0,949. | 0,990. | |
При некоторой температуре и давлении (они нс используются при решении и тут не указаны) находятся в равновесии жидкая и паровая фазы двухкомпонентной системы, содержащей диэтиловый эфир (1-й компонент) и четыреххлористый углерод (2-й компонент). Масса системы равна т, кг. Массовые доли СС14 в системе (р, паровой <�р" и жидкой ф* фазах приведены в табл. 5.11. Определите, чему равны массы жидкой и паровой фаз.
Данные для задач 5.9.1−5.9.20.
Таблица 5.11
№ задачи. | т, кг. | Ч>2. | <�р" . | ф. |
5.9.1. | 0,06. | 0,04. | 0,12. | |
5.9.2. | 0,12. | 0,08. | 0,20. | |
5.9.3. | 0,16. | 0,08. | 0,20. | |
5.9.4. | 0,16. | 0,12. | 0,32. | |
5.9.5. | 0,20. | 0,12. | 0,32. | |
5.9.6. | 0,24. | 0,12. | 0,32. | |
5.9.7. | 0,26. | 0,12. | 0,32. | |
5.9.8. | 0,24. | 0,19. | 0,46. | |
5.9.9. | 0,28. | 0,19. | 0,46. | |
5.9.10. | 0,34. | 0,19. | 0,46. | |
5.9.11. | 0,40. | 0,19. | 0,46. | |
5.9.12. | 0,36. | 0,29. | 0,60. | |
5.9.13. | 0,42. | 0,29. | 0,60. | |
5.9.14. | 0,46. | 0,29. | 0,60. | |
5.9.15. | 0,52. | 0,29. | 0,60. | |
5.9.16. | 0,48. | 0,42. | 0,76. | |
5.9.17. | 0,52. | 0,42. | 0,76. | |
5.9.18. | 0,56. | 0,42. | 0,76. | |
5.9.19. | 0,62. | 0,42. | 0,76. | |
5.9.20. | 0,68. | 0,42. | 0,76. |
Известны данные о составах равновесных фаз системы «бензол (1-й компонент) — пропанол (2-й компонент)»: мольные доли 2-го компонента в системе /V, в жидкой N* и паровой N" фазах при некоторых не используемых при решении и поэтому тут не приведенных температурах и давлении 1 атм. Первоначальная масса системы т (табл. 5.12). Определите массы равновесных фаз и массы каждого компонента в каждой фазе.
Данные для задач 5.10.1−5.10.20
Таблица 5.12
№ задачи. | т, кг. | N* | N | |
5.10.1. | 0,030. | 0,10. | 0,150. | |
5.10.2. | 0,020. | 0,08. | 0,110. | |
5.10.3. | 0,036. | 0,10. | 0,190. | |
5.10.4. | 0,040. | 0,10. | 0,224. | |
5.10.5. | 0,040. | 0,14. | 0,224. | |
5.10.6. | 0,040. | 0,18. | 0,224. | |
5.10.7. | 0,060. | 0,10. | 0,270. | |
5.10.8. | 0,060. | 0,14. | 0,270. | |
5.10.9. | 0,060. | 0,16. | 0,270. | |
5.10.10. | 0,060. | 0,18. | 0,270. | |
5.10.11. | 0,200. | 0,30. | 0,350. | |
5.10.12. | 0,700. | 0,60. | 0,530. | |
5.10.13. | 0,700. | 0,64. | 0,530. | |
5.10.14. | 0,700. | 0,58. | 0,530. | |
5.10.15. | 0,780. | 0,62. | 0,580. | |
5.10.16. | 0,780. | 0,66. | 0,580. | |
5.10.17. | 0,780. | 0,72. | 0,580. | |
5.10.18. | 0,820. | 0,66. | 0,620. | |
5.10.19. | 0,820. | 0,70. | 0,620. | |
5.10.20. | 0,820. | 0,74. | 0,620. |
На основании приведенных данных о составах жидкой УУ* и паровой N" фаз при различных температурах Т (табл. 5.13) постройте диаграмму фазового состояния системы (табл. 5.14). Обозначьте все поля и характерные точки на диаграмме; ответьте, есть ли отклонения от закона Рауля в поведении жидкой фазы. Расскажите, что происходит в системе первоначального состава N2 при изменении температуры от 7) до Тг
Таблица 5.13
Данные для построения диаграмм кипения
Система. | Состав паровой и жидкой фаз при разных температурах. | ||||||||
Бензол. (1 -й компонент) — пропанол (2-й компонент). | Т, К | 344,5. | |||||||
N* | 0,03. | 0,06. | 0,20. | 0,41. | 0,70. | 0,85. | 1,0. | ||
0,15. | 0,27. | 0,35. | 0,41. | 0,53. | 0,67. | 1,0. | |||
Бензол. (1 -й компонент) — метанол (2-й компонент). | Г, К. | ||||||||
N* | 0,08. | 0,20. | 0,34. | 0,45. | 0,67. | 0,85. | 1,0. | ||
N" | 0,23. | 0,41. | 0,50. | 0,57. | 0,57. | 0,77. | 1,0. | ||
Ацетон. (1 -й компонент) — трихлорметан (2-й компонент). | Г, К. | 337,4. | |||||||
N* | 0,10. | 0,22. | 0,43. | 0,53. | 0,67. | 0,83. | 1,0. | ||
К | 0,05. | 0,11. | 0,28. | 0,44. | 0,67. | 0,91. | 1,0. | ||
Диэтиловый эфир (1 -й компонент) — тетрахлорметан (2-й компонент). | г, к. | ||||||||
N* | 0,02. | 0,11. | 0,29. | 0,6. | 0,8. | 0,94. | 1,0. | ||
N-; | 0,001. | 0,04. | 0,1. | 0,26. | 0,5. | 0,8. | 1,0. | ||
Данные для задач 5.11.1−5.11.20
Таблица 5.14
№ задачи. | 1-й компонент. | 2-й компонент. | " г | Г, К. | 7), К. |
5.11.1. | Бензол. | Пропанол. | 0,1. | ||
5.11.2. | Бензол. | Метанол. | 0,8. | ||
5.11.3. | Ацетон. | Трихлорметан. | 0,1. | ||
5.11.4. | Диэтиловый эфир | Тетрахлорметан. | 0,2. | ||
5.11.5. | Бензол. | Пропанол. | 0,2. | ||
5.11.6. | Бензол. | Метанол. | 0,4. | ||
5.11.7. | Ацетон. | Трихлорметан. | 0,3. | ||
5.11.8. | Диэтиловый эфир | Тетрахлорметан. | 0,3. | ||
5.11.9. | Бензол. | Пропанол. | 0,3. | ||
5.11.10. | Бензол. | Метанол. | 0,3. | ||
5.11.11. | Ацетон. | Трихлорметан. | 0,2. | ||
5.11.12. | Диэтиловый эфир | Тетрахлорметан. | 0,4. | ||
5.11.13. | Бензол. | Пропанол. | 0,6. | ||
5.11.14. | Бензол. | Метанол. | 0,2. | ||
5.11.15. | Ацетон. | Трихлорметан. | 0.4. | ||
5.11.16. | Диэтиловый эфир | Тетрахлорметан. | 0,5. | ||
5.11.17. | Бензол. | Пропанол. | 0,7. | ||
5.11.18. | Бензол. | Метанол. | 0,1. | ||
5.11.19. | Ацетон. | Трихлорметан. | 0,8. | ||
5.11.20. | Диэтиловый эфир | Тетрахлорметан. | 0,6. |
Задачи 5.12.1−5.12.20
Постройте изобарную диаграмму двухкомпонентной системы (табл. 5.15), если известно, что в твердом состоянии вещества А и В нерастворимы друг в друге, а в жидком состоянии они образуют идеальный раствор. Известны также температуры кристаллизации Т° и Т" и мольные энтальпии плавления Д/г" пл и Д/г°пл чистых веществ А и В.
Данные для задач 5.12.1−5.12.20
Таблица 5.15
№ задачи. | 1-й компонент. | 2-й компонент. | ||||
Вещество А | г;, к. | ЛА.Г; кДж/моль. | Вещество В | т; к. | ДА°'ПЛ,. кДж/моль. | |
5.12.1. | с, н6 | 278,7. | 9,83. | С6Н5С1. | 228,2. | 9,56. |
5.12.2. | А1. | 6,40. | Si. | 31,20. | ||
5.12.3. | AgCl. | 13,20. | КС1. | 25,50. | ||
5.12.4. | Nal. | 22,0. | NaF. | 32,60. | ||
5.12.5. | Cd. | 6,23. | Bi. | 11,05. | ||
5.12.6. | Sb. | 20,10. | Pb. | 4,77. | ||
5.12.7. | AgBr. | 12,60. | KBr. | 29,0. | ||
5.12.8. | Ag. | 11,30. | Pb. | 4,77. | ||
5.12.9. | K.C1. | 25,50. | LiCl. | 13,40. | ||
5.12.10. | Zn. | 7,24. | Sn. | 7,20. | ||
5.12.11. | c"h5ci. | 228,2. | 9,56. | СД,. | 278,7. | 9,83. |
5.12.12. | Si. | 31,20. | Al. | 6,40. | ||
5.12.13. | KC1. | 25,50. | AgCl. | 13,20. | ||
5.12.14. | NaF. | 32,60. | Nal. | 22,0. | ||
5.12.15. | Bi. | 11,05. | Cd. | 6,23. | ||
5.12.16. | Pb. | 4,77. | Sb. | 20,10. | ||
5.12.17. | KBr. | 29,0. | AgBr. | 12,60. | ||
5.12.18. | Pb. | 4,77. | Ag. | 11,30. | ||
5.12.19. | LiCl. | 13,40. | KC1. | 25,50. | ||
5.12.20. | Sn. | 7,20. | Zn. | 7,24. | ||
Задачи 5.13.1−5.13.20
Постройте диаграмму плавкости системы, природу которой определите по табл. 5.16, по данным о температурах начала кристаллизации (7^) и окончания кристаллизации (7^) разных составов данной системы (табл. 5.17).
Подпишите все поля и характерные точки на диаграмме и проанализируйте процесс охлаждения системы первоначального состава ф2, ф2 и ф". Изобразите кривые охлаждения системы этих трех составов от температуры Т{ до температуры Т2 и поясните, что на каждом участке происходит, сколько фаз находится в равновесии и какие это фазы, чему равно число степеней свободы.
Определите, какие по природе фазы находятся в равновесии, в системе первоначального состава ф'2, находящейся при температуре Ту Определите их состав и массу, если масса всей системы 2 кг.
Данные для задач 5.13.1−5.13.20
Таблица 5.16
№ задачи. | Система. | Г, К. | т2, К. | г, к. | |||
5.13.1. | Cd — Bi. | 0,2. | 0,61. | ||||
5.13.2. | Nal — NaF. | 0,2. | 0,5. | 1.0. | |||
5.13.3. | Sb — Pb. | 0,3. | 0,85. | ||||
5.13.4. | Al —Si. | 0,1. | 0,6. | 1,0. | |||
5.13.5. | AgCl — KC1. | 0,6. | 0,27. | ||||
5.13.6. | Bi —Cd. | 0,1. | 0,39. | ||||
5.13.7. | NaF —Nal. | 0,3. | 0,8. | ||||
5.13.8. | Pb —Sb. | 0,15. | |||||
5.13.9. | Si—Al. | 0,4. | 0,9. | ||||
5.13.10. | KCI—AgCl. | 0,9. | 0,73. | ||||
5.13.11. | Cd —Bi. | 0,61. | 0,9. | 1.0. | |||
5.13.12. | Nal —NaF. | 0,6. | 0,2. | ||||
5.13.13. | Sb —Pb. | 1,0. | 0,5. | 0,85. | |||
5.13.14. | Al —Si. | 0,4. | 0,1. | ||||
5.13.15. | AgCl — KCI. | 0,5. | 0,27. | ||||
5.13.16. | Bi —Cd. | 0,39. | 0,8. | 1,0. | |||
5.13.17. | NaF — Nal. | 0,2. | 0,8. | ||||
5.13.18. | Pb —Sb. | 0,15. | 0,7. | 1,0. | |||
5.13.19. | Si—Al. | 0,5. | 0,9. | ||||
5.13.20. | KCI—AgCl. | 0,73. | 0,3. | 1,0. |
Таблица 5.17
Данные для построения диаграмм плавкости
Система. | Температуры начала и окончания кристаллизации в расплавах разного состава. | |||||||
Cd — Bi. | ъ | 0,1. | 0,3. | 0,5. | 0,61. | 0,8. | 1,0. | |
С> к. | ||||||||
TZ*к | ||||||||
Nal — NaF. | Ф2. | 0,1. | 0,2. | 0,4. | 0,6. | 0,8. | 1,0. | |
С> к. | ||||||||
TZ к | ||||||||
Sb —Pb. | ф. | 0,3. | 0,5. | 0,7. | 0,85. | 0,9. | 1,0. | |
Ск. | ||||||||
С". к. | ||||||||
Al —Si. | ф. | 0,1. | 0,3. | 0,4. | 0,6. | 0,8. | 1,0. | |
С, — к. | ||||||||
С, к. | ||||||||
AgCl — KC1. | ф2 | 0,2. | 0,27. | 0,5. | 0,7. | 0,9. | 1,0. | |
Сч> к. | ||||||||
С, к. | ||||||||
NaF — Nal. | ф2 | 0,2. | 0,4. | 0,6. | 0,8. | 0,9. | 1,0. | |
С. к. | ||||||||
С, к | ||||||||
Окончание табл. 5.17
Система. | Температуры начала и окончания кристаллизации в расплавах разного состава. | |||||||
Pb — Sb. | Ч>2. | 0,1. | 0,15. | 0,3. | 0,5. | 0,8. | 1,0. | |
С> к. | ||||||||
С".к. | ||||||||
Si — Al. | Фз. | 0,2. | 0,4. | 0,6. | 0,8. | 0,9. | 1,0. | |
с., к. | ||||||||
КС1 — AgCl. | Фз. | 0,2. | 0,3. | 0,5. | 0,73. | 0,86. | 1,0. | |
Сч> К | ||||||||
с". к. | ||||||||
Bi —Cd. | ф. | 0,1. | 0,39. | 0,5. | 0,7. | 0,9. | 1,0. | |
TZ К | ||||||||
Т1, к. | ||||||||
Задачи 5.14.1−5.14.20
На рис. 5.22−5.29 приведено схематичное изображение диаграмм плавкости нескольких систем при атмосферном давлении. Перерисуйте нужную вам диаграмму (табл. 5.18), подпишите все поля и характерные точки на вашем рисунке и проанализируйте процесс охлаждения системы первоначального состава Nr Изобразите кривые охлаждения системы составов N2, N'2, N", N'" от температуры, соответствующей жидкому состоянию данного состава, до температуры, характерной для твердого состояния данного состава. Поясните, что на каждом участке кривой охлаждения происходит, сколько фаз находится в равновесии, какие это фазы и чему равно число степеней свободы. Укажите тип и определите состав химического соединения.
Таблица 5.18
Данные для задач 5.14.1−5.14.20
№ задачи. | Система. | N, | К | К | N" |
5.14.1. | Mg — Pb. | 0,1. | 0,2. | 0,32. | 1,0. |
5.14.2. | Mg — Zn. | 0,46. | 0,6. | 0,77. | 1,0. |
5.14.3. | CuCl — К. С1. | 0,34. | 0,66. | 0,8. | 1,0. |
5.14.4. | Mg —А1. | 0,56. | 0,7. | 0,9. | 1,0. |
5.14.5. | KC1 — CaCl,. | 0,2. | 0,3. | 0,4. | |
5.14.6. | KBr — CuBr. | 0,32. | 0,5. | 0,7. | |
5.14.7. | AgCl — T1C1. | 0,4. | 0,6. | 0,8. | 1,0. |
5.14.8. | BaF, — BaCI,. | 0,5. | 0,7. | 0,8. | 1,0. |
5.14.9. | Mg —Pb. | 0,32. | 0,5. | 0,73. | 1,0. |
5.14.10. | Mg — Zn. | 0,0. | 0,46. | 0,6. | 0,77. |
5.14.11. | CuCl — KC1. | 0,2. | 0,34. | 0,66. | 1,0. |
5.14.12. | Mg —A1. | 0,35. | 0,56. | 0,8. | 1,0. |
5.14.13. | KC1 — CaCl,. | 0,4. | 0,63. | 0,8. | 1,0. |
5.14.14. | KBr —CuBr. | 0,32. | 0,5. | 0,7. | 1,0. |
5.14.15. | AgCl — T1CI. | 0,4. | 0,5. | 0,6. | |
5.14.16. | BaF, — BaCl2 | 0,32. | 0,5. | 0,7. | |
5.14.17. | Mg —Pb. | 0,5. | 0,32. | 0,73. | |
5.14.18. | Mg — Zn. | 0,1. | 0,2. | 0,46. | 1,0. |
5.14.19. | CuCl — KC1. | 0,34. | 0,5. | 0,66. | |
5.14.20. | Mg —A1. | 0,2. | 0,35. | 0,56. |
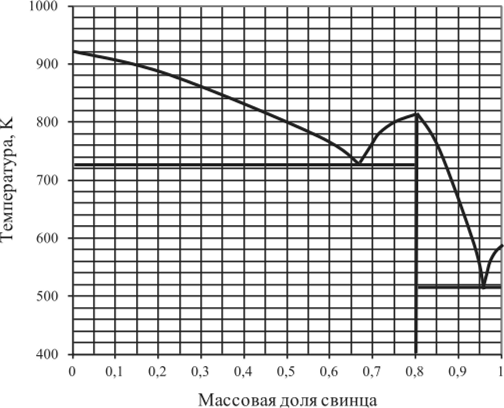
Рис. 5.22. Диаграмма плавкости Mg — Pb
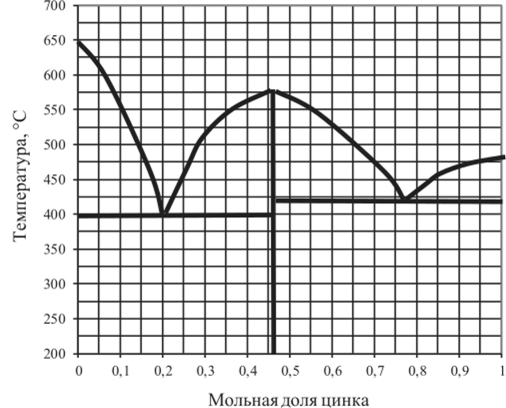
Рис. 5.23. Диаграмма плавкости Mg — Zn.
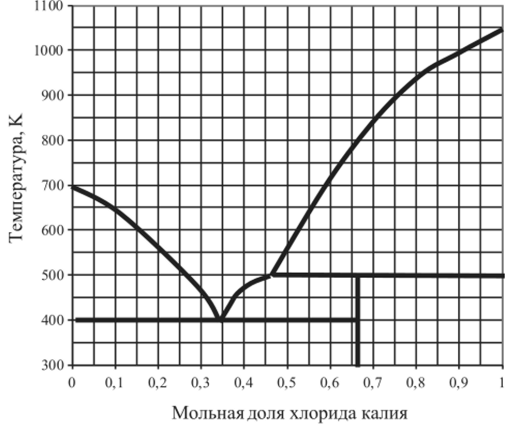
Рис. 5.24. Диаграмма плавкости CuCl — КС1.
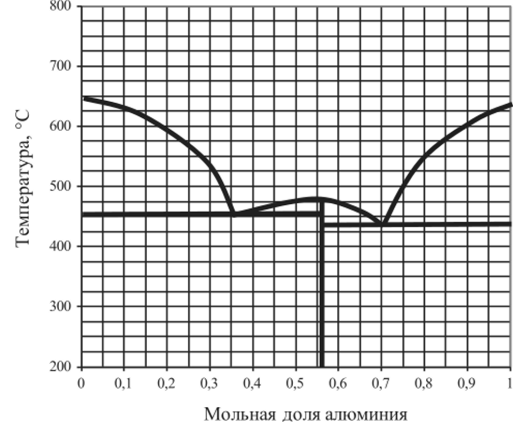
Рис. 5.25. Диаграмма плавкости Mg — А1.
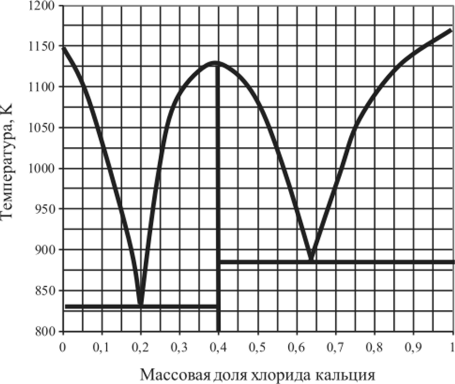
Рис. 5.26. Диаграмма плавкости КС1 — СаС12.
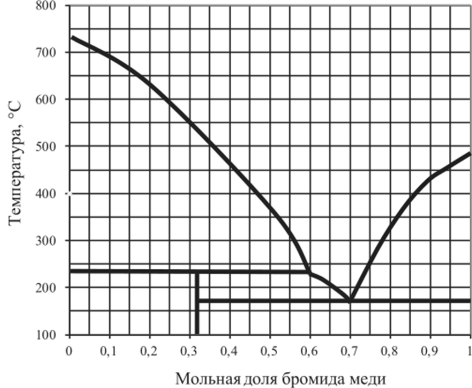
Рис. 5.27. Диаграмма плавкости КВг — CuBr.

Рис. 5.28. Диаграмма плавкости AgCl — Т1С1.
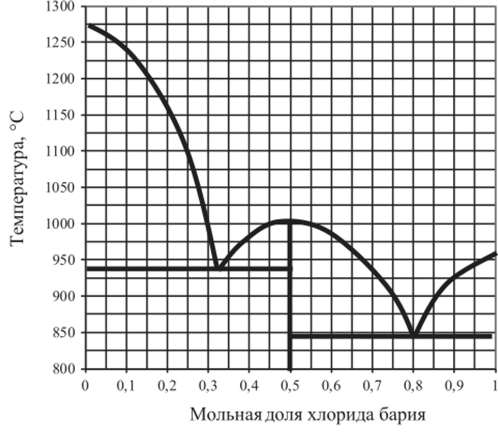
Рис. 5.29. Диаграмма плавкости BaF, — ВаС1,.
Задачи 5.15.1−5.15.20
Перерисуйте нужную вам диаграмму плавкости (табл. 5.18, рис. 5.30−5.41), укажите все области и характерные точки на этой диаграмме. Проанализируйте процесс охлаждения системы первоначального состава ф,. Изобразите кривые охлаждения системы составов ф2, ф'2, ф" и ф" ' от температуры, при которой системы в жидком состоянии до температуры, при которой в системе твердое состояние. Поясните, что на каждом участке кривой охлаждения происходит, сколько фаз находится в равновесии, какие это фазы, чему равно число степеней свободы.
Таблица 5.18
Данные для задач 5.15.1−5.15.20
№ задачи. | Система. | 4>2. | 4>2. | Ф". | |
5.15.1. | Fe — Sb. | 0,1. | 0,3. | 0,48. | 0,95. |
5.15.2. | Fe — Zr. | 0,05. | 0,2. | 0,52. | 0,96. |
5.15.3. | MgS04 — Na, S04 | 0,1. | 0,5. | 0,74. | 0,8. |
5.15.4. | Bi —Pb. | 0,04. | 0,42. | 0,7. | 0,94. |
5.15.5. | Hg — Cd. | 0,3. | 0,4. | 0,64. | 0,8. |
5.15.6. | Ag—Si. | 0,02. | 0,2. | 0,8. | 0,96. |
5.15.7. | nC6H4I2 —пСДСП. | 0,04. | 0,3. | 0,82. | 0,92. |
5.15.8. | CaSiO, — MnSiO,. | 0,3. | 0,5. | 0,86. | 1,0. |
5.15.9. | Hg —Cd. | 0,2. | 0,5. | 0,62. | 0,92. |
5.15.10. | Cu —Ni. | 0,2. | 0,4. | 0,8. | 1,0. |
5.15.11. | Bi —Pb. | 0,04. | 0,2. | 0,42. | 0,8. |
5.15.12. | Co — Cr. | 0,2. | 0,47. | 0,7. | 1,0. |
5.15.13. | LiCl —AgCl. | 0,1. | 0,4. | 0,7. | 0,8. |
5.15.14. | Hg —Cd. | 0,3. | 0,4. | 0,64. | 0,8. |
5.15.15. | nC6H4l, — пСДСП. | 0,06. | 0,2. | 0,82. | 0,9. |
5.15.16. | CaSiO, — MnSiO,. | 0,2. | 0,4. | 0,86. | 0,9. |
5.15.17. | MgS04 — Na, S04 | 0,2. | 0,4. | 0,74. | 0,9. |
5.15.18. | LiCl—AgCl. | 0,1. | 0,3. | 0,6. | 0,9. |
5.15.19. | Hg —Cd. | 0,3. | 0.4. | 0,64. | 0,8. |
5.15.20. | Fe — Zr. | 0,05. | 0,16. | 0,52. | 0,96. |
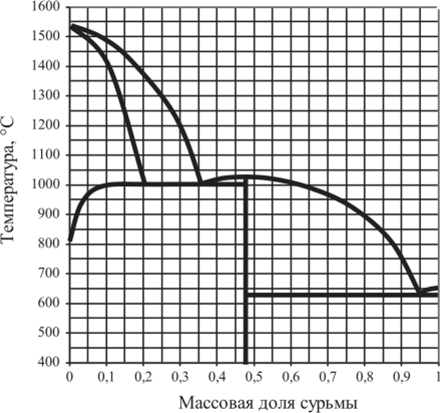
Рис. 5.30. Диаграмма плавкости Fe — Sb
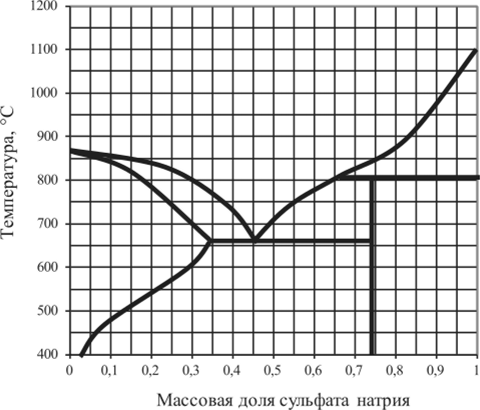
Рис. 5.31 Диаграмма плавкости MgS04 — Na2S04.
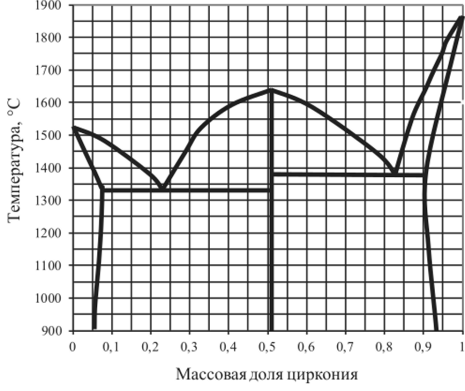
Рис. 5.32. Диаграмма плавкости Fe — Zr.
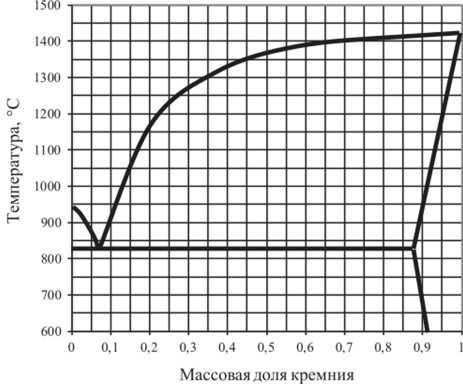
Рис. 5.33. Диаграмма плавкости Ag — Si.
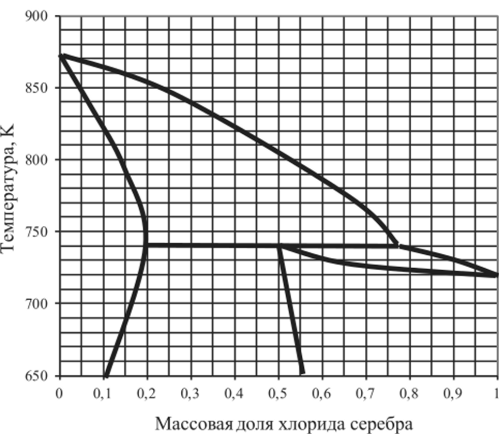
Рис. 5.34. Диаграмма плавкости LiCl —AgCl.
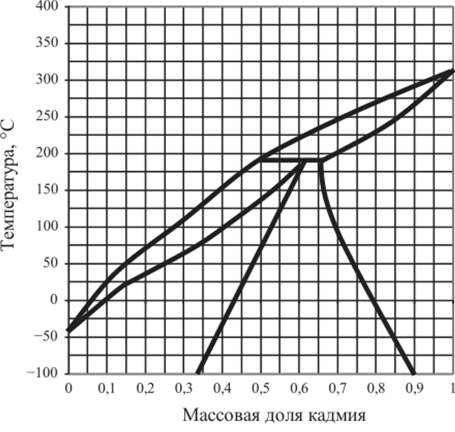
Рис. 5.35. Диаграмма плавкости Hg — Cd.
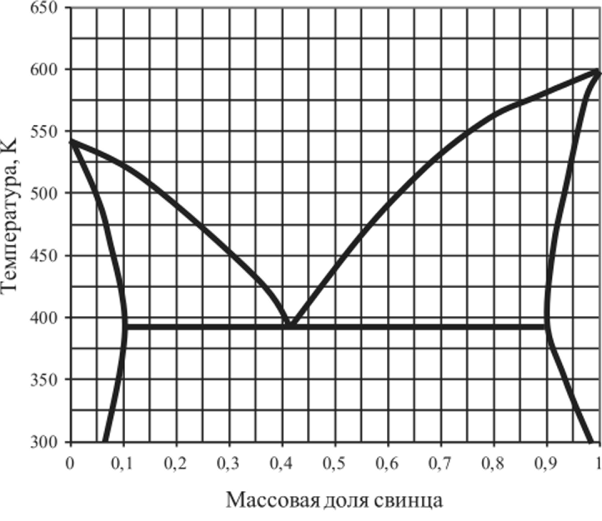
Рис. 5.36. Диаграмма плавкости системы Bi — Pb.
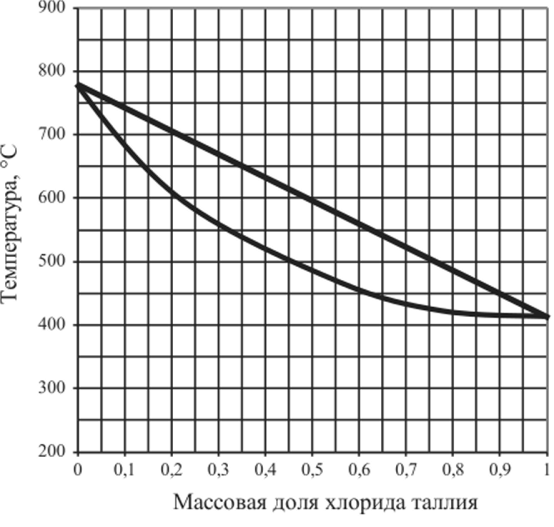
Рис. 5.37. Диаграмма плавкости системы КС1 — Т1С1.
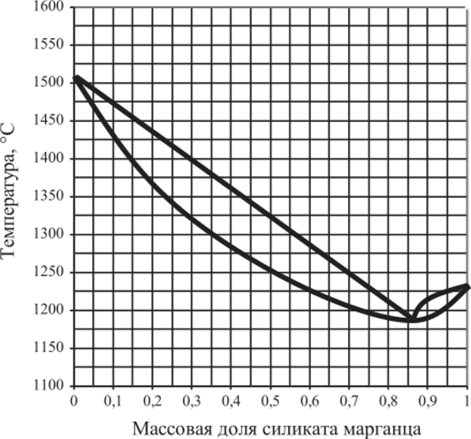
Рис. 5.38. Диаграмма плавкости CaSi03 — MnSi03.
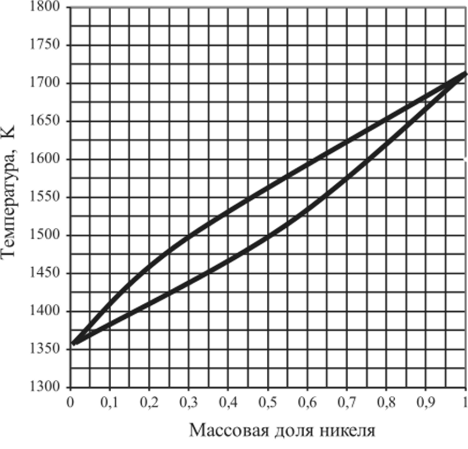
Рис. 5.39. Диаграмма плавкости системы Си — Ni.
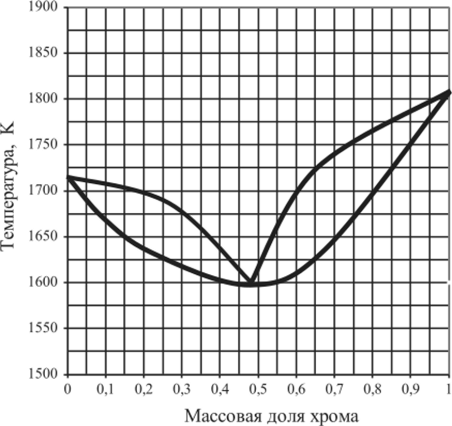
Рис. 5.40. Диаграмма плавкости системы Со — Сг.
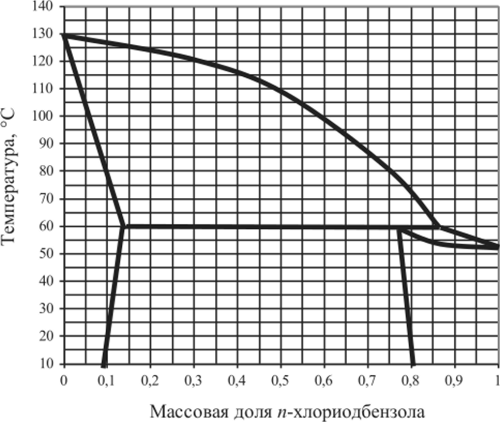
Рис. 5.41. Диаграмма плавкости п-С6Н412 — п-С6Н4СИ.