Физико-химические характеристики взрывчатых веществ
Кроме этих газов при взрыве могут образовываться сероводород H2S, сернистый ангидрид S02, хлор, при вдыхании которых происходят острое раздражение дыхательных путей и отек легких. Но токсичности эти газы считаются в 2,5 раза более ядовитыми, чем оксид углерода. Кроме того, при взрыве детонаторов в атмосфере появляются особо ядовитые пары и аэрозоли ртути или свинца, входящие в состав инициирующих… Читать ещё >
Физико-химические характеристики взрывчатых веществ (реферат, курсовая, диплом, контрольная)
Известны три основные формы химического превращения ВВ.
- • Медленное химическое превращение— процесс, протекающий, но всему объему вещества при относительно низких температурах. Он может возникнуть при неблагоприятных условиях хранения ВВ и его недостаточной химической стойкости.
- • Горение и детонация — химические реакции, протекающие в довольно узкой зоне — фронте химической реакции, перемещающиеся по В В при температуре, близкой к критической. Скорость перемещения фронта определяется величиной выделяющейся энергии и способом передачи ее к соседним слоям вещества. При горении энергия передается путем теплопередачи — эго сравнительно медленный процесс, поэтому и скорость горения может быть от долей сантиметра до десятков метров в секунду. При детонации жидких и порошкообразных ВВ энергия соседним слоям заряда передается детонационной волной, которая распространяется по ВВ со сверхзвуковой скоростью (от 2 до 6 км/ч).
- • Взрыв — процесс, при котором взрывные горящие частицы распространяются по заряду за счет струй раскаленных газов, проникающих в прилегающие к зоне реакции слои ВВ. Такая реакция характерна для грубодисперсных, гранулированных и водосодержащих ВВ.
Состав газов, выделяющихся при взрыве, зависит от химического состава ВВ, его кислородного баланса и условий взрывания.
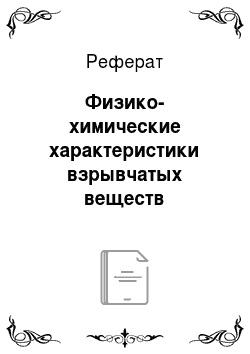
Кислородный баланс (КБ) характеризуют выраженным в процентах отношением избытка или недостатка кислорода в составе ВВ по сравнению с тем количеством, которое необходимо для полного окисления всех горючих элементов этого ВВ, к его массе. Например, аммиачная селитра.
NH4NO3 = N2 + 2Н20 + 1/202 имеет положительный кислородный баланс:
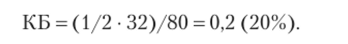
Кислородный баланс считается нулевым, если ВВ содержит кислорода достаточно для полного окисления его горючих элементов. Такое соотношение компонентов называют стехиометрическим. Если в составе ВВ не хватает кислорода для полного окисления горючих элементов, то такое ВВ имеет отрицательный, а при избытке кислорода — положительный кислородный баланс (табл. 6.1).
Таблица 6.1
Физико-химические характеристики некоторых ВВ
Вещество. | Химическая формула. | Молярная масса, г/моль. | Кислородный баланс,. %. | Теплота образования при постоянном объеме, кДж/моль. |
Алюминий. | А1. | — 89,0. | ; | |
Аммиачная селитра. | nh4no3 | +20,0. | ||
Гексоген. | C3H6N606 | — 21,6. | — 88. | |
Гремучая ртуть. | Hg (CNO)2 | — 11,3. | — 275. | |
Калиевая селитра. | KNO3. | +39,6. | ||
Калия хлорат. | КСЮ3. | 122,5. | +39,6. | |
Натриевая селитра. | NaN03 | +47,0. | ||
Натрия хлорат. | NaCl03 | 106,5. | +45,0. | |
Нитроглицерин. | C3H5(0N02)3 | +3,5. | ||
Нитроклетчатка (коллоидная). | C2H4H31N9038 | 1115,3. | — 38,7. | |
Октоген. | c4h8n8o8 | — 21,6. | ; | |
Пикриновая кислота. | CgH2(N02)30H. | — 45,4. | ||
Тетранитрометан. | C (N02)4 | +49,0. | — 35. |
Окончание табл. 6.1
Вещество. | Химическая формула. | Молярная масса, г/моль. | Кислородный баланс,. %. | Теплота образования при постоянном объеме, кДж/моль. |
Тетрил. | c6h2(no2)4nch3 | ; | ; | ; |
Т ротил. | C6H2(NO,)3CH3 | — 74,0. | 73,5. | |
ТЭН. | c5ii8(Ono2)4 | — 10,1. |
При взрыве ВВ с нулевым кислородным балансом образуются в основном пары воды, углекислоты, свободный азот, оксид алюминия и минимальное количество ядовитых газов. В этом случае выделяется максимальное количество энергии.
При взрыве ВВ с недостатком кислорода образуется ядовитый оксид углерода СО. Образование этого соединения происходит с меньшим выделением тепла (112 кДж/г моль), чем при образовании диоксида углерода (396 кДж/г моль).
При взрыве ВВ с избытком кислорода образуются соединения азота с этим кислородом — весьма ядовитые оксиды NO, N02, N203. Реакции образования оксидов азота идут с поглощением тепла (эндотермичны). Таким образом, ВВ с отрицательным и положительным кислородным балансом обладают меньшей теплотой взрыва, чем ВВ с нулевым балансом.
Состав газообразных продуктов взрыва зависит не только от химического состава ВВ, но и от оболочки патронов ВВ, условий взрывания заряда (степени ограничения пространства, в котором расположен заряд, и влажности ВВ) и свойств взрываемой породы, которые влияют на протекание вторичных химических реакций взрыва.
Плохая забойка зарядов, наличие воздушных промежутков между патронами увеличивают выделение ядовитых газов. При взрывании угля С02 может переходить в СО. Взрывы серосодержащих руд приводят к образованию сернистых газов и сероводородов. Калийные и апатитонефелиновые руды связывают оксиды азота, молибденовые и медные — оксид углерода. Чем выше коэффициент крепости взрываемых пород, тем больше образуется оксида углерода и меньше оксидов азота.
Бумажная парафиновая оболочка патронов участвует в реакции взрыва, понижая кислородный баланс. Поэтому масса бумажной оболочки должна быть не более 2 г, а парафина — не более 3 г на 100 г ВВ.
Для подземных работ применяют ВВ только с кислородным балансом, близким к нулевому (±3%). Для взрывания на земной поверхности могут применяться ВВ как с положительным, так и с отрицательным кислородным балансом.
Отравляющее действие оксида углерода СО (угарный газ) основано на его способности образовывать при вдыхании прочные соединения с красными кровяными тельцами, являющимися переносчиками кислорода из легких к тканям, из-за чего человеческий организм испытывает кислородное голодание. При больших концентрациях СО (> 1%) быстро наступает смерть. Предельно допустимой концентрацией СО в воздухе для шахт является 0,0016% но объему.
Оксиды азота NO, N02, N203 при вдыхании в легкие образуют, вступая в реакцию с водой, азотную и азотистую кислоты, действие которых приводит к отеку легких и смерти. Особую опасность представляет способность оксидов азота накапливаться в организме в течение 4—6 ч. По токсическому действию они считаются в 6,5 раза более ядовитыми, чем осид углерода. Поэтому предельно допустимая концентрация для шахт составляет 0,0002% по объему.
Кроме этих газов при взрыве могут образовываться сероводород H2S, сернистый ангидрид S02, хлор, при вдыхании которых происходят острое раздражение дыхательных путей и отек легких. Но токсичности эти газы считаются в 2,5 раза более ядовитыми, чем оксид углерода. Кроме того, при взрыве детонаторов в атмосфере появляются особо ядовитые пары и аэрозоли ртути или свинца, входящие в состав инициирующих ВВ, а свинец, кроме того, входит в состав электровоспламенителей и замедляющих составов ЭД.
Истинные реакции взрывчатого превращения ВВ составить практически невозможно из-за многообразия факторов, влияющих на их протекание. Поэтому принят упрощенный прием составления реакций взрыва, согласно которому все В В делятся на три группы.
1. ВВ с количеством кислорода, достаточным (или избыточным) для полного окисления всех горючих элементов. В этом случае весь водород превращается в воду, углерод — в углекислый газ, например реакция разложения нитрогликоля (табл. 6.2).
Характеристики взрывчатых превращений некоторых веществ.
6.2. Физико-химические характеристики взрывчатых веществ
вв. | Молекулярная масса. | Реакция взрывчатых веществ. | Кислородный баланс,. %. | Объем газов взрыва, л/кг. | Температура взрыва,. °С. | Теплота взрыва, кДж/кг. |
Нитроглицерин. | 4С3Н5(ОШ2)3 = 10Н2() + 12С ()2 + 6N, + ()2 | +3,5. | ||||
Нитрогликоль. | C2H4(0N02)2 = 2Н20 + 2СО, + N,. | |||||
Тротил. | 2CBH2(N02)3CH3 = 5Н20 + 7СО + 7С +3N2 | — 74,0. | ||||
Аммиачная селитра. | 2NH4N03= 4Н20 + 2N2 + 02 | +20,0. | ||||
Динитронафталин. | C10H6(NO2)2= ЗН20 + СО + 2N2 + 9С. | — 129,4. | ||||
Коллодионный хлопок. | C22.5H28.8°36.1N8,7= 14,4Н20 + 21,7СО + 0,8С + 4,35N2 | — 33,6. | ||||
Гексоген. | C3H6N606 = 4Н20 + С + 2СО + 3N2 | — 21,6. | ||||
тэн. | C5H8(0N02)4 = 2СО + 4Н20 + ЗС02 + 2N2 | — 10,2. |
ГО СО со.
2. ВВ с количеством кислорода, достаточным для полного газообразования. При этом принимается, что кислород сначала окисляет весь водород в воду, а углерод — в оксид углерода, а оставшийся кислород образует с частью оксида углерода углекислый газ (например, реакция разложения ТЭНа, см. табл. 6.2).
При взрыве алюмосодержащих ВВ с нулевым кислородным балансом образуется твердый оксид алюминия А12Оэ, а при отрицательном — он образуется в результате вторичных реакций алюминия с водой и углекислым газом:
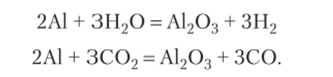
3. ВВ с количеством кислорода, недостаточным для полного газообразования. В этом случае водород полностью превращается в воду, оставшийся кислород окисляет часть углерода в оксид углерода, свободный углерод выделяется (например, реакция разложения тринитротолуола, см. табл. 6.2).
Таким образом, зная элементарный состав ВВ с нулевым или положительным кислородным балансом, можно легко составить реакцию его взрывчатого разложения в виде.
