Ионная связь.
Общая и неорганическая химия

Формулы ионных соединений определяются простым соотношением числа положительных и отрицательных ионов, что соответствует нейтральной молекуле: Na~Cl; Ca2+F2; А13+С13 и т. д. Таким образом, ионную связь следует считать предельным случаем ковалентной полярной связи. В отличие от ковалентной ионная связь не обладает ни направленностью, ни ненасыщаемостью. Силы притяжения между зарядами не зависят… Читать ещё >
Ионная связь. Общая и неорганическая химия (реферат, курсовая, диплом, контрольная)
Обсуждая различные типы химической связи, удобно пользоваться идеализированными моделями ковалентной и ионной связей. Первая, как было показано, базируется на представлении об обобществлении электронов атомами, а вторая — на представлено и о переносе электронов между атомами.
Если два соединяющихся атома сильно отличаются электроотрицательпостыо (например, Na и С1), то их взаимодействие в соответствии с теорией ионной связи сопровождается переносом электрона от натрия к хлору. Нейтральный атом натрия, теряя электрон, превращается в положительно заряженный ион (катион), а атом хлора, приобретая электрон, — в отрицательно заряженный ион (анион). Известно, что на внешней оболочке щелочные металлы содержат по одному s-электрону. У них на один электрон больше, чем у атомов предшествующих благородных газов. Поскольку щелочные металлы характеризуются малой энергией ионизации, то они легче всего образуют катионы. Аналогично ведут себя и щелочно-земельные металлы.
У галогенов — элементов 17-й группы — электронные конфигурации внешних оболочек одинаковые и выражаются формулой т2пр Это значит, что до восьмиэлектронной оболочки у галогенов не хватает по одному электрону. Поэтому при образовании молекулы из атомов щелочного металла и галогена перенос электрона схематически может быть показан так:
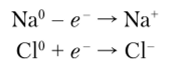
Вследствие этого процесса образуются противоположно заряженные ионы, которые далее взаимодействуют друг с другом за счет электростатического притяжения. Химические связи, в основе которых лежит электростатическое взаимодействие ионов, называются ионными (рис. 4.35).
Для натрия характерно образование устойчивого иона Na+, обладающего электронным строением предшествующего ему благородного газа неона. У иона же хлора строение внешней оболочки соответствует конфигурации благородного газа аргона.
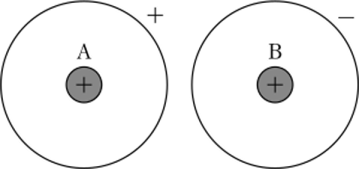
Рис. 435. Перенос электрона
Необходимо отметить, что идеальных ионных соединений вообще не существует, поэтому целесообразнее говорить о частичном ионном характере связей. Экспериментально доказано, что при взаимодействии наиболее электроположительных и электроотрицательных элементов возникает связь преимущественно ионного характера.
Различие в электроотрицательности взаимодействующих атомов приводит к образованию полярной связи вследствие смещения электронной плотности связующего электронного облака к более электроотрицательному атому. Пользуясь значениями относительных электроотрицательностей химических элементов, можно оценивать полярность химической связи между двумя атомами. Разность ОЭО двух элементов может служить мерой полярности связи: чем больше эта разность, тем более полярна связь.
Полингом установлены количественные соотношения между разностью ОЭО и степенью ионности (долей ионного характера связи).
Из-за сложности и необходимости использования экспериментальных данных мы сознательно опускаем математическое уравнение, отражающее указанную зависимость.
В табл. 4.1 приведены примерные соотношения между разностью ОЭО и степенью ионности, пользуясь которыми, можно ориентировочно оценивать степень ионности химической связи в соединениях.
Таблица 4.1
Разность ОЭО элементов и степень ионности связи
Ха ~ Хв. | Степень ионности. | Хл~Хв | Степень ионности. |
связи,%. | связи, %. | ||
0,2. | 1,8. | ||
0,4. | 2,0. | ||
0,6. | 2,2. | ||
0,8. | 2,4. | ||
1,0. | 2,6. | ||
1,2. | 2,8. | ||
1,4. | 3,0. | ||
1,6. | 3,2. |
Кроме этого для расчета степени ионности химической связи можно использовать эмпирическое соотношение:
Ионный характер связи, 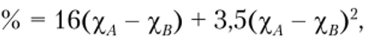
где Ха ~ относительная электроотрицательность элемента А; хв ~ относительная электроотрицательность элемента В.
Если разница ОЭО составляет 1,7, то степень ионности связи соответствует примерно 50%. При разнице между ОЭО большей, чем 2,0, по мнению Полинга, вещество следует рассматривать с позиций ионной структуры. Если же разница находится в пределах 0,4—2,0, то вещество следует описывать с точки зрения ковалентной структуры с частично ионным характером; при разнице менее 0,4 связь считается чисто ковалентной. Если же различие между относительными электроотрицательностями атомов ближе к 3, то можно говорить о полном переходе электронной пары к более электроотрицательному атому.
В молекулах и кристаллах ионная связь должна рассматриваться как предельный случай частично ионной связи. Об этом свидетельствуют данные по определению эффективных зарядов атомов, входящих в состав молекул. Доказано, например, что атомы кислорода или серы могут присоединять лишь только по одному электрону, поскольку энергия присоединения двух электронов (сродство к электрону второго порядка) отрицательна. Следовательно, свободные многозарядные ионы типа О2- или S2 практически не существуют. По этой причине все оксиды и сульфиды, независимо от активности металлов, относятся лишь к частичным ионным соединениям. К чисто ионным соединениям близки лишь галогениды щелочных металлов, хотя для них эффективные заряды составляют лишь 0,94 заряда электрона.
Все устойчивые одноатомные анионы имеют электронное строение соответствующего для данного периода благородного газа, а простейшие катионы имеют электронное строение благородного газа, предшествующего данному периоду (сравните, например, Na+ и Ne, К+ и Аг и т. д.). Такой тип ионной оболочки называется благородногазовым. Однако встречаются катионы с иным строением. Например, отдача нескольких электронов атомами металлов, расположенных сразу же за переходными металлами, приводит к образованию устойчивых катионов, конфигурация электронных оболочек которых может быть представлена как (п — l) s2(fl — 1 )рсп — 1 )d10. В данном случае к внешней оболочке соответствующего благородного газа добавляется полностью заполненный-подуровень. Например:
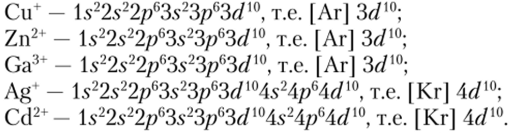
Такие ионы носят название ионов псевдоблагородногазового типа.
Переходные металлы d-семейства образуют ионы типа.
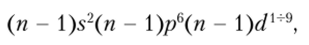
такие ионы называются ионами с незавершенным ^/-подуровнем. Например:
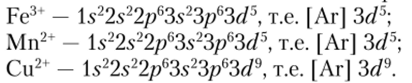
Элементы, расположенные за переходными металлами, могут образовывать ионы, конфигурация внешних электронных оболочек которых может быть представлена так: (п -1 )s2(n — 1 )рп — 1 )dl0ns2. При этом к электронным оболочкам соответствующего благородного газа добавляются заполненные d— и 5-подуровни: 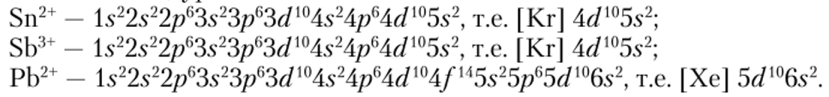
Такие ионы называются ионами с неподеленной электронной парой в я5-орбитали.
Формулы ионных соединений определяются простым соотношением числа положительных и отрицательных ионов, что соответствует нейтральной молекуле: Na~Cl; Ca2+F2; А13+С13 и т. д. Таким образом, ионную связь следует считать предельным случаем ковалентной полярной связи. В отличие от ковалентной ионная связь не обладает ни направленностью, ни ненасыщаемостью. Силы притяжения между зарядами не зависят от направления, по которому эти заряды сближаются (отсутствие направленности). Кроме этого, два разноименных иона, связанных силами притяжения, не теряют своей способности взаимодействовать с ионами противоположного знака. В этом и заключается отсутствие насыщаемости у ионной связи.