Железо.
Общая и неорганическая химия

Действие слабых окислителей приводит к образованию ионов Fe2+, а сильных окислителей — Fe: i+. С водородом железо не образует соединений, но хорошо поглощает его как в твердом, так и в расплавленном состоянии. При нагревании реагирует со многими неметаллами. При высокой температуре раскаленное железо реагирует с водой, что используется для получения водорода (железо-паровой метод): Железо (П… Читать ещё >
Железо. Общая и неорганическая химия (реферат, курсовая, диплом, контрольная)
Историческая справка Железо известно с глубокой древности — за 3000—2.500 лет до н.э. По-видимому, первыми металлами, применявшимися еще в Древнем Египте, были медь, золото, свинец, олово и железо.
Русское название происходит от санскритского корня «жель», что означает «блестеть», «пылать».
Железо не образует соединений, в которых его степень окисления соответствовала бы полному числу валентных электронов — восьми. Наивысшая степень окисления для железа равна +6, и она встречается крайне редко (например, K2Fe04). Степени окисления +2 и +3 соответствуют ионам Fe2+ и Fe3+, которые на незаконченной Зб/-орбитали содержат соответственно 6 и 5 электронов. Магнитные свойства соединений железа и других переходных элементов обусловлены наличием меньшего числа электронов на Зб/-подуровне, чем необходимо для его заполнения.
После алюминия железо — самый распространенный металл. Его содержание в земной коре достигает 5%. На поверхности Земли железо встречается преимущественно в виде соединений, образуя залежи железных руд. Наиболее важнейшие соединения железа следующие: магнитный железняк, или магнетит, Fe304; красный железняк, или гематит, Fe203; бурый железняк, или лимонит, Fe303 •/гН20; шпатовый железняк, или сидерит, FeC03; железный колчедан, или пирит, FeS2.
Свойства железа и его соединений. Химически чистое железо представляет собой блестящий, серебристо-белый пластичный металл. Оно значительно мягче золота и серебра, легче подвергается ковке, прокатке и другим видам обработки как в горячем, так и в холодном состоянии. Температура плавления Тпл = 1539 °C. Обладает магнитными свойствами.
Железо относится к металлам со средней восстановительной активностью. В ряду нормальных электродных потенциалов металлов располагается после цинка. При обыкновенной температуре очень медленно окисляется кислородом воздуха, однако в раскаленном состоянии легко сгорает с образованием оксида железа (Ш) Fe203. В присутствии влаги окисление железа на воздухе происходит быстрее, и оно ржавеет, т. е. покрывается слоем гидратированного железа (П). В присутствии следов влаги легко окисляется хлором, образуя хлорид железа (Ш).
Действие слабых окислителей приводит к образованию ионов Fe2+, а сильных окислителей — Fe:i+. С водородом железо не образует соединений, но хорошо поглощает его как в твердом, так и в расплавленном состоянии. При нагревании реагирует со многими неметаллами. При высокой температуре раскаленное железо реагирует с водой, что используется для получения водорода (железо-паровой метод):
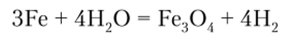
Железо легко взаимодействует с разбавленными соляной и серной кислотами, вытесняя водород:
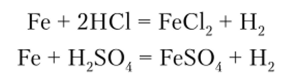
С концентрированными азотной и серной кислотами на холоде железо не реагирует вследствие пассивации. При нагревании эти кислоты окисляют железо до Fe (III):
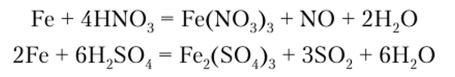
При действии разбавленной HN03 железо также окисляется до Fe (III):
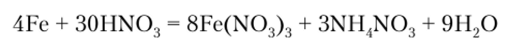
В водных растворах солей железо восстанавливает металлы, стоящие в ряду стандартных электродных потенциалов правее его: 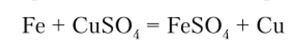
Важнейшие комплексные ионы железа имеют октаэдрическое строение:
Fe (II) — Зб/6-конфигурация. | [Fe (H20)6]2+, [Fe (CN)6]4 |
Fe (III) — Зг75-конфигурация. | [Fe (H20)6]3+, [Fe (CN)6]3~. |
Для Fe2+ наиболее типично координационное число 6, например в FeO (структура типа NaCl), в комплексных ионах [Fc (H20)6]2+, [FeF6]4" и т. д.
Оксид железа (И) может быть получен неполным восстановлением Fe304:
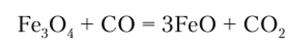
FeO представляет собой черное кристаллическое вещество, нерастворимое в воде и щелочах. При действии кислот образуются гексааквакомплексы:
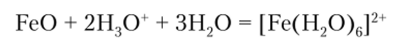
Оксиду FeO соответствует гидроксид Fe (OH)2, получающийся из солей действием щелочей. Этот гидроксид имеет выраженный основный характер. В присутствии кислорода воздуха Fe (OH)2 легко окисляется до Fe (OH)3, поэтому белый осадок Fe (OH)2 быстро темнеет: 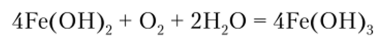
Ион Fe2+ образует соли почти со всеми анионами. При выпаривании из водных растворов выделяют кристаллогидраты зеленого цвета, что обусловлено наличием Fe2+: FeS04-7H20, FeBr2 6H20, Fe (N03)2 -6H20 и т. д.
Железо (П) образует как катионные, так и анионные комплексы. Кроме аквакомилексов [Fe (H90)6]2+ из катионных комплексов известны амминокомплексы [Fe (NH3)6]2+, которые образуются за счет взаимодействия NH3 с безводными соединениями Fe2+, в частности с галогенидами. Аммиакаты устойчивы лишь в твердом состоянии и в насыщенных растворах аммиака. В водных растворах они легко гидродизуются:
Более устойчивы хелатные комплексы, среди которых наибольший интерес с биологической точки зрения представляет гем крови (гем — небелковая часть гемоглобина) (рис. 18.1).
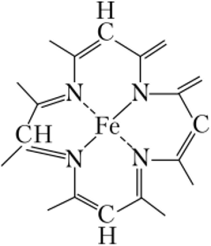
Рис. 18.1. Структура гема крови.
Анионные комплексы — ферраты (Н) — в большинстве своем нестойкие соединения и по свойствам напоминают двойные соли, например Me2+FeCl4 и Me4FeCN4. Из анионных комплексов Fe2+ наиболее устойчив цианидный комплекс [Fe (CN)6]4, образующийся по реакции.
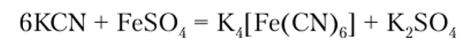
Гексацианоферрат (П)-иону соответствует H4[Fe (CN)6] — железистосинеродистая кислота, образующаяся при действии сильных кислот на гексацианоферраты (И). Как ион, так и кислота обладают диамагнитными свойствами. H4[Fe (CN)6] представляет собой мелкокристаллический порошок. Из солей этой кислоты наиболее известной является желтая кровяная соль K4[Fe (CN)6]-3H20, или гексациапоферрат (П) калия, которая широко применяется в аналитической химии для качественного обнаружения иона Fe3+.
Образование осадка:
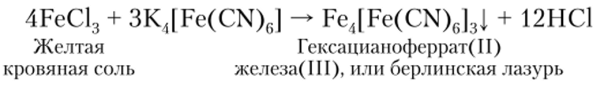
Состав берлинской лазури в растворе:
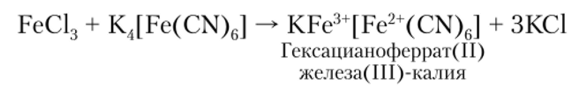
Образующийся осадок интенсивно синего цвета называется берлинской лазурью.
Гексацианоферраты (Н) ^/-элементов, например Cu2[Fe (CN)6], Fe2[Fe (CN)6], имеют координационную структуру. Атомы железа и соответствующего-элемента связаны посредством CN-rpynn.
При добавлении к водным растворам солей Fe2+ соединений, содержащих ионы НС03 и SH, образуются нерастворимые осадки FeC03 и FeS, которые постепенно окисляются кислородом воздуха:
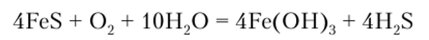
В кислых растворах ион Fe2+ окисляется до Fc3+. Направление процесса зависит от природы лигандов, так как они влияют на относительную устойчивость ионов железа в разных степенях окисления:
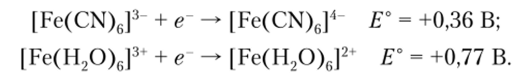
Роданистые комплексы Fe2+ сравнительно непрочны. Из растворов они выделяются в виде Fe (SCN)2*3H20. С роданидами щелочных металлов и аммония ион Fe2^ легко образует комплексные соединения двух типов: Na2[Fe (SCN)2] или Na4[Fe (SCN)G], но более характерен второй тип.
Оксид железа (Ш) Fe203 — порошок красно-бурого цвета, нерастворим в воде. В больших количествах его получают при обжиге железного колчедана: 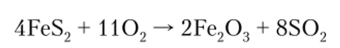
Гидроксид железа (Ш) Fe (OH)3 образуется в виде красно-коричневого осадка, имеющего переменный состав Fe203-wH20. Конечным продуктом дегидротации является Fe203.
Ион Fe3+ образует кристаллические соли с большинством анионов, кроме Г, S2" и им подобных ионов, с которыми он несовместим, поскольку восстанавл и вается:
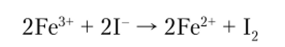
Координационное число Fe3+ равно 6, что соответствует октаэдрическому расположению связей.
Соли, содержащие аква-ион [Fe (H20)6]3+, имеют окраску от бледно-розовой до почти белой, а сам аква-ион — фиолетовую. Однако в растворах, если среда не является сильно кислой, может произойти гидролиз с образованием оксокомплексов, что описывается следующими равновесиями:
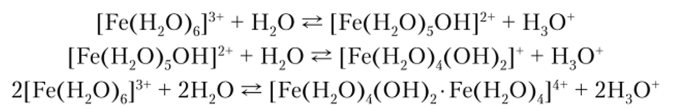
Двухъядерный комплекс [Fe (H.;0)/i(0H)v Fe (H20)J/i+ описывается следующей вероятной структурой (рис. 18.2).
При повышении pH до 2—3 в растворе появляются не только двухъядерные комплексы, но и более конденсированные структуры, образующие коллоидные гели.
Безводные соли имеют окраску, зависящую от природы аниона: FeF3 — зеленоватую, FeCl3 — черно-коричневую, Fe (SCN)3 — кроваво-красную.
![Вероятная структура комплекса [Fe(H0)(0H)«Fe(H0)].](/img/s/8/61/1387861_19.png)
Рис. 18.2. Вероятная структура комплекса [Fe (H20)4(0H)2«Fe (H20)4]4+.
Железо (Ш) образует аммиакаты типа [Fe (NH3)6]Hal3, которые менее устойчивы, чем аммиакаты железа (Н). Анионные комплексы Me3[Fe (OH)6] устойчивы и легко образуются в растворах концентрированных щелочей.
При сплавлении оксида или гидроксида железа (Ш) со щелочами и карбонатами образуются ферриты:
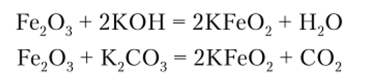
Приведенная реакция указывает на амфотерные свойства Fe203. Такие свойства проявляют и другие соединения Fe3 образующие анионные комплексы, из которых наиболее устойчивым является гексацианоферрат (1П) [Fe (CN)6]3. Производные этого анионного комплекса получают окислением соответствующих гексацианоферратов (И).
Наибольшее значение имеет K3[Fe (CN)6] — красная кровяная соль, являющаяся реактивом на катион Fe2+ и образующая с ним интенсивно синий осадок.
Образование осадка:

Состав турнбулевой сини в растворе:
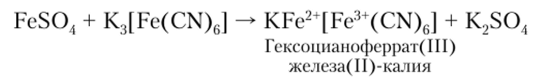
Детальное изучение турнбулевой сини и берлинской лазури показало, что в растворе берлинская лазурь постепенно превращается в турнбулеву синь. Это объясняется тем, что между желтой кровяной солью и ионом железа (Ш) в растворе протекает окислительно-восстановительная реакция:
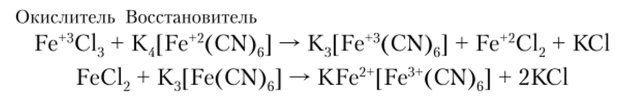
Суммарно имеем.
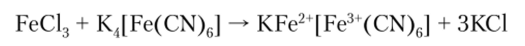
В последнем уравнении 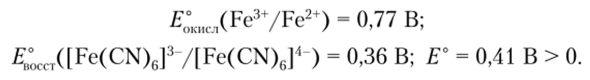
Соединения Fe (III) являются окислителями и восстанавливаются до Fe (II): 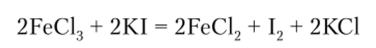
Окислительные свойства [Fe (CN)6]3" проявляются и в реакции с Н202:
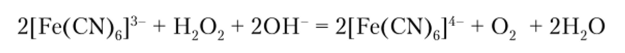
Характерным свойством железа как переходного d-элемента является его способность образовывать комплексы с СО. Простейшим из этого ряда является пентакарбонил железа [Fe (CO)-], имеющий структуру тригональиой бипирамиды с атомом железа в центре. Получают его взаимодействием восстановленного железа с СО:
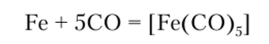
Это соединение в обычных условиях представляет собой желтую летучую жидкость, растворимую в неполярных органических растворителях и нерастворимую в воде. Известны также полиядерные карбонилы железа: Fe2(CO)g и Fe3(CO)12, в которых атомы железа связаны как непосредственно, так и через мостики СО (рис. 18.3).
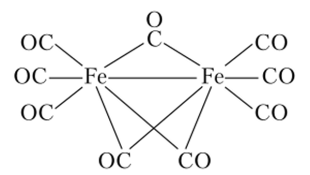
Рис. 183. Структура полиядерного карбонила железа Fe2(CO)9.
Карбонилы железа могут участвовать в реакциях окисления-восстановления:
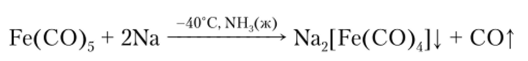
При действии сильных оснований образуется тетракарбонилжелезная (П) кислота:
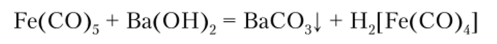
Ион [Fe (CO)J2_ рассматривается как производное железа в степени окисления -2. Эта реакция характеризуется высокой чувствительностью и применяется для обнаружения ионов Fe2+.
Среди соединений железа (У1) лучше всего изучен тетраэдрический оксоанион Fe02~, образующийся при окислении Fe203 ?zH20, или железной пудры, при сплавлении со щелочью:
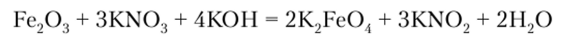
Образующиеся ферраты — кристаллические вещества красного цвета, по структуре и свойствам напоминающие хроматы и сульфаты. Натриевые и калиевые соли достаточно хорошо растворимы в воде, но с катионами Ва2+ и Sr2+ ион FeO2- образует нерастворимые осадки.
Ион Fe04" парамагнитен и имеет два неспаренных электрона. Соответствующая этому аниону железная кислота H2Fe04 в свободном состоянии не получена. Ион Fe04~ устойчив в щелочных растворах, но в нейтральной и кислой среде легко разлагается с выделением кислорода:
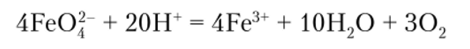
Fe04 — сильный окислитель, превосходящий даже Мп04, и может окислить, например, NH3 до N2, а Сг (П) до СЮ4".
Биологическая роль железа. Железо — жизненно важный элемент; в крови человека на долю гемоглобина приходится 14,5%. Две важнейшие функции соединений железа — перенос кислорода и участие в цепи переноса электрона. Важнейшими структурами, содержащими железо, являются гем-белки. Гем выполняет свои биологические функции, будучи связан с молекулой белка. Различают следующие гем-белки: гемоглобины, миоглобины, цитохромы, ферменты, такие как каталаза и пероксидаза. Гемоглобин, связывая кислород, переносит его из легких к мышцам, где они передаются миоглобину, после чего, связывая С02, переносит его в легкие. Нехватка железа в организме приводит к таким заболеваниям, как анемия и малокровие, для профилактики и лечения которых широко используется восстановленное железо, а также ряд соединений железа (FeS04*7H20; железо лактат, железо глицерофосфат и др.).
FeCl3 применяется как дезинфицирующее и кровоостанавливающее средство.