Хром.
Общая и неорганическая химия

Наиболее многочисленными являются комплексы с аминами в качестве лигандов. Среди них обнаружены соединения со всевозможными типами изомерии. Кроме моноядерных комплексов, например2+, могут существовать и полиядерные, в которых два и более атомов металла связаны с помощью гидроксильных мостиков. Состав катионных комплексов Сг (Ш) может изменяться в зависимости от pH, температуры и концентрации… Читать ещё >
Хром. Общая и неорганическая химия (реферат, курсовая, диплом, контрольная)
Историческая справка Минерал, содержащий хром, был открыт в 1766 г. И. Г. Леманом и назван «сибирским красным свинцом». В настоящее время этот минерал известен под названием крокоит РЬСг04. В 1797 г. французский химик Л. Вокелен выделил металлический хром.
Содержание хрома в земной коре составляет около 8−10_3% от общего числа атомов. Важнейшим минералом, служащим сырьем для получения хрома, является хромистый железняк FeO • Сг203.
Металлический хром получают восстановлением его из оксида с помощью алюминия (алюминотермия):
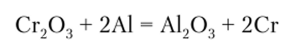
С этой целью используют хромистый железняк. Вначале его сплавляют с содой в присутствии кислорода, и далее образующий хромат натрия восстанавливают углеродом до оксида хрома:
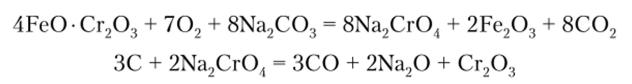
Свойства хрома и его соединений. Хром — белый, с сероватым оттенком блестящий металл, имеющий большую твердость и упругость. При комнатной температуре стоек к воде и воздуху.
В химическом отношении хром как металл является восстановителем. В зависимости от условий реакции он может проявлять переменную степень окисления; устойчивыми являются состояния +2, +3, +6.
При нормальных условиях хром устойчив к кислороду, взаимодействие с которым протекает лишь при нагревании. В этих же условиях хром реагирует и с хлором, серой, азотом, кремнием. Например:

Обычно на поверхности хрома содержится плотный слой оксида Сг203, защищающий металл от дальнейшего окисления. Такая пассивированная поверхность и является причиной того, что при обычных температурах не происходит взаимодействия хрома с азотной кислотой и царской водкой.
С разбавленными соляной и серной кислотами хром реагирует с выделением водорода и образованием солей Сг (П), которые, быстро окисляясь, переходят в соли Сг (Ш): 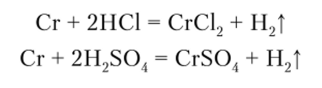
Соединения хрома чаще всего имеют следующее пространственное строение:
Сг (И) —-конфигурация Сг (Ш) — «^-конфигурация. | Октаэдрические структуры: [Сг (Н20)6]2+, [Cr (NH3)6]3+ |
Cr (IV) — ^-конфигурация. | Тетраэдрические структуры; характерны для соединений, где Cr (IV) связан с органическими радикалами. |
Cr (V) — d '-конфигурация Cr (VI) — (^-конфигурация. | Тетраэдрические структуры; СгОф, СгО2, Сг03 |
С кислородом хром образует ряд оксидов, которые в зависимости от степени окисления металла проявляют основные, амфотерные или кислотные свойства.
Оксид хрома (П) СгО обладает основными свойствами. При взаимодействии с НС1 образует СгС12.

Под действием водорода СгО восстанавливается до металлического хрома, при нагревании под действием кислорода воздуха переходит в Сг., 0:1.
Оксиду СгО соответствует гидроксид Сг (ОП)2, образующийся из СгС12:
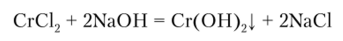
Сг (ОН)2 — вещество желтого цвета. Имеет основный характер и в реакциях с кислотами образует соответствующие соли Сг (П).
Ион Сг2+ является настолько сильным восстановителем, что способен вытеснять водород из воды:
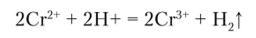
Кислородом воздуха Сг (П) легко окисляется, поэтому раствор СгС1:!, например, можно применять для поглощения кислорода:

Водные растворы соединений Сг (П) имеют голубой цвет.
Оксид хрома (Ш) Сг203 относится к амфотерным оксидам.
Его получают прокаливанием оксида хрома (У1), или разложением дихромата аммония, или термическим разложением гидроксида хрома (Ш):
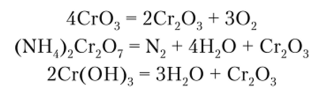
Гидроксид хрома (Ш) Cr (OH);j получается при действии щелочей на соли хрома; при этом Сг (ОН)3 выделяется в виде осадка синевато-серого цвета:
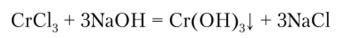
Сг (ОН)3 обладает амфотерными свойствами. Подобно гидроксиду алюминия Сг (ОН)3 взаимодействует с кислотами с образованием солей Сг (Ш), а со щелочами — с образованием хромитов:
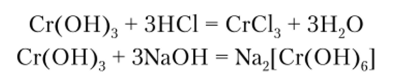
Метаили ортохромиты, являющиеся солями соответствующих кислот — НСг02 (метахромистая) и Н3Сг03 (ортохромистая), образуются при сплавлении оксида хрома (Ш) со щелочами или с содой:

Следовательно, Сг (ОН)3 следует рассматривать как амфотерный гидроксид:

Под действием сильных окислителей в щелочной среде соединения хрома (Ш) переходят в соединения хрома (У1) — хроматы:

Для иона Сг3* характерны многочисленные комплексные соединения, в которых, за редким исключением, проявляется координационное число 6. Основной признак этих комплексных соединений — их кинетическая устойчивость в водных растворах.
Гексааква-ион [Сг (Н20)6]3+ сине-фиолетового цвета входит в состав многих кристаллогидратов: CrCl3-6H20, KCr (S04)2-12Н20 и т. д. Получение этого катионного комплекса можно выразить следующим уравнением:
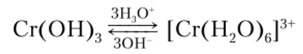
Состав катионных комплексов Сг (Ш) может изменяться в зависимости от pH, температуры и концентрации, в связи с чем их окраска изменяется от фиолетовой до зеленой. По мере замещения молекул Н20 в комплексном катионе, например, на хлор могут образоваться различные изомерные формы СгС13 • 6Н20:
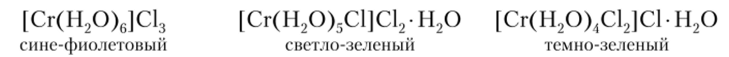
Наиболее многочисленными являются комплексы с аминами в качестве лигандов. Среди них обнаружены соединения со всевозможными типами изомерии. Кроме моноядерных комплексов, например [Cr (NH3)5Cl]2+, могут существовать и полиядерные, в которых два и более атомов металла связаны с помощью гидроксильных мостиков.
Анионные комплексы — хроматы — разнообразны, но своему составу и могут быть получены с помощью следующих реакций:
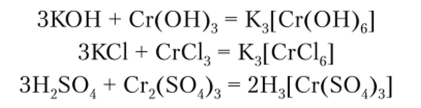
Окраска анионных комплексов зависит от природы лиганда: [Cr (OH)G]3_ — изумрудно-зеленого цвета, [СгС16]3_ — розово-красного, a [Cr (S04)3]3_ — желтого.
Анионный комплекс [Сг (ОН)6]3- образует многочисленные соли — гидроксохроматы, устойчивые в твердом состоянии, а в растворах — лишь в сильнощелочной среде.
Безводные соединения Сг (Ш) по структуре и свойствам отличаются от кристаллогидратов. Так, безводная соль СгС13 имеет полимерную слоистую структуру, тогда как СгС13-6Н20 — островную структуру. СгС13 в отличие от СгС13-6Н20 в воде растворяется очень медленно. Соединения Сг (ПТ) в водных растворах обычно гидролизуются, и на первой стадии этого процесса идет образование комплексного иона [Сг (Н20)0Н|3+:
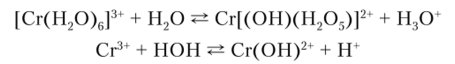
В дальнейшем может происходить полимеризация этих комплексов. Сульфид Cr2S3 и карбонат Сг2(С03)3 характеризуются еще большей неустойчивостью. Так, Cr2S3 и Сг2(С03)3 нельзя получить из водного раствора путем обменных реакций, ибо эти соединения вследствие большей растворимости по сравнению с Сг (ОН)3 полностью гидролизуются:
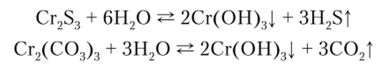
Оксид хрома (У1) Сг03 представляет собой кристаллическое вещество темно-красного цвета. Он получается действием концентрированной H2S04 на дихроматы:
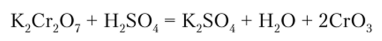
Сг03 имеет цепочечную структуру, образованную тетраэдрами Сг04.
Сг03 — типичный кислотный оксид. Он легко растворяется в воде с образованием раствора хромовой кислоты Н2Сг04 и двухромовой кислоты 112Сг207, между которыми устанавливается равновесие:

С увеличением разведения равновесие сдвигается в сторону образования НСг04
В щелочных растворах при pH > 7 Сг03 образует тетраэдрический хромат-ион Сг ()4 желтого цвета. В интервале pH от 2 до 6 существуют в равновесии ион НСг04 и оранжево-красный дихромат-ион Сг20| .
При pH < 1 преобладают молекулы Н2Сг04. Система равновесных процессов может быть представлена так:

В щелочной среде протекают такие процессы: 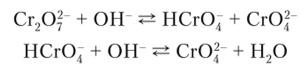
Положение равновесия зависит не только от pH, но и от характера катионов, которые могут образовать нерастворимые хроматы (катионы Ва2+, РЬ2+ и Ag* образуют хроматы).
Таким образом, добавление кислот смещает равновесие влево, а прибавление щелочей — вправо:

На этом основано получение хроматов из дихроматов, и наоборот:
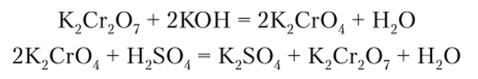
Соединения Cr (VI) являются окислителями. В кислой среде дихроматион Сг202 проявляет сильные окислительные свойства, восстанавливаясь до Сг (Ш):

Высокая окислительная активность Cr (VI) проявляется в реакции взаимодействия К2Сг207 с концентрированной НС1 при нагревании:

Эта реакция удобна для получения хлора в небольших количествах. При прекращении нагревания прекращается и выделение хлора. Действием очень сильных восстановителей производные Cr (VI) могут быть восстановлены в нейтральной и слабощелочной средах. Например, взаимодействие с (NH^S протекает при нагревании:
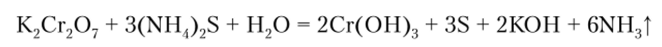
Необходимо отметить, что окислительные свойства Cr (VI) в щелочной среде выражены значительно слабее, чем в кислой. Таким образом, в кислых и щелочных растворах соединения Сг (Ш) и Cr (VI) существуют в разных формах: в кислой среде преобладают ионы Сг3+ или Сг702-, а в щелочной — ионы |Сг (ОН)(.|3 или СгО2, в связи с чем взаимопревращение соединений Сг (Ш) в Cr (VI) и наоборот протекает в зависимости от реакции среды:
в кислой среде.
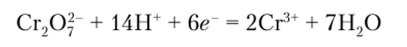
в щелочной среде.

Из этого следует, что в кислой среде выражены окислительные свойства Cr (VI), а в щелочной среде — восстановительные свойства Сг (Ш):
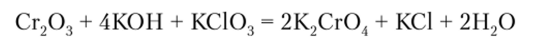
Хромовая кислота Н2Сг04 значительно слабее дихромовой кислоты. Так, для Н2СгО, К, = 3 • 10 7, а для Н2Сг207 К, = 2 • 10″ 2.
Н2Сг207 — простейший представитель изополикислот хрома, отвечающих общей формуле пЭ03 тН20 (где п > т) и известных в виде солей иолихроматов. Так, кроме оранжево-красных дихроматов (т = 1, п = 2) получены темно-красные трихроматы (т = 1, п = 3) и коричнево-красные тстрахроматы (w = 1, п = 4).
Полихроматы образуются при действии кислот на хроматы:
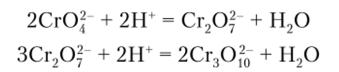
При действии щелочей на растворы иолихроматов происходит обратный процесс с образованием в конечном итоге хроматов.
Больших серий поликислот и полианионов Cr (VI) не образует, что объясняется размерами иона и его тенденцией к образованию кратных связей Сг=0.
Для хрома характерно образование нероксидных соединений при взаимодействии с Н202:

Кроме синего оксид-дипероксида хрома (У1) СгОхром образует соли пероксокислот Н2Сг2012, Н2Сг208 и Н2СгОв следующей структуры (рис. 16.1).
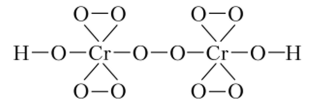
Рис. 16.1. Структура пентапероксодихромовой кислоты Н2Сг2012.
Кислота Н2Сг20|2 образует соли, окрашенные в синий цвет, а П, Сг, 08 — в красный.
Пероксидные соединения хрома устойчивы в эфирном растворе, в водных растворах они нестойки и легко разлагаются с выделением О., и образованием ионов Сг ()3 (в щелочной среде) или соединений Сг (1П) (в кислой). Предполагается, что устойчивость оксид-дипероксида хрома (У1) Сг05 в эфире обусловлена образованием комплекса, имеющего форму пснтагональной пирамиды с атомом кислорода в вершине (рис. 16.2).
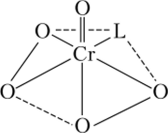
Рис. 16.2. Структура оксид-дипероксида хрома (У1) Сг03 в эфире, где L — молекула эфира или воды Этот комплекс может быть получен обработкой раствора дихромата пероксидом водорода в кислой среде:
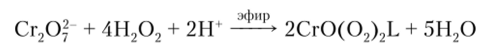
По окрашиванию эфирного слоя в синий цвет можно судить об образовании пероксокомплекса. Эта реакция очень чувствительна и специфична и поэтому широко используется в аналитической химии для обнаружения дихромат-иона.
Качественные реакции на хромат-ион (Сг04~).
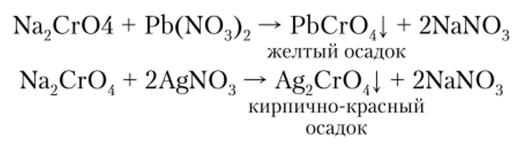
Техническое применение хрома общеизвестно: в качестве легирующей добавки хром широко используется для получения высокопрочных сталей, никелевых и медных сплавов. Хроматы и дихроматы широко используются в кожевенной, текстильной, лакокрасочной pi фармацевтической промышленности. Хромат свинца РЬСг04 под названием желтый крои применяется для изготовления красок. Дихроматы К2Сг207 и Na2Cr207-2H20, известные под названием хромпиков, применяются в аналр1тической химии.
Смесь равных объемов насыщенного на холоду раствора К2Сг207 и концентрированной H2S01 называется хромовой смесью и применяется для энергичного окисления.
Все соединения хрома очень ядовиты!