Химия Лавуазье и Дальтона

Связь между идеальными химическими веществами и отвечающими им соединениями вводится посредством еще двух пар важных определений. Во-первых, вводятся понятия простого и составного вещества. Вещества делятся на «простые» (или «элементы») и «составные» (или «соединения») (разные химики пользуются здесь разной терминологией, не всегда четко разводя понятие соединения и вещества. — А. Л.). «Вещество… Читать ещё >
Химия Лавуазье и Дальтона (реферат, курсовая, диплом, контрольная)
Следуя объектному подходу (см. гл. 9), попробуем ответить на вопрос «Что такое химия» и чем она отличается от физики.
Для химии XIX в. (химии Лавуазье и Дальтона) группа понятий, входящих в модельную часть теоретической части ее оснований (ОРН), существенно сложнее, чем в физике, — их существенно больше, и связи их многообразнее. Первая тройка состоит из понятий химических атомов, химических связей и химических соединений, где химические соединения представляют собой ансамбли определенным образом связанных между собой атомов (простейший пример — химическая молекула, более сложные случаи см. в работе [5]). К этим трем понятиям добавляется понятие идеального «химического вещества», которое характеризуется набором свойств произвольной природы. Химические вещества — это гомогенные или гетерогенные (коллоиды и др.) вещества в различных фазах, отличающиеся друг от друга разнообразными химическими (способностью превращаться друг в друга) и нехимическими свойствами. Спектр свойств весьма широк: от неопределенных, опирающихся на человеческие чувства вкуса и запаха (характерные для периода становления химии) до очень четко и точно количественно измеряемых физических свойств (превалирующих сегодня). Список свойств открыт и постоянно увеличивается. Эти свойства играют роль измеримых величин и задаются операционально (они в основном внешне заданы по отношению к теоретической части химии). Химия стремится к установлению однозначного соответствия между набором свойств химического вещества и системой химических атомов и связей, определяющих химическое соединение (это отражают многомерные диаграммы состав — структура — свойства).
Связь между идеальными химическими веществами и отвечающими им соединениями вводится посредством еще двух пар важных определений. Во-первых, вводятся понятия простого и составного вещества. Вещества делятся на «простые» (или «элементы») и «составные» (или «соединения») (разные химики пользуются здесь разной терминологией, не всегда четко разводя понятие соединения и вещества. — А. Л.). «Вещество, которое можно разложить на два или несколько других веществ, называют соединением. Вещество, которое нельзя разложить, называют элементарным веществом (элементом)», — пишет в современном учебнике химии дважды нобелевский лауреат Л. Полинг [20, с. 17]. Во-вторых, с ними связываются понятия молекулы и атома. Понятием химической молекулы определяется минимальное количество вещества, обладающего всеми свойствами этого вещества. Молекулы простого вещества состоят из одинаковых атомов. Сколько атомов в такой молекуле, выясняется из анализа тех химических превращений (реакций), в которой она участвует.
Определение элемента, или простого тела, дал еще Р. Бойль в 1661 г. Хотя он не назвал ни одного примера реального элемента в новом понимании, его определение было постепенно признано многими химиками XVIII в. Во второй половине XVIII в. суть этого понятия вполне адекватно изложена Макером: «Я положил, что будто бы все тела разрушены и приведены к самым простейшим их началам, дабы, узнав главные свойства сих первых начал, можно было по ним исследовать различные их соединения и иметь некоторое главное познание о свойствах сложенных тел, которые из соединения оных происходят». В 1787 г. Лавуазье высказал следующее определение понятия «простое тело». По его мнению, следует называть «простыми все тела, которые мы не можем разложить, которые мы получаем в последнем итоге путем химического анализа. Несомненно, настанет день, когда эти вещества, являющиеся для нас простыми, будут в свою очередь разложены… Но наше воображение не должно опережать факты» 123, т. 1, с. 361—362]. Дальтон приводит ряд конкретных правил для выявления простых и составных тел: «Следующие главные правила могут быть приняты в качестве руководства во всех наших исследованиях, относящихся к химическому синтезу: 1. Если возможно получить только одно соединение (combination) из двух веществ (bodies), можно предположить, что оно будет двойным, если отсутствуют какие-либо данные, свидетельствующие о противном. 2. Если наблюдалось два соединения, следует предполагать, что они двойные и тройные…» ([23, т. 2, с. 45]).
Итак, через понятия простого и составного вещества вводятся понятия химического атома (подобно тому, как была введена минимальная порция электричества).
При этом Дальтон — отец химического атомизма — исходил из модели «физического атомизма», он начинал с исследования газовых смесей. Он утверждал, что «элементарные частицы (ultimate particles) всех однородных тел (bodies) абсолютно подобны по весу, форме и т. д. Другими словами, любая частица воды подобна другой частице воды, любая частица водорода подобна другой частице водорода и т. д.» [25, с. 113]. Кроме того, он конструирует модели составных атомов (молекул) из простых атомов (обозначая их кружочками):
«1 атом сорта А + 1 атом сорта В = 1 атом сорта С, бинарного;
1 атом сорта Л + 2 атома сорта В = 1 атом сорта Д тернарного…" [25, с. 163−1641).
Так выглядит его теоретическая модель. Но он описывает и конкретные эмпирические процедуры для воплощения этой химической модели в эмпирический материал, т. е. способ распознавать химическими средствами простые и составные «химические тела» [25, с. 1671. В этой модели существенно, что атомы бывают разных сортов (относятся к разным элементам).
Следующим необходимым элементом исходной системы понятий является понятие химического превращения одних химических соединений (и веществ) в другие (химической реакции):
{соединения (вещества)}! => {соединения (вещества)}2. (18.1.1).
«Если определить химическую реакцию как процесс, в результате которого одно химическое соединение превращается в другое (или некоторая совокупность соединений переходит в другую совокупность), то к числу важнейших систем базисных химических индивидов целесообразно причислить многообразие химических реакций» [5|. Структура (18.1.1) играет в химии роль, подобную структуре {5Л(^) —> 5^(?2))} в физике. Химические формулы составляют соответствующий математический слой. Так выглядит теоретическая часть для химии, отвечающая схеме, изображенной на схеме 9.2.1.
В определение понятия идеального химического вещества входит возможность его реализации в виде эмпирического вещества. Эмпирические вещества в виде жидкостей, газов или твердых тел, обладающих соответствующими свойствами, являются эмпирической реализацией (материализацией) «химических веществ» (с определенной точностью, «чистотой»). Эмпирические вещества — то, что «приготовляется» и «измеряется» в химии.
Их приготовление и измерение (т.е. отождествление эмпирического вещества с определенным «химическим веществом» и отвечающим ему соединением) — дело аналитической химии, которая согласно одному из современных определений является «научной дисциплиной, разрабатывающей и применяющей методы, инструменты и стратегии получения информации о составе (composition) и природе (nature) вещества в пространстве и времени» [27]. «Аналитическая химия — наука об определении химического состава и, в некоторой степени, химического строения соединений. Алхимики XIV—XVI вв. впервые применили взвешивание и выполнили огромный объем экспериментальных работ по изучению свойств веществ, положив начало химическому методу анализа. В XVI—XVII вв. появились новые химические способы обнаружения веществ, основанные на реакциях в растворе… Родоначальником научной аналитической химии считают Р. Бойля, который ввел понятие „химического анализа“… До первой половины XIX в. аналитическая химия была основным разделом химии», — пишет в статье «Аналитическая химия» Ю. А. Золотов в работе |4|.
С помощью аналитической химии из «базового множества химических веществ и их превращений» определяется набор атомов и связей. В отличие от атомов, число сортов которых довольно быстро устоялось (в химических соединениях присутствует не более 80 разных сортов атомов), множество химических связей чрезвычайно велико и продолжает расти1. Поскольку набор связей открыт, постольку в принципе открыто и «базовое множество», но практически оно в основном сформировалось уже к началу XIX в.[1][2]
В результате ОРН химии образует следующая замкнутая система совместно определяемых исходных химических понятий, отображенная на схеме 18.1.1: «химические атомы» разных сортов, «химические связи», «химические соединения», «химические вещества», «простое» и «составное» вещество, математический слой М{}, изображенное горизонтальной стрелкой «химическое превращение» (химическая реакция) — в теоретической части (Т), «эмпирические вещества» — в операциональной части (ЭМ), где индексы «1» и «2» отвечают, соответственно операциям приготовления и измерения. Так выглядит ОРН для химии Лавуазье — Дальтона — аналог изображенного на схеме 9.1.2 ОРН для физики. Сравнение этих двух схем дает пример различий на уровне разных наук (дисциплин): разные типы процессов и ПИ О.
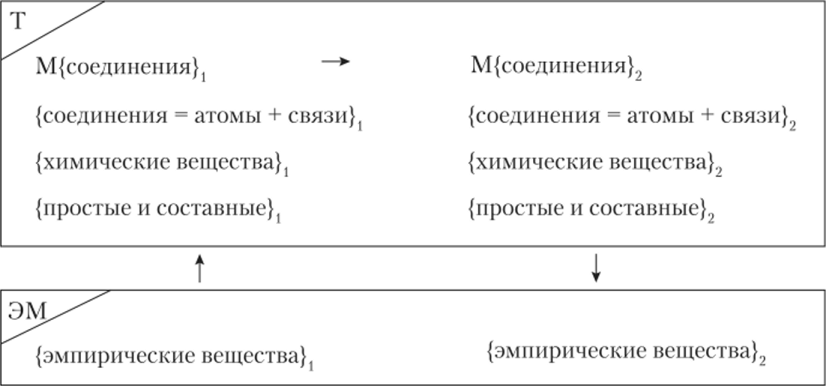
Схема 18.1.2. Основания химии.
Затем, используя определенные в рамках ОРН атомы и связи, создается расширяющееся множество химических соединений и соответствующее расширяющееся множество химических веществ (это отвечает ВИО-типу работы). Этот процесс идет полуэмиирическим путем, но описывается с помощью химических атомов, играющих роль ПИО химии. В рамках ВИО-типа работы строят разнообразные химические соединения и изучют «не только химические реакции, но и функциональные зависимости вида р=р (Х), где X — по-прежнему химическое вещество, а р — какое-либо свойство. Это может быть и такое „химическое“ свойство, как реакционная способность, и такое физическое свойство, как температура плавления или электропроводность…» [5][3].
- [1] Существует удобная, но грубая классификация, согласно которой связи могут различаться качественно (ковалентные (большинство), ионные, металлические и к ним добавляютваи-дер-ваальсовы) и количественно (валентность и др.).
- [2] Речь идет о простейшей «химии состава». В понятие «соединение» в органическойхимии добавляется структура (структурная химия), позволяющая отличать уголь от алмаза, а в понятие химической реакции вводится понятие скорости химической реакции, позволяющее ввести понятие катализатора и ингибитора (подробнее эти и другие усложнения рассматриваются в работах [9, 14, 5]). По все это не меняет вид структуры (схема 18.1.2) и логикипостроения ОРН в химии, хотя требует некоторого расширения «базового множества».
- [3] При этом «функциональные зависимости вида р = р (Х)» или «свойства как функцияприродного вещества» П. М. Зоркий вообще кладет в основу определения химии как науки, как научного предмета [5|. Такой взгляд естественен, если исходить из эмпиристской философии, для которой существует только ВИО-тип работы.