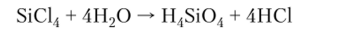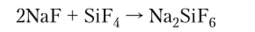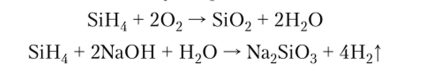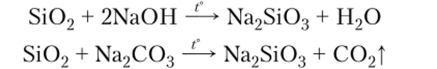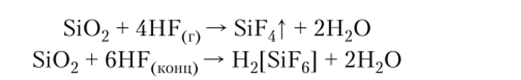Кремний образует соединения типа SiX4 со всеми галогенами и водородом: фторид и хлорид при обычных условиях — газы; бромид — бесцветная жидкость; иодид — белые кристаллы. Все галогениды кремния, кроме SiF4, быстро и полностью гидролизуются:
Тетрафторид кремния SiF4 используется для получения фторосиликатов:
Гексафторосиликат натрия Na2SiF6 растворим в воде, ядовит, используется для фторирования воды.
Силаны
Соединения кремния с водором имеют общую формулу Si"H2«+2.
Моносилан SiH4 — бесцветный газ, более реакционноспособный, чем СН4, легко самовоспламеняется па воздухе, проявляет восстановительные свойства:
Оксид кремния
Кремний не образует двойные связи Si=Si и Si=0, так как вследствие его большого радиуса перекрывание р-орбиталей с образованием л-связей невозможно. Поэтому молекула Si02 не существует, а оксид кремния представляет собой макромолекулу, в которой каждый атом кремния окружен четырьмя атомами кислорода, а каждый атом кислорода связан, в свою очередь, с атомом кремния. Оксид кремния — твердое тугоплавкое вещество, имеющее атомную кристаллическую решетку. В природе существует в виде минерала кварца и его разновидностей (горный хрусталь, халцедон, яшма).
Химические свойства. Оксид кремния — кислотный оксид, но нс реагирует с водой и водными растворами щелочей. Кислотные свойства его проявляются в реакциях с расплавленными щелочами и солями летучих кислот:
При высоких температурах оксид восстанавливается до кремния (см. выше — получение в промышленности и в лаборатории).
В обычных условиях с оксидом кремния реагирует только раствор фтороводорода: 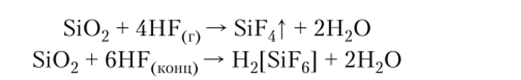
Гексафторокремниевая кислота H2[SiF6] — в водном растворе сильная двухосновная кислота, при диссоциации она образует устойчивый комплексный анион [SiF6|2-.