Состав углеводородной смеси
Для водорода: = 22 183,1 * 0,002 = 44,37 кгч Для метана: 22 183.1 0,094 = 2085,21 кгч Для этилена: 22 183.1 0,112 = 2484,51 кгч Для этана: 22 183.1 0,014 = 310,56 кгч Для пропилена: 22 183.1 0,566 = 12 555,64 кгч Для пропана: 22 183.1 0,048 = 1064,79 кгч Для бутана: 22 183.1 0,131 = 2905,99 кгч Для пентана: 22 183,1 0,032 = 709,86 кгч Для бензола: 22 183.1 0,001 = 22,18 кгч Проверим полученные… Читать ещё >
Состав углеводородной смеси (реферат, курсовая, диплом, контрольная)
Таблица 1.
№. п/п. | НАИМЕНОВАНИЕ. | М. | Кгч. | Критические параметры. | ||
Т, С. | МПа. | |||||
1. | Н2 | 44,37. | — 239,89. | 1,28. | ||
2. | СН4 | 2085,21. | — 82,09. | 4,58. | ||
3. | С2 Н4 | 2484,51. | 9,91. | 5,05. | ||
4. | С2 Н6 | 310,56. | 32,31. | 4,82. | ||
5. | С3 Н6 | 12 555,64. | 91,81. | 4,56. | ||
6. | С3 Н8 | 1064,79. | 96,81. | 4,20. | ||
7. | н-С4 Н10 | 2905,99. | 153,01. | 3,75. | ||
8. | С5 на н-пентан. | 709,86. | 196,61. | 3,33. | ||
9. | Бензол. | 22,18. | 289,51. | 4,86. | ||
ИТОГО. | 22 183,1. | |||||
- 2. Годовая производительность, тн — 189 000
- 3. Число часов непрерывной работы в году — 8520
- 4. Начальное давление, ати — 0,6
- 5. Начальная температура, 0С: — 16
- 6. Хладагенты:
оборотная вода с начальной температурой, оС…25.
пропиленовый холод, параметр,оС …6.
пропиленовый холод, параметр,оС …(-18).
пропиленовый холод, параметр,оС …(-37).
этиленовый холод, параметр,оС …(-56).
этиленовый холод, параметр,оС …(-99).
Переведем исходное давление в систему СИ, для этого избыточное давление преобразуем в абсолютное:
Р = 1 + 0,6 = 1,6 атм.
В системе СИ давление имеет размерность Па, следовательно:
Р = 1,6: 10 = 0,16 МПа.
Для того чтобы определить способ для разделения углеводородной смеси, необходимо знать фазовое состояние исходной смеси.
Фазовое состояние можно определить, сравнивая температуру критическую углеводородной среды с исходной температурой, т.к. критическая температура определяет границы фазового состояния. Критическая температура является величиной аддитивной, следовательно, определяется как сумма произведений мольной доли каждого компонента на его критическую температуру:
Зная мольные доли и критические температуры каждого компонента, мы можем найти критическую температуру смеси. Для этого необходимо найти общую производительность:
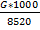
= = 189 000 * 1000 / 8520 = 22 183.1 кгч.
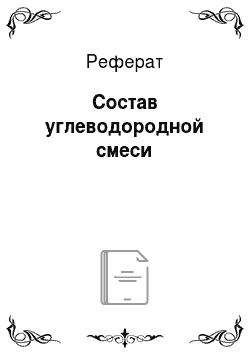
Далее найдем производительность по каждому отдельному компоненту в смеси. Для этого общую производительность умножим на вес каждого компонента в смеси:
Для водорода: = 22 183,1 * 0,002 = 44,37 кгч Для метана: 22 183.1 0,094 = 2085,21 кгч Для этилена: 22 183.1 0,112 = 2484,51 кгч Для этана: 22 183.1 0,014 = 310,56 кгч Для пропилена: 22 183.1 0,566 = 12 555,64 кгч Для пропана: 22 183.1 0,048 = 1064,79 кгч Для бутана: 22 183.1 0,131 = 2905,99 кгч Для пентана: 22 183,1 0,032 = 709,86 кгч Для бензола: 22 183.1 0,001 = 22,18 кгч Проверим полученные результаты, найдя сумму полученных производительностей по каждому компоненту:
= 44,37 + 2085,21 + 2484,51 + 310,56 + 12 555,64 + 1064,79 + 2905,99 + 709,86 + 22,18 = 22 183,1кг/ч.
Полученный результат сходится с первоначальным, следовательно, производительность посчитана верно.
Далее нам необходимо рассчитать молярный расход каждого компонента. Для этого производительность каждого компонента нужно разделить на молярный вес этого компонента:
Водород:
Х = 44.37 / 2 = 22,185 кмоль/час Далее все оставшиеся компоненты рассчитываются подобно, а результаты вносятся в таблицу 2.
Определяем мольную долю каждого компонента в смеси:
Водород:
22.185 • 100 / 634,98 = 3,50%.
Далее все оставшиеся компоненты рассчитываются подобно, а результаты вносятся в таблицу 2.
Чтобы перевести температуры из К в °С нужно вычесть 273.15.
Водород:
33,6 — 273,15 = -239,89°С Далее все оставшиеся компоненты рассчитываются подробно, а результаты вносятся в таблицу 2.
Чтобы найти Х`(мольный вес) нужно:
Водород:
3,5/100 = 0,035.
Далее все оставшиеся компоненты рассчитываются подробно, а результаты вносятся в таблицу 2.
Теперь находим Т крит по формуле: Х`i .Т крит
Водород:
0,035 • (-239,89) = (-8,40) °С Далее все оставшиеся компоненты рассчитываются подробно, а результаты вносятся в таблицу 2 и складываются.
№. П/П. | НАИМЕ-НОВ; АНИЕ. | %,. вес. | х, вес. | М. | Кг/ч. | Кмоль/ч. | %,. Мол. | Крит. параметра. | Х`. | Х`i .Т крит. | ||
t, 0С. | Р, МПа. | |||||||||||
1. | Н2 | 0,2. | 0,002. | 44,37. | 22,185. | 3,50. | — 239,88. | 1,28. | 0,035. | — 8,40. | ||
2. | СН4 | 9,4. | 0,094. | 2085,21. | 130,33. | 20,52. | — 82,09. | 4,58. | 0,2052. | — 19,85. | ||
3. | С2 Н4 | 11,2. | 0,112. | 2484,51. | 88,73. | 13,97. | 9,91. | 5,05. | 0,1397. | 1,38. | ||
4. | С2 Н6 | 1,4. | 0,014. | 310,56. | 10,352. | 1,65. | 32,31. | 4,82. | 0,0163. | 0,53. | ||
5. | С3 Н6 | 56,6. | 0,566. | 12 555,64. | 298,94. | 47,08. | 91,81. | 4,56. | 0,4708. | 24,22. | ||
6. | С3 Н8 | 4,8. | 0,048. | 1064,79. | 24,20. | 3,86. | 96,81. | 4,20. | 0,0381. | 3,69. | ||
7. | н-С4 Н10 | 13,1. | 0,131. | 2905,99. | 50,10. | 7,8. | 152,01. | 3,75. | 0,078. | 8,94. | ||
8. | С5 (по н-пентану). | 3,2. | 0,032. | 709,86. | 9,86. | 1,58. | 196,61. | 3,33. | 0,0156. | 3,07. | ||
Бензол. | 0,1. | 0,001. | 22,18. | 0,28. | 0,04. | 289,51. | 4,86. | 0,0004. | 0,12. | |||
Итого. | 22 180,1. | 634,98. | 13,7. | |||||||||
Так мы получим значение температуры:
Т крит. смеси = 13.7 0С В связи с тем, что критическая температура меньше исходной температуры, следует, что смесь находится в газовом фазовом состоянии.
Подберем наиболее подходящий способ разделения углеводородной смеси.
Адсорбционно-ректификационный считается эффективным для разделения газов с содержанием углеводородов С3 — С5, но в нашем случае необходимо разделить большое число компонентов, в состав которых входит водород, метан, этан, этилен к каждому из которых нужен соответствующий адсорбер. Также невозможно обеспечить непрерывность этого процесса, это значительно усложняет технологический процесс из-за трудностей при транспортировании адсорбента, делает его нецелесообразным из-за больших капиталовложений.
В абсорбционно-ректификационном способе существует аналогичная проблема в подборе абсорбентов, но тут используется жидкий абсорбент, что делает процесс проще в техническом плане. Однако абсорбционно-ректификационный способ значительно проще, его также использовать нецелесообразно, из-за присутствия в нашей смеси водорода, и легких углеводородов, невозможно добиться такой степени чистоты компонентов, как конденсационно-ректификационным способом, т.к. эти компоненты лучше разделить конденсацией. А не столь низкая температура, может только благоприятно сказаться на экономически более целесообразном выборе конденсационно-ректификационного способа.
Рассчитаем для примера критическую температуру МВФ и этилена.
Таблица 3.
Критические параметры для смеси МФВ и этилена.
№. п/п. | Наименование. | кмоль/ч. | x `. | Критические параметры. | ||
t, ° С. | Р, МПа. | |||||
1. | Водород. | 22,185. | 0,035. | — 239,89. | 1,28. | |
2. | Метан. | 130,33. | 0,2052. | — 82,09. | 4,58. | |
3. | Этилен. | 88,73. | 0,1397. | 9,91. | 5,05. | |
1579,76. | — 86,19. | |||||
Критическая температура МВФ =(-124,33° С), но максимально возможный холод — этиленовый, имеет температуру (-99° С), значит, нам нужно утяжелять фракцию, тем самым повышая температуру ее конденсации. Если вместе с МВФ мы выделим весь этилен, то критическая температура смеси будет (-84,19)° С, это означает, что мы сможем добиться режима полной конденсации, используя этиленовый холод.