Функции состояния.
Аксиомы термодинамики

Каждому равновесному (или близкому к равновесному) состоянию, а термодинамической системы соответствуют определенные значения макроскопических параметров. Поэтому эти параметры называют функциями состояния о термодинамической системы. Макроскопические параметры разделяют на внутренние и внешние. Последние характеризуют воздействия, оказываемые на систему со стороны других тел или полей. Например… Читать ещё >
Функции состояния. Аксиомы термодинамики (реферат, курсовая, диплом, контрольная)
Каждому равновесному (или близкому к равновесному) состоянию а термодинамической системы соответствуют определенные значения макроскопических параметров. Поэтому эти параметры называют функциями состояния о термодинамической системы. Макроскопические параметры разделяют на внутренние и внешние. Последние характеризуют воздействия, оказываемые на систему со стороны других тел или полей. Например, внешними параметрами являются напряженности внешних электрического и магнитного полей. Из двух параметров: Р — давление и V — объем, один можно считать внешним. Внешние параметры можно рассматривать как независимые переменные, а внутренние — как их функции.
Термодинамические величины бывают интенсивньши и экстенсивными. Интенсивные параметры макросистемы не зависят от числа частиц в этой системе (или от ее массы) и принимают одно и то же значение для любой части равновесной пространственно однородной термодинамической системы. Такими параметрами являются, например, температура Т и давление Р.
Экстенсивные, или аддитивные параметры при фиксированных значениях интенсивных параметров пропорциональны числу частиц в системе (или ее массе). Примерами аддитивных величин могут служить объем V и внутренняя энергия U системы Аддитивная величина X, характеризующая макроскопическую систему, равна сумме одноименных величин JV*, соответствующих различным макроскопическим частям этой системы: 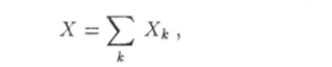
где k = 1, 2, … — номер составной части макросистемы.
Система, которая не взаимодействует ни с какой другой системой, называется замкнутой, или изолированной. Энергия такой системы со временем не изменяется. Строго говоря, совершенно замкнутых систем в природе не существует. В общем случае термодинамические системы могут взаимодействовать между собой и при этом обмениваться энергией. Если объем V некоторой системы изменяется, то в результате совершения окружающими телами работы над этой системой ее энергия также будет изменяться. Над макросистемой можно совершить работу, изменяя значения и других внешних параметров, например, напряженностей внешних электрического или магнитного полей. Однако энергия может быть передана от одной макросистемы к другой и без совершения работы, т. е. при неизменных значениях внешних параметров. Переданная таким образом энергия называется тепловой, или просто теплом, а такой вид передачи энергии — тепловым взаимодействием, или теплообменом. Это взаимодействие есть результат обмена энергией непосредственно между отдельными частицами макросистем.
Система называется адиабатически изолированной, или теплоизолированной, если она не может обмениваться теплом с другими системами. Энергия такой системы изменяется только тогда, когда изменяются значения внешних параметров и при этом совершается работа. Равновесный процесс, протекающий в теплоизолированной системе, называется адиабатическим.
Основу термодинамики составляют утверждения, к которым пришли путем обобщения большого количества опытных данных. Эти утверждения сформулированы в виде аксиом и законов, называемых началами термодинамики.
- 1. Аксиома существования состояния термодинамического равновесия. Для любой макроскопической системы при неизменных внешних условиях возможно состояние термодинамического равновесия, т. е. такое состояние системы, в котором ее внутренние параметры при фиксированных значениях внешних не изменяются с течением времени и из которого она не может выйти самопроизвольно, а только под влиянием внешних воздействий. Неравновесная система при неизменных внешних условиях переходит (релаксирует) со временем в равновесное состояние.
- 2. Аксиома аддитивности энергии. Внутренней энергией U термодинамической системы называется среднее значение ее энергии, измеренное в системе отсчета, относительно которой центр масс системы неподвижен, а сама система не вращается. Внутренняя энергия макроскопи ческой системы складывается из кинетических энергий частиц, входящих в ее состав, и потенциальных энергий взаимодействия этих частиц друг с другом. Во внутреннюю энергию системы не входят кинетическая энергия движения системы как целого и та часть потенциальной энергии частиц, которой они обладают, находясь во внешнем силовом поле. Внутренняя энергия есть функция состояния <�т термодинамической системы,
т.е. каждому макросостоянию системы соответствует определенное значение ее внутренней энергии:

В термодинамике принято считать, что внутренняя энергия макросистемы равна сумме энергий ее макроскопических частей:
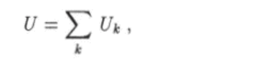
т.е. предполагается, что энергия взаимодействия макроскопических систем так мала по сравнению с энергией каждой из них в отдельности, что ею можно пренебречь.
3. Аксиома существования температуры, или нулевой закон термодинамики. Существует параметр Т, называемый температурой, который характеризует макросистему в состоянии термодинамического равновесия. Этот параметр таков, что равновесные системы, между которыми осуществлен тепловой контакт (т.е. возможен теплообмен), останутся равновесными только при условии, что их температуры одинаковы. При установлении теплового контакта между системами с различными температурами тепло передается от системы с более высокой температурой к системе с более низкой температурой. Как говорят, тепло передается от горячего тела к холодному.
Многие количественные характеристики вещества — объем, электрическое сопротивление и др. — зависят от температуры. Любая из этих зависимостей может быть использована для измерения температуры. Пусть некоторое тело (называемое термометрическим), одна из количественных характеристик которого х зависит от температуры, приведено в тепловое равновеснее тающим льдом. Такой системе приписывают нулевое значение температуры. Пусть этому значению температуры соответствует значение х0 термометрической величины х. Затем это тело приводят в тепловое равновесие с кипящей при атмосферном давлении водой, приписывают ему в таком состоянии значение температуры, равное 100°, и определяют соответствующее значение х величины х. Если предположить, что величина х изменяется с температурой линейно, то любому другому равновесному состоянию термометрического тела и телам, находящимся вместе с ним в равновесии, можно приписать температуру.

Определенная таким образом шкала температуры называется шкалой Цельсия. Единицей измерения температуры t является градус Цельсия.
(°С).
При сравнении показаний термометров, в которых в качестве термометрических тел используются различные вещества (например, ртуть и спирт) или различные температурные зависимости (например, температурные зависимости объема V = V (t) и электрического сопротивления R = #($)), может оказаться, что эти показания не совпадают при значениях температуры t, не равных 0° и 100°. Поэтому для однозначности определения температурной шкалы необходимо условиться о выборе термометрического тела, термометрической величины и способа градуировки шкалы.
В физике применяется также абсолютная шкала температуры Т. Единицу абсолютной температуры называют кельвином (К). Значения кельвина и градуса Цельсия одинаковы. Абсолютная температура Т связана с температурой t по шкале Цельсия соотношением.
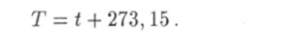
Равновесное состояние а макроскопической системы однозначно определяется значениями температуры Т и других внешних параметров. При этом внутренние параметры являются функциями от внешних. В дальнейшем изложении будем рассматривать только такие системы, состояния которых однозначно определяются значениями температуры Т и объема V.
Для того чтобы температура исследуемой системы приняла определенное значение Т, достаточно привести эту систему в соприкосновение с равновесной системой, имеющей данную температуру. Если последняя система обладает достаточно большой теплоемкостью, то в результате теплообмена ее температура изменится очень незначительно. Тогда как температура исследуемой системы примет требуемое значение Т. Система. обладающая относительно большой теплоемкостью и постоянной температурой и находящаяся в тепловом контакте с исследуемой системой, называется резервуаром тепла, или термостатом. До тех пор, пока существует теплообмен между термостатом и системой, ее температура будет равна температуре термостата. Равновесный процесс, протекающий в термодинамической системе при постоянной температуре, называется изотермическим.
Если равновесное состояние а термодинамической системы однозначно определяется значениями двух параметров (например, температуры Т и объема К), то такое состояние <�т можно изобразить точкой на координатной плоскости, где на осях координат откладываются значения этих параметров. Так как равновесный процесс можно рассматривать как непрерывную последовательность равновесных состояний, его можно изобразить соответствующей кривой на плоскости. На рис. 1.1 изображен равновесный процесс а — } переводящий термодинамическую систему из состояния <�т 1 в состояние (то. Число процессов, при помощи которых такой переход может быть осуществлен, бесконечно велико. Любая кривая, соединяющая точки <7! и <72. изображает один из таких процессов. Конкретный равновесный процесс может быть описан посредством зависимости V' = V (T) объема от температуры или другого уравнения, связывающего любые два из параметров P, V и 7 Неравновесные состояния и процессы <7 = не поддаются геометрической интерпретации.
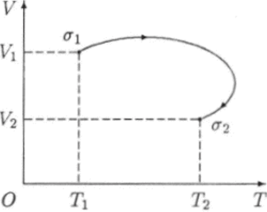
Рис. 1.1. Равновесный термодинамический процесс.
Из трех параметров Р, V и 7 характеризующих равновесное состояние термодинамической системы, независимыми являются только два (например, Т и V). Зависимость давления от температуры и объема.
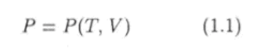
называется уравнением состояния рассматриваемой равновесной термодинамической системы.