Мышьяк.
Сурьма.
Висмут

Мышьяк, сурьма и висмут образуют оксиды типа Э203 и Э203. Устойчивость состояния с высшей степенью окисления уменьшается с увеличением заряда ядра в ряду As — Sb — Bi, при этом основные свойства оксидов возрастают в ряду As — Sb — Bi. Так, у As203 преобладают кислотные свойства, у Sb203 — основные свойства, a Bi203 обладает отчетливо выраженными основными свойствами. Свойства элементов подгруппы… Читать ещё >
Мышьяк. Сурьма. Висмут (реферат, курсовая, диплом, контрольная)
Кроме азота и фосфора в 15-ю группу входят мышьяк, сурьма и висмут (образуя подгруппу мышьяка).
Историческая справка Мышьяк и сурьма относятся к числу элементов, точная дата открытия которых не установлена. В 1789 г. А. Лавуазье мышьяк и сурьму как самостоятельные элементы включил в список простых веществ.
Первые сведения о металлическом висмуте, его добыче и переработке встречаются в трудах средневекового химика Агриколы (1529). Символ элемента Bi впервые введен в химическую номенклатуру в 1819 г. И. Я. Берцелиусом.
С увеличением радиуса атомов изменяются окислительно-восстановительные свойства: окислительные свойства убывают, восстановительные усиливаются.
Висмут — металл, а мышьяк и сурьма занимают промежуточное положение. Для всех трех элементов характерны степени окисления -3, 0, +3 и +5. Степень окисления +5 наиболее характерна для Sb, менее для As и неустойчива для Bi. Сравнительная окислительно-восстановительная активность мышьяка, сурьмы и висмута в различных состояниях окисления (+3 и +5) может быть выражена следующей схемой:
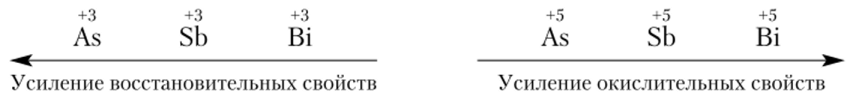
Важнейшие соединения мышьяка, сурьмы и висмута сходны между собой по строению, ионно-электронной и окислительно-восстановительной характеристикам. Это относится и к водородным, и к кислородным соединениям, и к галогенидам. Кислородсодержащие соединения обычно проявляют кислотный характер.
Мышьяк, сурьма и висмут в природе встречаются преимущественно в соединениях с серой. Среди них наибольшее значение имеют реальгар As4S4, аурипигмент As2S3, лёллингит FeAs2, сурьмяный блеск (антимонит) Sb2S3, висмутовый блеск Bi2S3, мышьяковый цвет As203, сурьмяная охра Sb203, висмутовая охра Bi203.
Получение мышьяка, сурьмы и висмута сводится к их восстановлению из соответствующих оксидов. Обычно в качестве восстановителя используется уголь:
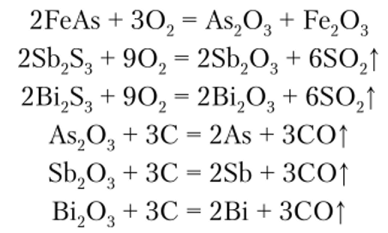
Свойства элементов подгруппы мышьяка. В виде простых веществ мышьяк, сурьма и висмут похожи на металлы, проводят электрический ток и теплоту, но в отличие от настоящих металлов лишены таких свойств, как упругость, пластичность, ковкость и т. п. Эти вещества очень хрупки и легко измельчаются при растирании.
Мышьяк образует два аллотропных видоизменения: металлический мышьяк, устойчивый в твердом состоянии при обычных условиях и при нагревании; желтый мышьяк, отличающийся своей неустойчивостью. Металлический мышьяк при нагревании возгоняется.
Сурьма существует в виде кристаллической и желтой аллотропной модификации. Кристаллическая сурьма образует гексагональные кристаллы (изоморфные кристаллам мышьяка), но внешнему виду напоминает металл, но очень хрупкий. Желтая модификация сурьмы аналогична желтому мышьяку, но еще более неустойчива.
Висмут — относительно мало распространенный элемент. Представляет собой блестящий металл белого цвета с красноватым оттенком. Хрупок, легко измельчается. Проводит электрический ток, но хуже, чем истинные металлы.
С водородом мышьяк, сурьма и висмут образуют соединения общей формулы RH3 (AsH3 — арсин, SbH3 — стибин и BiH3 — висмутин). Арсин и стибин получают при действии кислот на соответствующий оксид в присутствии цинка:
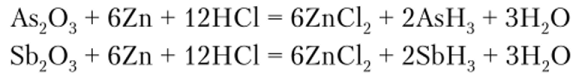
BiH3 получают при растворении сплава Bi с Mg в соляной кислоте:
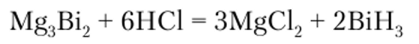
Аналогично можно получить также AsII3 и SbH3.
В гидридах степень окисления элементов равна -3. Все три гидрида очень нестойки, причем их неустойчивость усиливается от H3As к H3Bi. Арсин разлагается при 300—400°С, SbM3 разлагается при более низкой температуре, а ВШ3 разлагается уже при комнатной температуре:
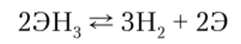
На способности гидридов разлагаться при нагревании основана специфическая качественная реакция Марша, позволяющая устанавливать присутствие этих трех элементов в исследуемом веществе. Метод Марша широко используется в судебно-химических исследованиях при обнаружении мышьяка. В основе этого метода лежит реакция восстановления мышьяка из его соединений до AsH3, который при пропускании через накаленную, наполненную водородом стеклянную трубку разлагается с образованием черно-бурого осадка элементарного мышьяка — мышьякового зеркала:
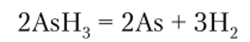
Водородные соединения элементов подгруппы мышьяка обладают сильными восстановительными свойствами. Так, если подействовать арсином на AgN03, то образуется металлическое серебро (реакция Гутцайга):
 +з Под действием окислителей мышьяк и сурьма могут окисляться до As,.
+з Под действием окислителей мышьяк и сурьма могут окисляться до As,.
+3 +5 +5 +3.
Sb, Sb, As. Висмут обычно окисляется до Bi, но при действии очень силь;
+5 +5.
ных окислителей на соединения Bi можно получить соединения Bi:
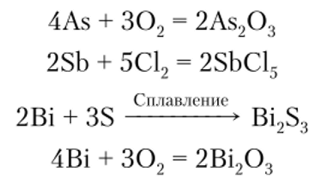
По отношению к кислотам мышьяк, сурьма и висмут ведут себя по-разному. С соляной кислотой мышьяк в присутствии кислорода образует AsCl3:
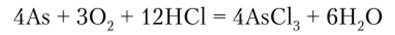
На сурьму разбавленные кислоты не действуют. Концентрированная НС1 растворяет сурьму:
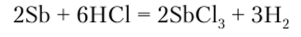
Висмут с разбавленными серной и соляной кислотами не реагирует. При взаимодействии с концентрированной серной кислотой мышьяк, сурьма и висмут окисляются, образуя соединения со степенью окисления +3:
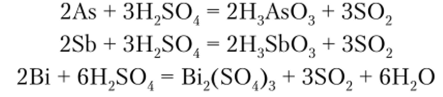
Концентрированная азотная кислота и хлорноватистая кислота окисляют сурьму и мышьяк до степени окисления +5:
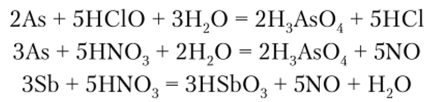
Висмут в концентрированной кислоте пассивируется, а в разбавленной, растворяясь, дает нитрат:
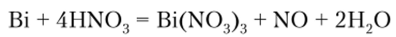
В ряду стандартных электродных потенциалов Sb и Bi располагаются между водородом и медыо, поэтому при взаимодействии с кислотами водород этими элементами не вытесняется.
При взаимодействии с элементами 1-й и 2-й групп образуются солеподобные соединения: арсениды, стибиды (антимониды) и висмутиды, в которых As, Sb и Bi проявляют степень окисления -3. Например:
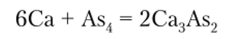
Действием разбавленных кислот на эти соединения получают соответствующие гидриды по схеме.
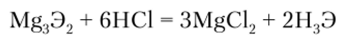
Степени окисления +3 и +5 мышьяк и его аналоги проявляют кроме кислородных соединений и в галогенидах. Молекулы имеют форму треугольных пирамид с атомом Э в вершине и валентным углом Hal—Э—Hal около 100°. В этих соединениях As, Sb и Bi сохраняют несвязывающую-электронную пару. Тригалогениды мышьяка AsHal3 схожи с тригалогенидами фосфора. SbCl3 отличается от них тем, что он растворяется в небольшом объеме воды с образованием прозрачного раствора, который при разбавлении дает нерастворимые оксохлориды SbOCl и Sb^O^Cl^ Простых ионов Sb3+ в растворах не существует. Трихлорид висмута BiCl3 гидролизуется до BiOCl, но эта реакция обратима: 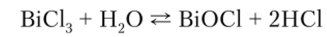
Для галогенидов ЭНа13 характерна склонность к реакциям присоединения с образованием комплексных соединений:
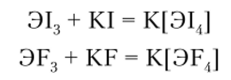
В ряду AsHal3 — SbHal3 — BiHal3 кислотные свойства ослабевают и усиливаются основные. Для всех элементов описаны пентафторнды 3F5, а для сурьмы — еще и хлорид SbCl5. Пентафториды As и Sb — сильные акцепторы фторид-иона, образующие ионы MFg. Тенденция к комплексообразованию по схеме.
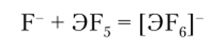
особенно сильно выражена у сурьмы, в меньшей степени — у мышьяка и еще слабее — у висмута. Фториды 3F5 всех трех элементов являются сильными окислителями, причем эта способность увеличивается в ряду AsF5 — SbF5 — BiF5.
Мышьяк, сурьма и висмут образуют оксиды типа Э203 и Э203. Устойчивость состояния с высшей степенью окисления уменьшается с увеличением заряда ядра в ряду As — Sb — Bi, при этом основные свойства оксидов возрастают в ряду As — Sb — Bi. Так, у As203 преобладают кислотные свойства, у Sb203 — основные свойства, a Bi203 обладает отчетливо выраженными основными свойствами.
Оксиды типа Э203 легко образуются при непосредственном взаимодействии элементов с кислородом по схеме.
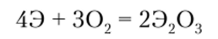
As203 — белый мышьяк. Проявляет преимущественно кислотные свойства. Он взаимодействует с Н20, щелочами и галогеноводородными кислотами:
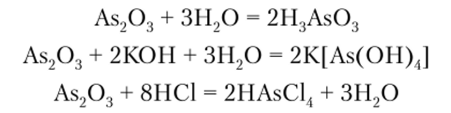
Sbv03 в воде практически нерастворим, но взаимодействует с НС1 и щелочами.
Взаимодействие А$203 и Sb203 со щелочами приводит к образованию тетрагидроксоарсенатов (Ш) К[As (OH) 4] и тетрагидроксоантимонатов (Ш) K[Sb (OH)J.
Bi203 в воде не растворяется, со щелочами практически не реагирует, но легко взаимодействует с кислотами, образуя соли:
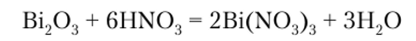
Оксидам R203 соответствуют гидроксиды типа Э (ОН)3, химические свойства которых изменяются в той же последовательности, что и оксидов.
As (OH)3 амфотерен, с преобладанием кислотных свойств. В свободном состоянии не выделен, в водном растворе ведет себя как слабая кислота H3As03, называемая мышьяковистой кислотой. Соли этой кислоты — арсениты.
Sb (OH)3 также амфотерен, но с преобладанием основных свойств. Кислотно-основная ионизация у этих гидроксидов выражена слабо.
У Bi (OH)3 явно преобладают основные свойства. Следовательно, кислотные свойства в ряду As (OH)3, Sb (OH)3 и Bi (OH)3 ослабевают, а основные усиливаются.
As (OH)3 может быть получен взаимодействием As203 с водой. Поскольку у As (OH)3 преобладают кислотные свойства, то в водном растворе он ведет себя как кислота H3As03:
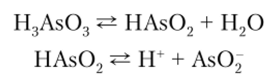
Равновесие в первой из этих реакций сильно смещено вправо.
Гидроксиды Sb (OH)3 и Bi (OH)3 в воде практически не растворяются. Их обычно получают действием растворов щелочей на соответствующие соли:
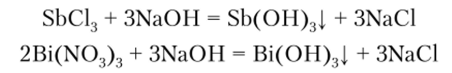
Соли мышьяковистой кислоты называются арсенитами и получаются при действии щелочей на As203:
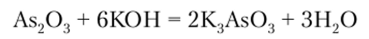
Соли Sb (III) и Bi (III) легко гидролизуются с образованием основных солей, которые в дальнейшем разлагаются до малорастворимых в воде оксосолей:
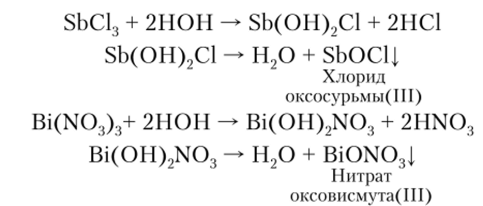
Соединения As (III) являются восстановителями; при их окислении получаются соединения As (V). Так, в слабощелочной среде арсениты могут быть окислены свободным иодом до арсеиатов:
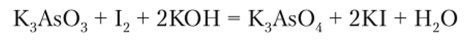
Производные Sb (III) обладают меньшей восстановительной способностью, а окисление соединений Bi (III) возможно лишь энергичными окислителями в сильнощелочной среде:
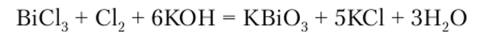
Оксид мышьяка (У) As205 непосредственным окислением мышьяка не образуется. Его получают дегидратацией мышьяковой кислоты H3As04:
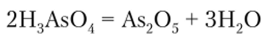
Sb205 в чистом виде выделить трудно, поскольку в процессе его получения происходят частичная потеря кислорода и образование Sb204.
As2() — и Sb205 в обычных условиях — твердые вещества. По своей структуре и свойствам As7() — напоминает Р205. Так, легко растворяясь в воде, As2Os образует мышьяковую кислоту H3As04:
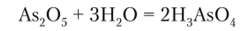
Sb205 в воде растворим мало, но легко растворяется в щелочах с образованием гексагидроксостибатов (У) типа Me[Sb (OH)6]:
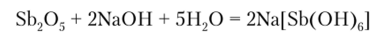
При сплавлении As20- и Sb205 со щелочами образуются арсенаты (У).
+ 1 ' +3 +2.
и стибаты (У) типа МеЭ03; МеЭ04 и Ме2Э2От7, которые в своем большинстве полимерны.
Кристаллизацией из водных растворов обычно получают арсенаты типа.
+i.
Me3As04.
Оксиду As203 соответствует оксоарсенат водорода или мышьяковая кислота H3As04, которая слабее фосфорной. Как трехосновная кислота H3As04 образует три типа солей — арсенаты Na3As04, дигидроарсенаты NaH2As04 и гидроарсенаты Na2HAs04.
Оксиду Sb205 соответствует сурьмяная кислота H3Sb04, однако она существует в водных растворах в нескольких формах. Попытка выделить сурьмяные кислоты приводит к образованию осадков неопределенного состава Sb205-«H20.
Соли сурьмяной кислоты (антимонаты) соответствуют обычно гексагидроксосурьмяной кислоте, формула которой H[Sb (OH)G], отвечает гидратированной метаформе HSb03-3H20.
В свободном состоянии не получены и висмутовые кислоты.
Подобно фосфатам, большинство арсенатов и антимонатов труднорастворимы в воде.
Соединения Bi (V) могут быть получены при действии сильных окислителей на Bi (OH)3 в концентрированном растворе NaOH. Состав образующихся.
+ 1.
полимерных висмутатов отвечает формуле МеВЮ3. Висмутаты рассматривают как соли невыделенной в свободном состоянии висмутовой кислоты.
+5 +5 +5.
Окислительная способность в ряду As — Sb — Bi усиливается, поэтому если мышьяковая и сурьмяная кислоты и их соли такие свойства проявляют лишь в кислой среде, то производные Bi окислительные свойства проявляют как в кислой, так п в щелочной среде:
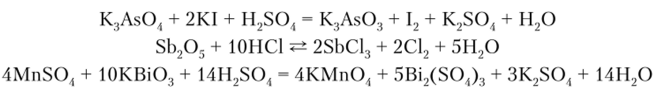
Для элементов подгруппы мышьяка характерны сернистые соединения, обычно нерастворимые в воде и разбавленных кислотах.
As2S3 и As2S5 нерастворимы в концентрированной HCI, но концентрированная HNO., растворяет их: 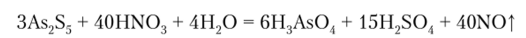
Сульфиды этих элементов проявляют определенную аналогию свойств оксидов Э20, и Э205. Так, при взаимодействии сульфидов со щелочами образуются соли тиокислот, г. е. кислот, в которых кислород (О2) заменен на серу (S2) (например, вместо (NHH^AsO, можно получить (NH4)3AsS4):
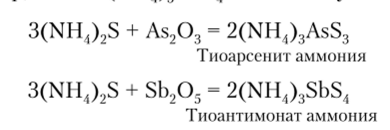
Аналогично протекают процессы для сульфидов сурьмы.
В противоположность им Bi2S3 с растворимыми сульфидами почти не реагирует. Тиоарсеииты и тиоантимоииты в твердом состоянии устойчивы, но соответствующие им тиокислоты обычно распадаются. Тиосоли, содержащие As (V) и Sb (V), называются соответственно тиоарсенатами и тиоантимонатами. В отличие от своих солей тиокислоты неустойчивы и разлагаются на сульфиды и сероводород:
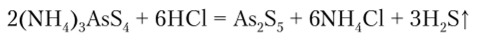
Некоторые тиоарсеииты и тиоарсенаты применяются для борьбы с вредителями сельского хозяйства.
Качественные реакции на арсенит-ион AsO|, арсенат-ион As04~, ион сурьмы (Ш), ион висмута (Ш) следующие:
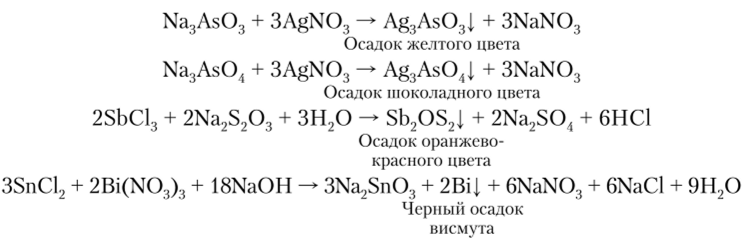
Мышьяк и все его соединения очень ядовиты! Несмотря на это, некоторые соединения находят применение в медицине.
Арсенит калия (калия арсенит) KAsO., получают по уравнению реакции.
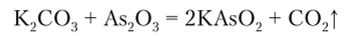
Его применяют как тонизирующее средство при малокровии и истощении нервной системы.
Гидроарсенат натрия (натрия арсенат кристаллический) Na2HAs04 получают окислением As20;! азотной кислотой, затем образовавшийся As205 обрабатывают карбонатом натрия:
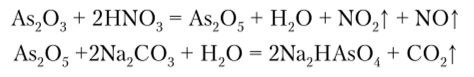
Применяют Na2HAs04 в виде 0,5—1%-ного раствора при малокровии и неврозах. As., 03 используют для лечения кожных заболеваний, малокровии, неврастении. В стоматологии применяют для иекротизации пульпы.
Нитрат висмута (основной нитрат висмута) обычно является смесью нескольких основных солей:
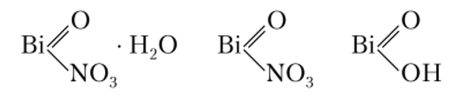
Его используют в качестве антисептика при желудочно-кишечных заболеваниях. Висмут входит в состав многих органических соединений, широко применяемых в медицине: ксероформа, дерматола и др.