Физико-химические свойства.
Пищевая химия.
Наличие металлов в продуктах

Метилртуть имеет большое сродство к сульфгидрильным группам, и при их взаимодействии образуются соединения ртути с белками живых организмов. Метилртуть самая стойкая и очень токсичная. Метилирование ртути осуществляют аэробные и анаэробные микробы, а также микромицеты, обитающие в почве, особенно в верхнем слое донных отложений водоемов. Метилртуть (СНзНд*) синтезируется микроорганизмами воды как… Читать ещё >
Физико-химические свойства. Пищевая химия. Наличие металлов в продуктах (реферат, курсовая, диплом, контрольная)
Ртуть Hg (Hydrargyrum) в переводе с греческого обозначает «жидкое серебро». Порядковый номер ртути в периодической системе Менделеева — 80, атомная масса — 200,6. Ртуть является одним из самых тяжелых металлов, ее плотность — 13,6 г/см3. Ртуть в широком интервале температур — от температуры плавления минус 38,9 °С до температуры кипения 356,6 °С — находится в жидком состоянии.
Она довольно летуча, при температуре 24 °C содержание ее насыщенных паров в атмосфере составляет 18 мг/м3. Ртуть плохо растворима в воде и жирах, ее растворимость порядка 5−50 мг/дм3. На воздухе металл быстро окисляется.
Соединения. Ртуть находится в природе в трех окисленных состояниях:
- 1) металлическая (Нд°);
- 2) одновалентный ион, состоящий из двух ядер ковалентной связи между атомами (НдНд)2*;
- 3) двухвалентный ион (Нд2*).
Может образовывать водорастворимые сульфаты, нитраты, галогениды. Степени окисления ртути 1* и 2*. В водном растворе существует равновесие мехщу состояниями Нд°, HgCI2*, Нд2*. Свойства ртути в различных степенях окисления определяются окислительновосстановительным потенциалом раствора и присутствием комплексных соединений. Ион Нд2* может образовывать стабильные комплексы с органическими соединениями, особенно через сульфгидрильные группы. В водном растворе образуются четыре соединения с хлором:
НдСГ, HgCI2, HgCi;, HgClJ'.
Металлическая ртуть претерпевает множество химических превращений после выделения в окружающую среду. В почве серовосстанавливающие бактерии могут превращать ртуть в ее сульфат. Такое же превращение наблюдается при анаэробных условиях в воде, но более важным превращением, происходящим в водных системах, является аэробное метилирование.
Одновалентный ион ртути более нестабилен и в присутствии биологических объектов диссоциирует на атом ртути и ион Нд2*.
Метилртуть имеет большое сродство к сульфгидрильным группам, и при их взаимодействии образуются соединения ртути с белками живых организмов. Метилртуть самая стойкая и очень токсичная. Метилирование ртути осуществляют аэробные и анаэробные микробы, а также микромицеты, обитающие в почве, особенно в верхнем слое донных отложений водоемов. Метилртуть (СНзНд*) синтезируется микроорганизмами воды как из атомарной, так и из окисленной формы ртути Нд2*. Метилирование, которое сопряжено с микробным синтезом метионина, — наиболее эффективный способ обезвреживания Нд2*. Реакция метилирования, вероятно, происходит в верхних осадочных породах водоемов. Метилртуть, образованная микроорганизмами, а также выделившаяся как побочный продукт при промышленном производстве, быстро поглощается живыми организмами и включается в пищевые цепи обитающих на дне моря беспозвоночных, питающихся планктоном.
Дальнейшее распространение ртути после ее естественного разложения в воде может происходить путем поглощения метилртути живыми организмами и их последующего разложения. При этом образуется летучее соединение диметилртуть (СНз)гНд, которое выделяется в атмосферу. В атмосфере она может располагаться кислой дождевой водой до монометилртути и таким образом вернуться в водную систему.
Токсическое действие ртути зависит от вида соединения: алкилртутные соединения токсичнее неорганических. Наиболее токсичные алкилртутные соединения с короткой цепью: метилртуть, этилртуть. Они больше накапливаются в организме, лучше растворяются в липидах и легче проникают через биологические мембраны. Чувствительность нервной системы к метили этилртути выше, чем к другим соединениям.
Алкилртуть с галогенами образует сильно токсичные летучие соединения. Гидроксид и нитрат алкилртутных соединений с короткими цепями менее летучи. Хлориды метили этилртути хорошо растворяются в различных растворителях и жирах.
Распространение. Ртуть — элемент, не часто встречающийся в окружающей среде. По распространению в земной коре она занимает 62-е место, средняя концентрация составляет примерно 0,5 мг/кг. Ее распределение неоднородно, в некоторых местах может встречаться в очень больших количествах. Ртуть и ее соединения летучи, поэтому она повсеместно распространена в природе. Основные месторождения ртути расположены в районе, известном как «ртутно-железный» пояс, протянувшемся вдоль Средне-Атлантического хребта, Средиземного моря, Южной и Восточной Азии и береговой линии Тихого океана, включая Новую Зеландию и Центральную Америку.
Известные месторождения ртути находятся в Индрии (Югославия), Алмадене (Испания) и Новом Алмадене в Калифорнии (США). Большие залежи имеются в России. В меньших количествах этот металл встречается в других странах, в том числе Ирландии. Кроме ртути, попадающей в атмосферу из руд, большие количества металла выделяются во время землетрясений и извержений вулканов.
Ртуть встречается в земной коре главным образом в виде сульфидов. Киноварь — красный сульфид — является основной добываемой рудой. Из руд с содержанием ртути свыше 70% чистый металл сравнительно легко экстрагируется. Сульфиды обжигают на воздухе, при этом ртуть испаряется, ее пары конденсируют и собирают металл, который при нормальной температуре является жидким.
Фоновые концентрации ртути в почве составляют 0,01−0,06 мг/кг, а в поверхностных слоях — в 5−10 раз больше. В ртутных биогеохимических провинциях фоновые концентрации ртути на 1−2 порядка больше.
К индустриальным источникам ртути относятся сжигание топлива, электротехническая и целлюлозная промышленности, производство электролитического хлора, каустической соды, производство и применение ртутных фунгицидов, промышленные стоки ряда производств и др.
Источниками ртути для биосферы являются горные породы, месторождения богатых ртутью ископаемых (например, киновари), извержения вулканов, испарения ртути с поверхности почвы и воды.
Атмосфера играет ведущую роль в региональном и глобальном распространении ртути. Ежегодно от 30 тыс. до 150 тыс. т ртути в виде паров и аэрозолей выделяется в атмосферу.
Фоновая концентрация ртути в воздухе составляет 0,001−0,8 мкг/м3, а в промышленных городах может быть на 2−3 порядка выше. Ртуть, присутствующая в воздухе, может эффективно удаляться во время интенсивных ливней.
Большой интерес представляет содержание ртути в гидросфере.
Наименьшие концентрации ртути встречаются в дождевых и глубоких подземных водах (0,001−0,1 мкг/дм3), вблизи богатых ртутью горных пород ее концентрация достигает 1−5 мкг/дм3 (в отдельных случаях до 30−50 мкг/дм3), а в зонах локального загрязнения стоками, содержание ртути в водах возрастает до 10−100 мкг/дм3.
В незагрязненных открытых водоемах концентрация ртути 0,01−0,1 мкг/дм3, реже около 0,5 мкг/дм3. Например, в речных водах Швеции, в которые спускали производственные сточные воды, содержание ртути достигало 40−510 мкг/дм3, Японии — 80−100 мкг/дм3, Югославии — 100−1300 мкг/дм3 и более. Значительное количество ртути попадает в донные отложения, где она может сохраняться десятки лет. Здесь под воздействием микроорганизмов соединения ртути постепенно превращаются в органические хорошо растворимые соединения (метилртуть), вторично загрязняющие воду и легко включающиеся в пищевые цепи. На рис. 1 показана схема трансформации ртути в биосфере.
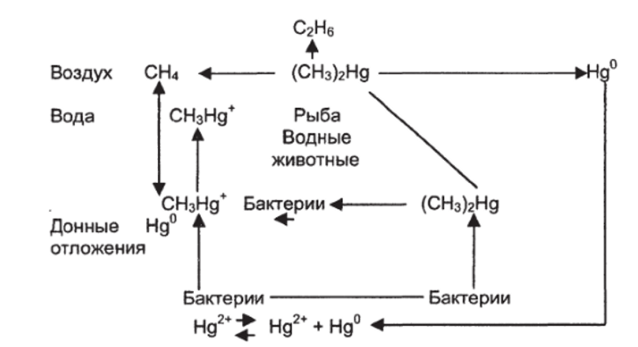
Рис. 1. Схема трансформации ртути в биосфере.
Извлечение. Ртутную руду добывают шахтным способом. Металлическую ртуть выделяют из руды прокаливанием во вращающихся или шахтных печах путем восстановления железом или оксидом кальция. Пары ртути выносятся отходящими газами и конденсируются в вертикальных трубках.
Кроме 10 тыс. т ртути, добываемых в мире при горнорудных разработках, еще 10 тыс. т металла выделяется в окружающую среду при сгорании угля, нефти, газа, добыче пустой породы и других индустриальных разработках. Естественным образом ежегодно от 30 тыс. до 150 тыс. т ртути выделяется при дегазации земной коры и океанов.
Применение. Ежегодно в мире получают более 10 тыс. т ртути, из которых 25% используют для производства электродов при получении хлора и щелочей, 20% в производстве электрооборудования, 15% в составе красок, 10% для производства различных ртутных приборов, таких, как термометры, 5% в производстве зеркал, агрохимии и 3% в стоматологии в качестве ртутной амальгамы. Кроме того, порядка 25% производимой ртути используется в других отраслях промышленности, при получении детонаторов, катализаторов (например, для производства ацетальдегида и поливинилхлорида), в производстве бумажной пульпы, фармацевтической и косметической промышленности, а также в военных целях.
В качестве сильно токсичных веществ соединения ртути широко используют в качестве гербицидных и пестицидных добавок, органические соединения ртути прежде широко применялись для той же цели, а также в качестве фунгицидов при обработке зерна, однако в настоящее время во многих странах их использование запрещено.