Водородный и гидроксильный показатели (pH и рОН)

Где п — число ионов данного сорта, учитывая, что степень диссоциации равна единице (100%), а концентрация кислоты выражена в моль/л. Концентрация рассчитывается по формуле (1.1) с учетом того, что степень диссоциации выражается из закона разбавления Оствальда: Точное значение pH измеряют приборами — pH-метрами, для качественной оценки кислотности среды применяют индикаторы. Решение. Концентрация… Читать ещё >
Водородный и гидроксильный показатели (pH и рОН) (реферат, курсовая, диплом, контрольная)
Вода — слабый электролит, диссоциирующий, хотя и весьма незначительно, по уравнению.
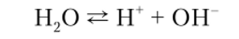
Степень диссоциации воды очень мала. Так, при 25 °C в 1 л воды распадается на ионы лишь одна молекула из 10 000 000 (или 10 ' моль). Это равновесие для слабого электролита характеризуют константой равновесия.
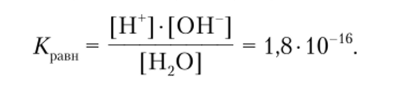
Концентрация непродиссоциированных молекул воды — величина постоянная, равная [Н20] = 55,37 моль/л. Перенеся это значение в левую часть (|Н20| /Срапм), мы получим новую константу — Кв, называемую ионным произведением воды: 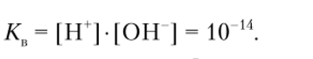
В нейтральной среде |Н*] = [ОН ] = 10 '.
В кислой среде концентрация ионов водорода должна быть больше, чем 10"' моль/л, т. е. 10 6, 10″э,…, 10″1; а в щелочной среде — меньше, чем 10″7, т. е. 10 8, 10″9,…, 10 14.
Кислотность среды (обозначается pH) выражается величинами, рассчитываемыми по формуле.
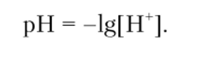
Параметр pH называется водородным показателем. Изменение кислотности среды можно представить следующей схемой:
![Гидроксильный показатель рОН рассчитывается по формуле рОН = -lg[OH ].](/img/s/8/33/1459333_5.png)
Гидроксильный показатель рОН рассчитывается по формуле рОН = -lg[OH ].
и связан с водородным показателем соотношением.

Пример 1.3. Вычислим [Н+] и |ОН | в растворе, если pH = 5.
Решение. Если pH = 5, тогда [Н] = 10 ' моль/л, рОН = 14 — 5 = 9, [ОН ] = = 10 9 моль/л.
Точное значение pH измеряют приборами — pH-метрами, для качественной оценки кислотности среды применяют индикаторы.
Индикаторы представляют собой слабые органические кислоты или основания, недиссоциированные молекулы и ионы которых имеют различную окраску. Лакмус, например, содержит азолитминовую кислоту, молекулы которой красного цвета, а анионы — синего:

В кислой среде лакмус окрасит раствор в красный цвет, а в щелочной — в синий.
Фенолфталеин относится к одноцветным индикаторам и меняет свою окраску от бесцветной (в кислой среде) до малиновой (в щелочной):
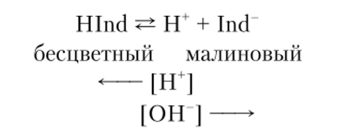
Рассмотрим далее вычисление водородных ионов в водных растворах кислот и оснований.
Сильные кислоты диссоциируют практически полностью, и концентрацию ионов водорода рассчитывают по формуле.

где п — число ионов данного сорта, учитывая, что степень диссоциации равна единице (100%), а концентрация кислоты выражена в моль/л.
Пример 1.4. Вычислим |FT] и pH 0,05 и раствора соляной кислоты.
Решение. Концентрация ионов водорода практически равна концентрации соляной кислоты. Для соляной кислоты концентрация 0,05 н = 0.05М. Концентрация [Н ] = 5 -10 2 1 1 = 0,05 моль/л. Тогда pH = -lg (5 10 2) = 1,3.
Вычисление концентрации водородных ионов [Н+] в растворе одноосновной слабой кислоты для слабой одноосновной кислоты диссоциация происходит по схеме.
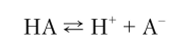
Концентрация [ Н' ] рассчитывается по формуле (1.1) с учетом того, что степень диссоциации выражается из закона разбавления Оствальда:
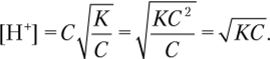
Пример 1.5. Вычислим |Н+] и pH 0,2 н раствора уксусной кислоты.
Решение. Из табличных данных (см. табл. 111) константа диссоциации уксусной кислоты равна 1,8−10 :>. Ск«сл = 0,2 н = 0,2 М, тогда концентрация ионов водорода.
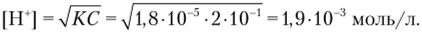
Следовательно, pH = —lg (1,9 -10 3) = 2,72.
Вычисления концентрации гидроксид-ионов ОН | и рОН в растворах оснований аналогичны определению [Н11 и pH в растворах кислот, что очевидно из примеров.
Пример 1.6. Вычислим [ОН ], рОН и pH 0,05 н раствора гидроксида натрия.
Решение. Концентрация NaOII 0,05 н = 0,05 М и для сильного электролита концентрация гидроксид-ионов [ОН ] = Сжн-11 =5−10 2 моль/л.
Следовательно, рОП = -lg [ОН ] = -lg (5−10 2) = 1,3; pH = 14 — 1,3 = 12,7.
Пример 1.7. Вычислим | ОН |, рОН и pH 0,3 и раствора гидроксида аммония.
Решение. Для N1 14ОН концентрация 0,3 н = 0, ЗМ. Зная из таблиц значение константы диссоциации NH, OII К = 1,8−10 вычисляем концентрацию [ОН ], рОН и pH: 