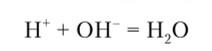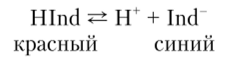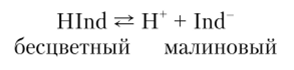В основе метода нейтрализации лежит реакция взаимодействия катионов Н+ с анионами ОН с образованием слабо диссоциирующих молекул воды:
С помощью этого метода, пользуясь рабочими титрованными растворами щелочей, определяют количество или концентрацию кислот (IICI, H2S04, Н3Р04, Н2С204). Или с помощью рабочих растворов кислот находят концентрацию щелочей (NaOH, КОН, Са (ОН)2, Ва (ОН)2). Метод пригоден также для определения солей (Na2C03, NH4C1 и др.).
Большое влияние на точность титрования имеет правильный выбор индикатора.
Индикаторы в методе нейтрализации
В методе нейтрализации наиболее употребимы следующие индикаторы: метиловый оранжевый, метиловый красный, лакмус и фенолфталеин. Поведение их объясняет ионная теория индикаторов, предложенная В. Оствальдом в 1894 г.
Согласно этой теории индикаторы — это слабые органические кислоты (или основания), у которых недиссоциированные молекулы и образуемые ими ионы имеют различную окраску. Например, лакмус:
Одноцветные индикаторы (фенолфталеин):
Существует и другая — ионно-хромофорная теория индикаторов.
Интервал значений pH, в пределах которых индикатор меняет окраску, называется областью перехода.
Укажем области перехода и показатели титрования (ПТ) для различных индикаторов:
- • метиловый оранжевый — 3,1—4,4 и 4,0;
- • метиловый красный — 4,4—6,2 и 5,5;
- • лакмус — 5,0—8,0 и 7,0;
- • фенолфталеин — 8,0—10,0 и 9,0.
Наиболее часто применяют метиловый оранжевый и фенолфталеин. Па рис. 5.3 показана графически область перехода этих индикаторов.
Из рис. 5.3 очевидно, что область перехода метилового оранжевого простирается от pH = 4,4 до 3,1. Внутри этого интервала окраска индикатора.
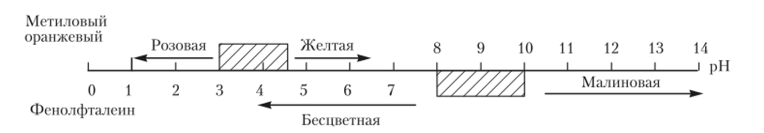
Рис. 53. Окраска фенолфталеина и метилового оранжевого при различных значениях pH.
переходит из желтой в розовую. При pH > 4,4 он сохраняет желтую окраску, а при pH < 3,1 — розовую.
Пример 5.1. Определим, какую окраску будет иметь метилоранж при pH, равном 5.
Решение. До pH = 3,1 метилоранж имеет красную (розовую) окраску. После pH = 4,4 — желтую. При pH = 5 окраска индикатора желтая.