Потенциометрия (ионометрия). Аналитическая химия и физико-химические методы анализа

Способность мембраны взаимодействовать в основном с одним видом ионов обусловлена наличием в ее составе определенных ионогенных групп. Если мембрана контактирует одновременно с двумя растворами, в одном из которых активность определяемого иона равна а, (анализируемый раствор), а во втором — а2 (внутренний раствор), то на поверхностях раздела «мембрана — раствор» будет происходить обмен ионами… Читать ещё >
Потенциометрия (ионометрия). Аналитическая химия и физико-химические методы анализа (реферат, курсовая, диплом, контрольная)
Потенциометрия основана на зависимости равновесного потенциала индикаторного электрода от активности (концентрации) определяемого иона. Для проведения анализа электродный потенциал измеряют в условиях, близких к условиям термодинамического равновесия, т. е. в отсутствие заметного тока через ячейку.
Различают прямую нотенциометрию, или ионометрию, и косвенную иотенциометрию, или потенциометрическое титрование.
В качестве индикаторных электродов в потенциометрии применяют электроды, обратимые по катиону (электроды I рода), обратимые по аниону (электроды II рода), а также ионоселективные и модифицированные электроды.
Для большинства электродов, применяемых в потенциометрии, активность одной из форм определяемого компонента (я0х или aRed) является величиной постоянной. Кроме того, внесение в исследуемый раствор специальных растворов (корректоров или регуляторов ионной силы — буферных растворов, корректирующих суммарную ионную силу), которые обеспечи;
вают постоянство ионном силы в процессе измерении, позволяет поддерживать неизменной величину коэффициента активности определяемого компонента независимо от его содержания. Поэтому в этом случае уравнение Нернста приобретает следующий вид:
а) при aRcd = const (электроды, обратимые по катиону, — электроды I рода, например серебряный электрод, помещенный в раствор соли серебра, или калий-селективный электрод).
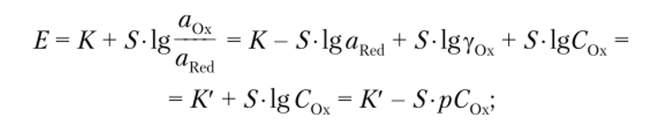
б) при aQx = const (электроды, обратимые по аниону, — электроды II рода, например хлоридсеребряный или фторид-селективный электроды).
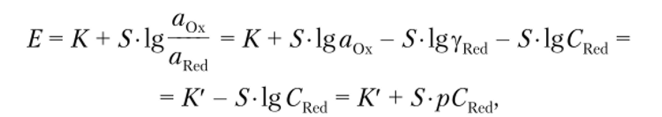
где С0х и CRcd — концентрации окисленной и восстановленной форм определяемого компонента соответственно; рС = -lgС.
Пример 12.1. Вычислим потенциал медного электрода, помещенного в раствор нитрата меди, относительно насыщенного хлоридсеребряиого электрода, если в 150 мл раствора содержится 24,2 г Cu (N03)2 2И20.
Решение. Стандартный потенциал пары? cu2ycu= 0,345 В. Потенциал насыщенного хлоридсеребряиого электрода равен 0,222 В. Медный электрод, опущенный в раствор соли меди, является электродом I рода, его потенциал зависит от природы потенциал определяющей пары и концентрации Си2+ (окисленной формы). Считая, что величина коэффициента активности для иона меди равна единице, можно записать 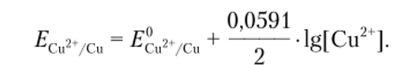
Предполагая, что степень диссоциации соли в растворе равна единице, концентрацию иона Ctr можно определить из соотношения.
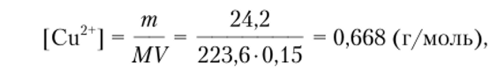
где т — масса соли, г; М — молярная масса соли, г/моль; V — объем раствора, л:
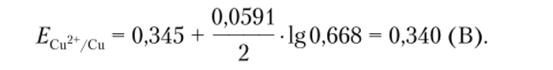
Потенциал медного электрода Equ^/cv относительно хлоридсеребряиого электрода сравнения можно вычислить по формуле 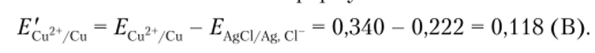
По определению ИЮПАК, ионоселективниые электроды — это сенсоры (чувствительные элементы, датчики), потенциалы которых линейно зависят от логарифма активности определяемого иона в растворе.
Важнейшей составной частью этих электродов является ионоселективная мембрана — тонкая пленка, отделяющая внутреннюю часть электрода (внутренний раствор) от анализируемого раствора и способная обратимо взаимодействовать преимущественно с ионами только одного вида. Внутренний раствор выбирают так, чтобы он одновременно содержал ионы, по отношению к которым селективна мембрана, и ионы, обеспечивающие устойчивый потенциал электрода сравнения, помещенного в этот раствор.
Способность мембраны взаимодействовать в основном с одним видом ионов обусловлена наличием в ее составе определенных ионогенных групп. Если мембрана контактирует одновременно с двумя растворами, в одном из которых активность определяемого иона равна а, (анализируемый раствор), а во втором — а2 (внутренний раствор), то на поверхностях раздела «мембрана — раствор» будет происходить обмен ионами, приводящий к появлению межфазной разности потенциалов. Таким образом, на внешней п внутренней поверхностях мембраны возникают так называемые равновесные граничные потенциалы Е{ и Е.р величина которых в соответствии с уравнением Нернста зависит от активности иона в растворах:
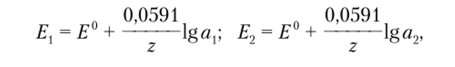
где 2 — заряд иона.
Если теперь в оба раствора — анализируемый и внутренний — поместить электроды сравнения, то разность потенциалов Е между этими электродами выразится следующим образом:
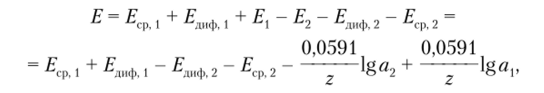
где Еср [, Е 2 — потенциалы первого и второго электродов сравнения соответственно; Етф , — диффузионный потенциал, возникающий в месте контакта первого электрода сравнения и анализируемого раствора; Е. 2 — диффузионный потенциал, возникающий в месте контакта второго электрода сравнения и внутреннего электрода.
Активность ионов во внутреннем растворе обычно поддерживается постоянной, поэтому где 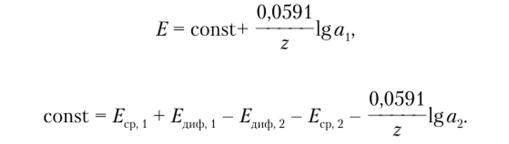
В общем виде с учетом неидеальности процессов на границе «мембрана — раствор» можно записать 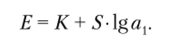
К сожалению, на потенциал мембраны в той или иной мере могут влиять также посторонние ионы, присутствующие в анализируемом растворе. Это влияние учитывается в модифицированном уравнении Нернста {уравнении Никольского) 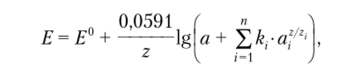
где a, z — активность и заряд определяемого иона; a, zt — активность и заряд постороннего иона соответственно; kt — коэффициент селективности, отражающий относительное влияние определяемого и постороннего ионов на потенциал мембраны и характеризующий способность мембраны различать различные ионы. Если kl< 1, то мембрана селективна относительно определяемого иона, причем чем меньше коэффициент селективности, тем выше селективность мембраны. Наоборот, если kt> 1, то мембрана селективна относительно постороннего иона.
Согласно рекомендациям ИЮПЛК различают:
- • первичные ионоселективные электроды (к ним относятся стеклянные электроды и электроды с кристаллическими мембранами);
- • электроды с подвижными носителями (обычно это электроды с жидкими или полимерными мембранами, содержащими иммобилизованные ионофоры);
- • сенсибилизированные {активированные) электроды (к ним относятся газочувствительные и ферментные электроды).
Стеклянные электроды содержат стеклянную мембрану, изготовленную из специального стекла, состав которого подбирают таким образом, чтобы мембрана проявляла повышенную селективность по отношению к определяемому иону. В зависимости от целевого назначения электрод может иметь разную форму и размер: от крошечных стерженьков, предназначенных для введения в полость зуба или даже отдельную клетку, до цилиндрических электродов диаметром 10—15 мм для лабораторных аналитических работ. Первым и наиболее распространенным в настоящее время ионоселективным стеклянным электродом был электрод для измерения pH. Его мембрану обычно изготавливают из стекла, содержащего 22% оксида натрия, 6% оксида кальция и 72% оксида кремния. Чувствительностью к ионам водорода обладает только мембрана, длительное время выдержанная в 0,1 моль/л растворе НС1 или соответствующем буферном растворе. В этом случае на ее поверхности образуется тонкий (-1 мкм) слой гидратированного геля, в котором в результате ионообменных процессов катионы натрия заменены ионами водорода:
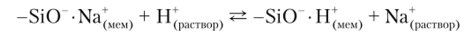
Внутри электрода располагается хлоридсеребряный электрод сравнения, погруженный во внутренний раствор, представляющий собой в данном случае насыщенный раствор хлорида серебра в 0,1 моль/л растворе соляной кислоты. При погружении стеклянного электрода в анализируемый раствор за счет процессов ионного обмена устанавливается равновесие между количеством ионов водорода, связанных на внешней поверхности мембраны, и активностью ионов водорода в растворе:
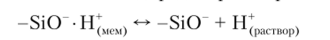
Этот процесс сопровождается изменением граничного потенциала мембраны.
Потенциал pH-чувствительного стеклянного электрода в широком диапазоне значений pH описывается уравнением.
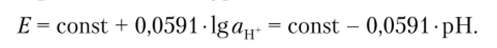
Константа включает в себя величину потенциала внутреннего электрода сравнения и потенциал асимметрии, который проявляется при погружении электрода в раствор, идентичный по составу внутреннему.
Причины его появления заключаются в различии структуры и состава внешней и внутренней поверхностей мембраны, вызванном тем, что в процессе измерений внешняя поверхность мембраны подвергается воздействию разнообразных по составу растворов и поэтому может дополнительно гидратироваться, дегидратироваться, подтравливаться либо загрязняться компонентами раствора. В процессе эксплуатации потенциал асимметрии непрерывно изменяется и может достигать величины, соответствующей одной единице pH. Поэтому правильные результаты измерений могут быть получены только при регулярной калибровке стеклянного электрода по стандартным буферным растворам (табл. 12.2).
Таблица 12.2
Буферные растворы, рекомендуемые для калибровки pH-селективного стеклянного электрода.
Состав буферного раствора. | pH (25°С). |
Гидротартрат калия (насыщ.). | 3,557. |
КНС4Н406 (0,05 моль/л). | 3,776. |
Гидрофталат калия (0,05 моль/л). | 4,004. |
КН2Р04 (0,025 моль/л) + Na2HP04 (0,025 моль/л). | 6,863. |
КН2Р04 (0,8 695 моль/л) + Na2HP04 (0,0343 моль/л). | 7,415. |
Na2B407 (0,01 моль/л). | 9,183. |
NaHC03 (0,025 моль/л) + Na2CO:{ (0,025 моль/л). | 10,014. |
При измерении pH со сравнительно невысокой точностью для калибровки можно использовать один раствор, но для более точных измерений необходимо калибровать электрод по двум или даже трем растворам, причем калибровочные растворы выбираются таким образом, чтобы измеряемая величина pH была максимально близкой к pH калибровочных растворов.
Рабочий диапазон для pH-чувствительных стеклянных электродов зависит от состава мембраны и для хороших электродов составляет 0—12 ед. pH. Измерения pH вблизи нижней границы диапазона (pH — 0) обычно дают несколько завышенные результаты (кислотная ошибка). Предполагается, что это связано с разрушением мембраны в сильнокислой среде.
В сильнощелочных растворах (pH >12) начинает заметно сказываться мешающее влияние ионов щелочных металлов (щелочная ошибка). Эта ошибка тем больше, чем больше значение pH и, следовательно, меньше концентрация ионов водорода. Присутствие в растворе металлов с большим, чем у натрия, ионным радиусом вызывает меньшую ошибку по сравнению с катионом натрия. Для хороших электродов коэффициент селективности kH Na ~ 10 12, поэтому при pH = 11-М2 и концентрации иона натрия в растворе на уровне 1 моль/л погрешность измерений составляет около 0,2 ед. pH.
Подбирая соответствующим образом состав стекла мембраны, можно обеспечить высокую селективность и к другим, кроме Н+, ионам, например к катионам натрия и калия.
Кристаллические мембраны изготавливают из индивидуальных кристаллических соединений (LaF3, Ag2S) или гомогенной поликристаллической смеси разных веществ (Ag., S + AgCl, Ag9S + PbS), причем мембрана должна обладать заметной ионной проводимостью при комнатной температуре. Ионная проводимость и высокая селективность кристаллических мембран обусловлены высокой концентрацией, размерами и зарядом вакансий, присутствующих в кристаллической решетке, а низкая растворимость материала мембраны обеспечивает очень низкие пределы обнаружения определяемого иона. Кристаллические мембраны могут изготавливаться из соответствующего монокристалла, прессованного поликристалла или представлять собой инертную матрицу (обычно полимерную), в состав которой в качестве наполнителя включена порошкообразная соль.
Превосходным веществом для изготовления кристаллических мембран является сульфид серебра, обладающий малой растворимостью (ПР — 10 высокой устойчивостью к окислителям и восстановителям, сравнительно низким удельным сопротивлением. Обычно мембрану формируют из прессованного поликристаллического сульфида серебра. В сульфиде серебра подвижными являются ионы серебра, поэтому при контакте мембраны с раствором на границе «мембрана — раствор» устанавливается равновесие, которое характеризуется соответствующим значением граничного потенциала:
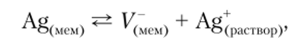
где V~ — отрицательно заряженная вакансия в кристаллической решетке материала мембраны.
Передаточная функция электрода линейна в растворах нитрата серебра в диапазоне концентраций 10 7— 1 моль/л и описывается уравнением.
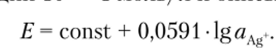 aside class="viderzhka__img" itemscope itemtype="http://schema.org/ImageObject">
aside class="viderzhka__img" itemscope itemtype="http://schema.org/ImageObject">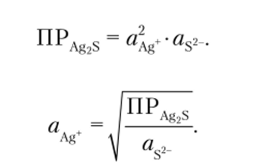
Поэтому потенциал электрода в среде, содержащей сульфид-ионы, определяется упавнением 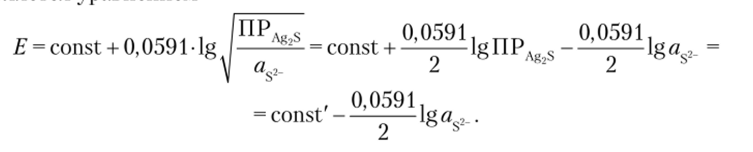
Этот электрод пригоден и для определения сульфид-ионов, так как их активность связана с активностью ионов серебра через произведение растворимости Отсюда Это уравнение хорошо выполняется в диапазоне концентраций сульфид-иона 10 6— 10 2 моль/л.
Существует целый ряд прессованных порошковых мембран из смесей сульфида серебра с другими малорастворимыми неорганическими солями. Сульфид серебра благодаря своей ионной проводимости придает этим мембранам необходимую электропроводность, в то время как второй компонент обеспечивает селективность мембраны по отношению к заданным ионам. Состав соответствующих мембран приведен в табл. 12.3.
Таблица 123
Поликристаллические мембраны на основе смеси порошков сульфида серебра с другими неорганическими солями.
Определяемый ион. | Состав мембраны. |
СГ (ВС или I). | Ag2S/AgCl (AgBr или Agl). |
CN. | Ag2S/AgI. |
Cel2" . | Ag2S/CdS. |
РЬ2" . | Ag, S/PbS. |
Си2" . | Ag, S/CuS. |
Во всех этих случаях первичным является отклик мембраны па ион серебра, чувствительность же по отношению к другим ионам определяется произведением растворимости соответствующей соли, величина которого должна превышать произведение растворимости для сульфида серебра.
Например, для кадмий-селективного электрода.

Наиболее совершенным электродом с кристаллической мембраной является фторид-селективный электрод. Мембрана его выполнена из пластинки монокристалла фторида лантана, легированного для увеличения концентраций вакансий фторидом двухзарядного катиона. Обычно для этих целей используются фториды бария или европия.
При контакте мембраны с анализируемым раствором ионы фтора перераспределяются относительно межфазной границы «мембрана — раствор» в соответствии с активностью (концентрацией) фторид-ионов в растворе. При этом переход ионов фтора в жидкую фазу сопровождается появлением положительно заряженных вакансий в кристаллической решетке фторида лантана. Таким образом, возникает межфазная разность потенциалов, величина которой зависит от активности ионов фтора в растворе.
Градуировочная функция этого электрода имеет линейную зависимость относительно логарифма активности ионов фтора в диапазоне содержания F 10 6—1 моль/л. Определению фторид-ионов не мешает присутствие в анализируемом растворе даже 1000-кратного избытка посторонних ионов за исключением ОН, А13+ и Fe3. Катионы алюминия и железа связывают анионы фтора в прочный комплекс, а в сильнощелочной среде фторид лантана, вероятно, превращается в гидроксид по реакции.
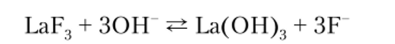
В сильнокислой среде работа электрода нарушается из-за образования слабодиссоциирующих молекул НЕ Фторид-селективный электрод уже много лет выпускается промышленностью и успешно используется для определения фтора в самых разных объектах: почвах, минералах, природных водах, пищевых продуктах, биологических жидкостях. На основе этого электрода создана автоматическая система контроля процесса фторирования питьевой воды.
В настоящее время, используя относительно высокую электропроводность кристаллических мембран, ионоселективные электроды делают и без внутреннего раствора, напрямую соединяя металлический проводник с мембраной. Такие электроды получили название твердотельных, или электродов с твердым контактом. Они удобнее и проще в использовании, чем классические ионоселективные электроды с внутренним раствором.
Электроды с подвижными носителями по конструкции похожи на стеклянные, но имеют жидкую мембрану — раствор реагента (ионофора) в органическом растворителе, удерживаемый на пористом полимере и селективно реагирующий с определяемым ионом.
Жидкие мембраны должны отвечать следующим основным требованиям: они не должны смешиваться с водой, должны иметь низкую летучесть, обратимо реагировать с определяемым ионом и обладать хотя бы небольшой электропроводностью, которая, вероятно, в большинстве случаев обусловлена транспортом ионов через мембрану молекулами реагентов.
Селективность мембраны зависит как от свойств ионофора, так и от свойств органического растворителя. Так, если для растворения дидодецилфосфата кальция используют диоктилфенилфосфонат, то электрод пригоден для определения ионов кальция в присутствии 100-кратного избытка магния. Но если растворителем является деканол-1, электрод начинает одинаково реагировать на ионы кальция и магния. Такой электрод можно использовать для определения жесткости воды.
В современных электродах с подвижными носителями используется принцип иммобилизации компонентов жидкой мембраны в объеме пленки из поливинилхлорида (ПВХ). Это оказалось возможным потому, что компоненты жидких мембран, как правило, являются прекрасными пластификаторами для ПВХ. Они понижают температуру стеклования полимера, что обеспечивает получение гомогенных, гибких и прочных пленок. Обычно ПВХ мембраны для ионселективных электродов в среднем содержат около 30% по массе ПВХ и 70% пластификатора. Количество требуемого ионофора составляет только около 1% и включается в количество пластификатора.
Одним из лучших электродов этого тина является К-селективный электрод, который приобрел огромное значение и применяется практически повсеместно для определения содержания калия в биологических жидкостях. В качестве ионофора для такого электрода используется макроциклический антибиотик валиномицин. В валиномицинс шесть карбонильных атомов кислорода направлены к центру полости молекулы.
Ион калия по размерам полностью соответствует внутренней полости молекулы валиномицина и, по-видимому, удерживается молекулой за счет ион-дипольного взаимодействия с шестью карбонильными атомами кислорода. Этим объясняется селективность данного ионофора по отношению к калию, а благодаря реакции комплексообразования осуществляется быстрый и обратимый обмен ионами калия между мембраной и анализируемым раствором.
При изготовлении калий-селективной мембраны в качестве пластификатора обычно используется ди (2-этилгексил)себацинат. Электрохимическая ячейка для определения калия описывается следующей схемой:
Ag, AgCl|nac. КС1|| 10% NH4N03|| исследуемый раствор | мембрана | ОД М KCl|AgCl, Ag.
Особенность этой ячейки заключается в том, что между насыщенным хлоридсеребряным электродом сравнения и исследуемым раствором помещен солевой мостик с нитратом аммония, который предназначен для того, чтоб предотвратить загрязнение исследуемого раствора ионами калия из насыщенного раствора хлорида калия.
Механизм формирования граничного потенциала описывается уравнением 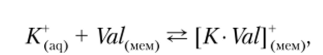
где Val — молекула валиномицина, а К• Vaiy — катионный комплекс калия и валиномицина, иммобилизованных в мембране. Для этого электрода уравнение Нернста можно записать в виде.
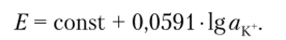
В настоящее время известны также сенсоры с полимерными мембранами для определения некоторых наиболее распространенных анионов. В этих мембранах в качестве ионофора используют анионообменник, а селективность соответствует так называемому ионообменному ряду Гофмейстера: 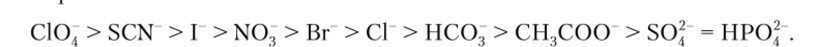
Например, определению нитрат-ионов не будут мешать все остальные ионы, располагающиеся в ряду Гофмейстера правее N03. Этот факт позволяет разработать достаточно селективный нитрат-чувствительный электрод, что является весьма актуальной задачей, обусловленной необходимостью контроля содержания нитратов в продуктах питания, природных водах, почве и гидропонных питательных растворах.
В нитрат-чувствительных электродах успешно используются два типа ионофоров. Один из них представляет собой четвертичные аммониевые соли, такие как нитрат три (н-додецил)метиламмония ((C12H25)3CH3N~N03) или нитрат тетра (н-додецил)аммопия ((C12H25)4N+ N03). Пластификатором в этом случае является дибутилфталат, а типичная мембрана состоит из 66% пластификатора, 33% I1BX и 1% ионофора.
Второй тип — нитраты комплексных катионов переходных металлов, таких как нитрат трис (4,7-дифенил- 1,10-фенантролин) никеля (П).
Объемный катион прочно удерживается в мембране, в то время как нитрат-ион достаточно подвижен и легко переходит в водную фазу обеспечивая равновесие на границе «мембрана — раствор» и формирование граничного потенциала.
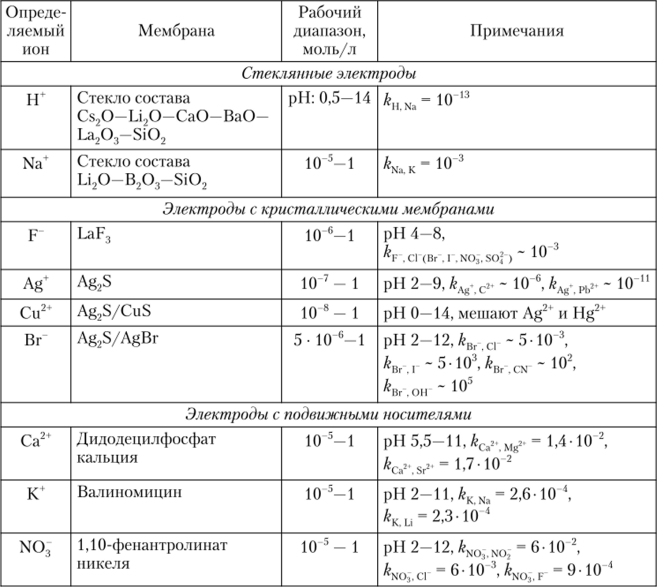
Характеристики некоторых из вышерассмотренных ионоселективных электродов приведены в табл. 12.4.
Таблица 12.4
Характеристики некоторых ионоселективных электродов.
Газочувствительные электроды представляют собой электрохимическую ячейку, содержащую промежуточный раствор электролита, который отделен от окружающей среды газопроницаемой мембраной, и два электрода — индикаторный (обычно — ионоселективный) и электрод сравнения, помещенные в промежуточный раствор. Определяемый газ, попадая через газопроницаемую мембрану в электрохимическую ячейку, взаимодействует с промежуточным раствором, в результате чего происходит изменение какого-либо параметра этого раствора, например pH. Это изменение фик;
сируется ионоселективным электродом, причем величина его потенциала пропорциональна парциальному давлению определяемого компонента в анализируемом газе или концентрации в анализируемом растворе. В табл. 12.5 приведены примеры реализации газочувствительных электродов.
Таблица 125
Типы газочувствительных электродов.
Опреде ляемый газ. | Индикаторный электрод. | Состав внутреннего раствора. | Химическая реакция. | Предел обнаружения, мг/м3 |
С02 | Стеклянный рНчувствительный. | 10 2М NaHC03 + + 10 2М NaCl. | со2 + н2о ^ нсо3 + Н+ | |
SO,. | Стеклянный рНчувствительный. | 10 3М NaHS03 | so2 + h2o^hco3 + h'. | |
NH3 | Стеклянный рНчувствительный. | 10~2М NH, C1 + + 10 ‘М KN03 | nh3 + н, о ^ nh; + он; | |
HF. | F-селективный. | 1 М н+ | HF ^ Н+ + F" . | 0,2. |
H, S. | S-селективпый. | Цитратный буферный раствор, pH = 5. | H2S^HS +н+ HS-^S2+ н*. | 3,4. |
При низком парциальном давлении газа отклик газочувствительных электродов может быть достаточно медленным. Время отклика иногда составляет несколько минут, так как механизм формирования сигнала электрода включает стадии диффузии газа через газопроницаемую мембрану и установления равновесия с внутренним раствором электролита. Однако при высоких парциальных давлениях газа эта проблема снимается (равновесие в системе устанавливается за время менее 1 мин).
Ферментные электроды — это ионоселективные электроды, покрытые слоем фермента, вызывающего реакцию органического или неорганического вещества (субстрата) с образованием частиц (ионов, молекул), обусловливающих отклик электрода. Каждый фермент катализирует только один тип реакции, поэтому ферментные электроды обладают высокой селективностью.
В качестве примера рассмотрим электрод для определения мочевины CO (NH2)2. Он представляет из себя аммоний-селективный стеклянный электрод, на внешнюю поверхность которого нанесен слой полиакриламидного геля, содержащий фермент уреазу. Электрохимическая ячейка, используемая для измерения концентрации мочевины в анализируемом образце, может быть описана следующим образом:
Ag, AgCl|nac. КС1||исслед. раствор | гель с уреазой|стекл. мембрана 10,1 М HCl|AgCl, Ag.
При погружении такого электрода в исследуемый раствор содержащаяся в нем мочевина диффундирует внутрь геля, где протекает реакция.
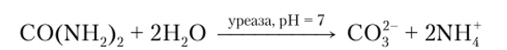
Образовавшиеся ионы аммония регистрируются ионоселективным электродом. Зависимость между потенциалом электрода и концентрацией мочевины описывается уравнением.
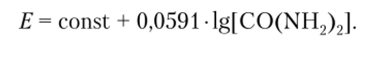
В целом для ферментных электродов характерно медленное достижение равновесия, так как механизм формирования сигнала включает стадию диффузии молекул аналита внутрь ферментного слоя.
Некоторые другие примеры реализации ферментных электродов приведены в табл. 12.6.
Таблица 12.6
Тины ферментных электродов.
Определяемое вещество. | Фермент. | Электрохимически активная частица. | Индикаторный электрод. |
Пенициллин. | Пенициллиназа. | н+ | Стеклянный рН-чувствительный. |
Муравьиная кислота. | Ал когол ьокс идаза. | о о. м. | С02-газовый. |
Глюкоза. | Гл юкозооксидаза. | 1 Г. | Стеклянный рН-чувствитсльный. |
Фосфат-ион. | Щелочная фосфатаза. | о2 | Платиновый. |
Модифицированными называются электроды, на поверхность которых тем или иным способом наносятся вещества, способные селективно взаимодействовать с молекулами определяемого компонента, вызывая соответствующий отклик на электроде. Наиболее просто модификации подвергаются электроды, изготавливаемые по толстопленочной технологии. В этом случае модифицирующий компонент (например, фермент или комплексон) обычно вводится в состав электропроводящей пасты на стадии ее изготовления. Затем эта паста наносится либо на поверхность проводящей основы (например, металлической проволоки), либо, через соответствующий трафарет, задающий форму и геометрические размеры будущего толстопленочного электрода, на диэлектрическую подложку. После термообработки электрод приобретает необходимые механические свойства.
Например, добавлением в пасту пульпы банана, которая содержит в своем составе полифенолазы, были получены электроды для определения дофамина и других катехоламинов.
Введение
в состав пасты комплектна 2,9-диметил-1,10-фенантролина позволило получить Си+-селективный электрод с пределом обнаружения ионов одновалентной меди на уровне 3 10' моль/л, причем присутствие в анализируемом растворе ионов Cu2+, Zn2+, Со2+, РЬ2+, Ni2" и Ре2+ вообще не создавало помех, а помехи от иона серебра были очень незначительными.
Модификация электрода может быть проведена нанесением па его поверхность соответствующей полимерной пленки. Для получения таких пленок обычно используют три типа полимеров: проводящие, ионообменные и редокс-полимеры. Часто для придания полимерному покрытию определенных электрохимических характеристик в полимер дополнительно вводят те или иные функциональные группы. Модифицированные таким образом электроды в основном используются для вольтамперометрического метода анализа, хотя некоторые из них применяются также в потенциометрии и кондуктометрии.
Как правило, электрохимические ячейки с ионоселективными электродами имеют очень высокое сопротивление — порядка 108 Ом. Для точного измерения потенциала вольтметр должен иметь входное сопротивление на несколько порядков выше, чем сопротивление ячейки, для того чтобы минимизировать величину тока в измерительной цени и тем самым уменьшить погрешность измерения. В настоящее время для этих целей используются электронные цифровые вольтметры с входным сопротивлением порядка 1011—1012 Ом. Эти приборы (рис. 12.1) называРис. 12.1. Внешний вид ются иономерами или pH-метрами и имеют мономера.

шкалу, калиброванную в милливольтах или единицах pH.
Для более точных измерений потенциала используются различные компенсационные методы, суть которых заключается в том, что измеряемая разность потенциалов компенсируется с использованием внешнего источника напряжения так, чтобы в измерительной цени отсутствовал ток. Чаще всего для этого используют потенциометр Погендорфа. В этом случае в процессе измерений электрохимическая ячейка находится в условиях термодинамического равновесия.
Разновидность прямой нотенциометрии, в которой в качестве индикаторных используются ионоселективные электроды, называется ионометрией. Это удобный и простой метод, для которого продолжительность анализа определяется временем подготовки пробы, поскольку на процедуру измерений тратится не более 1—2 мин. От других физико-химических методов ионометрия отличается прежде всего простотой методик и портативностью и дешевизной измерительной аппаратуры, которая способна работать не только в лаборатории, но и в нолевых условиях.
Для ионометрической ячейки измеряемая разность потенциалов Ех на ее электродах запишется как.
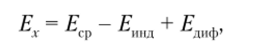
где Еср — потенциал электрода сравнения; Епт — потенциал индикаторного электрода; Етф — диффузионный потенциал.
Согласно уравнению Нернста для ионоселективного электрода.
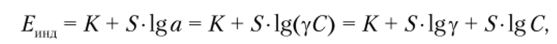
где у — коэффициент активности. Если коэффициент активности в процессе измерений остается постоянным, то.
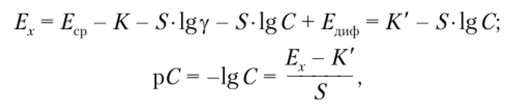
где К' = ?ср + ?лиф -S-lgy = const.
Таким образом, для проведения измерений необходимо либо оценить, либо исключить константу К'. На практике для этого используют один из трех методов: метод калибровки электрода, метод калибровочного (градуировочного) графика или метод добавок.
Самый быстрый и простой из них — метод калибровки электрода. Чтобы вычислить К', достаточно измерить потенциал электрода в растворе с известной концентрацией определяемого иона (стандартном растворе). При этом величина S считается равной теоретической (S = 0,0591/г для 25°С). Использование двух стандартных растворов позволяет определить одновременно К' и S. Недостатком этого метода является предположение о неизменности констант для всего рабочего диапазона электрода, что не всегда выполняется, тем более если не предпринимать специальных мер для обеспечения постоянства ионной силы растворов. Поэтому при использовании этого метода концентрацию стандартного раствора стараются подобрать как можно ближе к концентрации анализируемого раствора.
Более точным методом является метод калибровочного графика, который для обеспечения постоянства коэффициента активности предусматривает добавление одинакового избытка индифферентного электролита (корректора ионной силы) во все стандартные и анализируемые растворы. Метод работает даже в том случае, если уравнение Нернста по каким-то причинам перестает выполняться. В этом случае калибровочный график является нелинейным, однако это не мешает проведению анализа.
И наконец, оптимальным в случае анализа растворов сложного состава является метод добавки, основанный на измерении потенциала электрода в анализируемом растворе (?,) и после добавления к нему известного объема стандартного раствора (Е2). Так как.
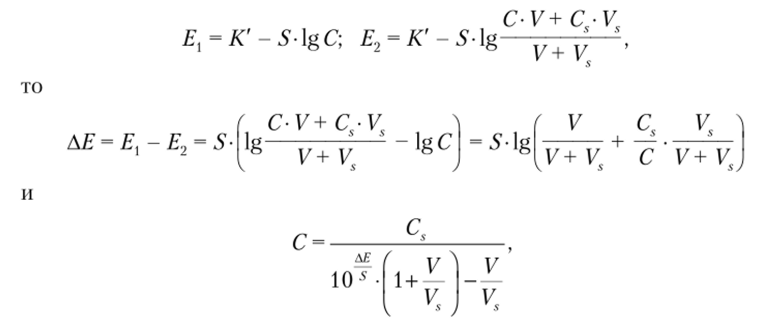
где Cs — концентрация стандартного раствора; V и Vs — объем анализируемого раствора и добавки соответственно. Метод предполагает, что величина S известна заранее либо принимается равной теоретической.
Модификацией рассмотренного метода является метод многократной добавки. Его суть заключается в том, что в анализируемый раствор несколько раз добавляют стандартный раствор и каждый раз измеряют величину электродного потенциала. После добавления стандартного раствора к анализируемому разность потенциалов на электродах электрохимической ячейки будет равна.
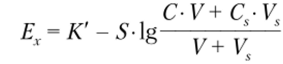
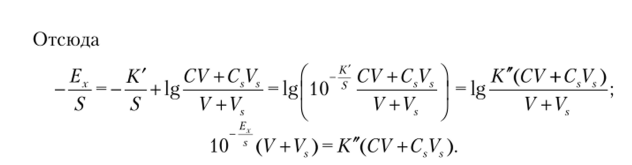
_Ь_.
Таким образом, зависимость 10 ' (У + VS) от общего объема добавки Vs представляет собой прямую (график Грана), причем точка пересечения этой прямой с осью абсцисс отвечает такому объему стандартного раствора, содержание определяемого компонента в котором равно содержанию его в анализируемом растворе. Поэтому справедливо соотношение.
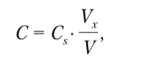
где Vx — объем стандартного раствора, соответствующий на графике точке пересечения его с осью абсцисс.