Политропные процессы.
Теплотехника в 2 т. Том 1. Термодинамика и теория теплообмена

Выведем уравнение для такого общего процесса, воспользовавшись уравнением первого закона термодинамики в виде. Изменение внутренней энергии и энтальпии в политропном процессе рассчитывается соответственно по (2.2) и (2.6). Уравнение политропного процесса в координатах Ts получим, если подставим в формулу для ds значение с из (2.21): Все политропные процессы в зависимости от показателя политропы п… Читать ещё >
Политропные процессы. Теплотехника в 2 т. Том 1. Термодинамика и теория теплообмена (реферат, курсовая, диплом, контрольная)
Уравнение политропного процесса.
Политропными называют процессы, протекающие при постоянной теплоемкости: с = const.
Выше были рассмотрены простейшие процессы, в которых один из параметров состояния (р, v, Т и л) оставался постоянным. В общем же случае при процессах, протекающих в тепловых двигателях с подводом или отводом теплоты, изменяются все параметры состояния.
Выведем уравнение для такого общего процесса, воспользовавшись уравнением первого закона термодинамики в виде.
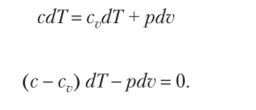
или Подставляя в это уравнение значение dT из продифференцированного уравнения состояния, получаем.
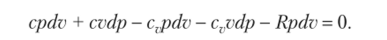
После приведения подобных с учетом уравнения Майера (1.27) получим.
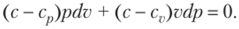
Разделив обе части полученного равенства на (с — сг;) pv и обозначив будем иметь.
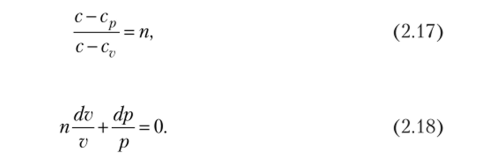
После интегрирования и потенцирования получим.
pv" = const. (2.18а) Уравнение (2.18а) является искомым уравнением общего термодинамического процесса, называемого политропным. Величину п в этом уравнении называют показателем политропы.
Таким образом, политропным называют процесс с произвольным подводом или отводом теплоты, подчиняющийся уравнению pvn = const.
Политропных процессов может быть бесконечное множество, и у каждого будет свое значение п. Оно может быть произвольным в пределах -оо<�п< +, но постоянным в рассматриваемом процессе.
При некоторых частных значениях п уравнение pvn = const превращается в уравнение рассмотренных четырех простых процессов:
- • при п = k —> pvk = const (адиабатный процесс);
- • при п = 1 —> pv = const (изотермический процесс);
- • при п = 0 —"р = const (изобарный процесс);
- • при п —" ± °° —" v = const (изохорный процесс).
Внешнее сходство уравнения политропы с уравнением адиабаты позволяет использовать формулы, полученные из уравнения адиабаты, для политропных процессов с заменой в них k на п. Зависимости между параметрами состояния в политропном процессе выражаются следующими формулами:
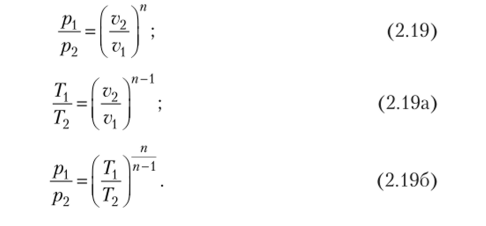
Удельная работа изменения объема в политропном процессе определяется следующим образом.
Уравнение первого закона термодинамики для политропного процесса при переходе рабочего тела из состояния 1 в состояние 2
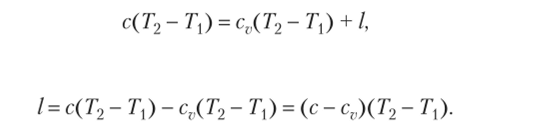
откуда.
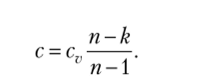
Значение теплоемкости в политропном процессе может быть найдено из (2.17):
Отсюда следует, что теплоемкость политропного процесса зависит от свойств рабочего тела и показателя политропы п. Тогда.
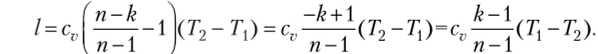
С учетом уравнения Майера ср= cv + R (1.27) и ранее выведенного соотношения при определении работы адиабатного процесса.
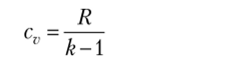
очевидно, что формулы для работы в политропном процессе аналогичны (2.16) выведенным для адиабатного процесса и имеют вид.
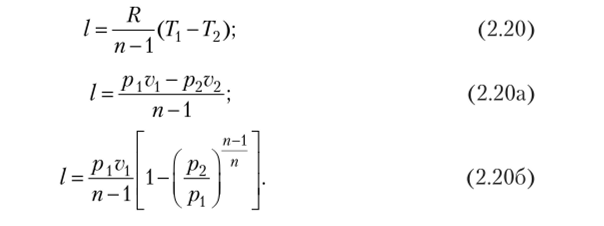
Изменение внутренней энергии и энтальпии в политропном процессе рассчитывается соответственно по (2.2) и (2.6).
Значение теплоемкости в политропном процессе может быть найдено с помощью (2.17):

Из (2.21) следует, что теплоемкость политропного процесса зависит от свойств рабочего тела и показателя политропы п.
Количество теплоты, участвующей в политропном процессе, определяется по формуле.
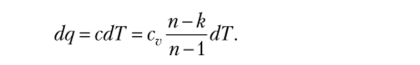
Интегрируя это выражение, получаем.

Все политропные процессы в зависимости от показателя политропы п могут быть разделены на три группы:
- • I группа: 0 < п < 1;
- • II группа: 1 < п < k
- • III группа: п > к.
Взаимное расположение политроп расширения и сжатия с различными значениями п, проходящими через точку 1, на диаграмме pv приведено на рис. 2.7, а.
Уравнение политропного процесса в координатах Ts получим, если подставим в формулу для ds значение с из (2.21):
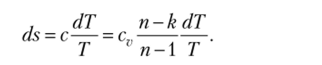
Интегрируя это уравнение, найдем.

Взаимное расположение политроп с различными значениями п, проходящими через точку 1, на диаграмме Ts дано на рис. 2.7, 6.