Влияние катализаторов на скорость химических реакций

Ускорить или замедлить протекание химической реакции, а также наступление равновесия в системе можно путем введения в нее небольших добавок некоторых веществ, количество которых не изменяется в ходе реакции. Вещества, ускоряющие реакцию, называют катализаторами, а замедляющие — ингибиторами. Это явление носит название положительного или отрицательного катализа. Различают катализ гомогенный… Читать ещё >
Влияние катализаторов на скорость химических реакций (реферат, курсовая, диплом, контрольная)
Ускорить или замедлить протекание химической реакции, а также наступление равновесия в системе можно путем введения в нее небольших добавок некоторых веществ, количество которых не изменяется в ходе реакции. Вещества, ускоряющие реакцию, называют катализаторами, а замедляющие — ингибиторами. Это явление носит название положительного или отрицательного катализа. Различают катализ гомогенный и гетерогенный, в зависимости от того, находится катализатор в одной или различных фазах с реагирующими веществами.
Рассмотрим протекание реакции, А + В = АВ в присутствии катализатора (рис. 1.4). Допустим, что реакция между веществами, А и В протекает с очень малой скоростью Vx, но при введении в систему определенного вещества скорость реакции существенно возросла. По окончании реакции количество добавленного вещества не изменилось. Роль катализатора можно объяснить изменением механизма протекания реакции. По всей вероятности, она протекает в несколько стадий:
1) катализатор К взаимодействует, например, с веществом Л. По всей вероятности, энергия активации этой реакции мала, и реакция протекает с большой скоростью:
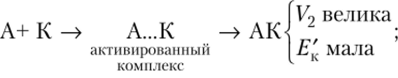
2) образующееся промежуточное соединение АК взаимодействует с веществом В с выделением катализатора в свободном виде. Энергия активации этой реакции также мала, и реакция протекает с большой скоростью:
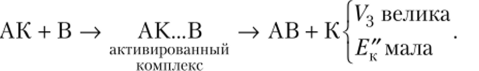
Суммируя оба уравнения, получаем.
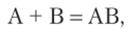
т.е. в результате реакции катализатор остался без изменения.
На рис. 1.4 графически изображены энергетические схемы реакции без катализатора (1) ив присутствии катализатора (2).
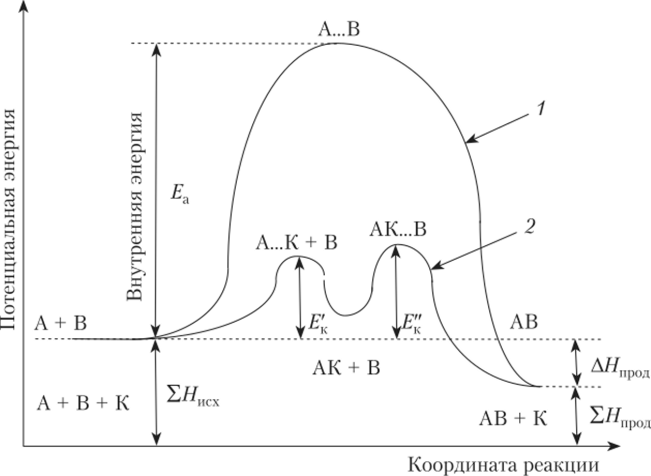
Рис. 1.4. Энергетические схемы реакции:
1 — без катализатора; 2 — с участием катализатора; Н — внутреннее теплосодержание системы в исходном (Х#исх) и конечном (Х^прод) состояниях, АН — изменение внутреннего теплосодержания системы;
Е.л — энергия активации прямой реакции в отсутствие (Е.л) и в присутствии катализатора (Ек)
Из рис. 1.4 видно, что в присутствии катализатора энергия активации реакции снижается на величину Д?к. Таким образом, основной причиной ускоряющего действия катализаторов является уменьшение энергии активации вследствие изменения пути протекания реакции. Снижение энергии активации в присутствии катализаторов ДЕк тем значительнее, чем активнее катализатор. Так, энергия активации реакции 2HI = Н2 + 12 при использовании в качестве катализатора золота снижается на 79 кДж, а в присутствии более активного катализатора, платины, на 115 кДж. Так как в уравнении Аррениуса значение ДЕк. входит в показатель, такие значения снижения ДЕк приводят к увеличению скорости реакции в десятки и сотни тысяч раз.
Катализаторы обладают избирательным действием. Но некоторые из них, например вода и платиновые металлы, способны катализировать многие различные, но характеру реакции. Действие катализаторов зависит от присутствия посторонних веществ. Некоторые из них способны усиливать (активировать) действие катализаторов и называются промоторами, а вещества, прекращающие действие катализаторов, называются каталитическими ядами.