Для объяснения природы химической связи в комплексных соединениях в настоящее время применяют:
- — метод валентных связей;
- — теорию кристаллического поля;
- — метод молекулярных орбиталей.
Метод валентных связей
Вид гибридизации и структура комплекса определяются электронным строением центрального иона и природой лиганда.
Химическая связь образуется по донорно-акцепторному механизму, причем лиганд выступает в качестве донора (предоставляет для образования связи готовые электронные пары), а комплексообразователь — в качестве акцептора (предоставляет пустые ячейки).
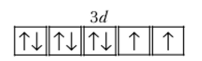
Рассмотрим комплексы никеля с различными лигандами. Атом никеля имеет электронное строение валентных уровней 4s23#. Ион Ni2+ (4.v°3#) является акцептором. При образовании комплексного иона тетрахлороникеля (Н) донором является лиганд хлорид-ион, имеющий электронное строение валентного уровня Cl 3s23p6.
Распределение валентных электронов в ионе Ni2+ можно представить схемой.
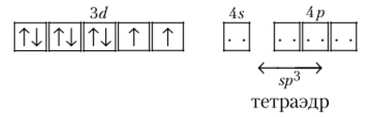
1. Комплексный ион тстрахлороникеля (Н) [NiCl4]2~ парамагнитен, что объясняется наличием в валентном Зб/-подуровне двух неспаренных электронов. Четыре лиганда С1_ образуют sp3- допорпо-акцепторные связи. Комплексный ион имеет тетраэдрическое строение.
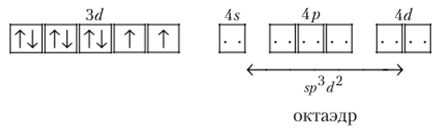
2. Комплексный ион гексаамминникеля (И) [Ni (NH3)6]2+ тоже парамагнитен и отличается достаточной прочностью (К" = 6 • 10-9). Шесть лигандов образуют шесть гибридных 5/?3^2-связей, и комплекс имеет форму октаэдра:
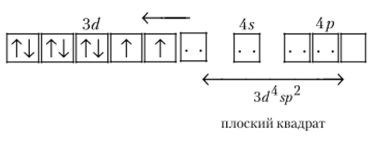
3) Комплексный ион тетрацианоникеля (Н) [Ni (CN)4]2_ диамагнитен и очень прочен (Кн = 3*10 16). Диамагнитные свойства объясняются отсутствием в ионе никеля непарных электронов, так как один из валентных электронов против правила Гунда перешел в уже занятую ячейку, освободив одну 3<�У-ячейку для электронной пары лиганда. Образуются четыре очень прочные гибридные связи 3dAsp2 (участие в гибридизации внутреннего ЗгУ-уровня обеспечивает большую прочность). Комплексный ион имеет плоское квадратное строение:
Координационному числу 2 отвечает sp-гибридизация и линейное строение.
Метод валентных связей (ВС) успешно объясняет связь координационного числа с геометрической формой комплекса, описывает магнитные свойства и предсказывает реакционоснособность соединения. Однако оптические свойства (например, спектры поглощения) объяснить с позиций метода ВС нельзя.