Торий.
Фундаментальная радиохимия

Определение тория в почве, иле и растительности с реактивом арсеназо III основано на предварительном извлечении тория из пробы путем соосаждения с кальцием в виде оксалата, очистке от примесей на анионите АВ-17 с последующим фотометрическим определением с арсеназо III. Чувствительность метода 2 10 6 г/проба; погрешность ±10%. В природных и сточных водах торий определяют фотометрическим методом… Читать ещё >
Торий. Фундаментальная радиохимия (реферат, курсовая, диплом, контрольная)
Торий (Thorium) Th — химический элемент 3-й группы, 7-го периода периодической системы, первый член семейства актинидов, Z = 90, атомная масса 232,0381. Открыт в 1828 г. (в виде оксида) Й. Берцелиусом. Назван торием в честь всемогущего скандинавского божества Тора — бога войны, грома и молнии. Металлический торий получен в 1882 г. Л. Нильсоном. Радиоактивность тория открыта в 1898 г. независимо друг от друга одновременно М. Склодовской-Кюри и Г. Шмидтом.
На данный момент известны 30 изотопов тория и еще 3 возбужденных изомерных состояния. Самый легкий изотоп 209Th (Г½ = 7 мс), самый тяжелый 238Th (Г½ = 9,4 м). Только 232Th (Г, 2 = 14,05−10° л) обладает достаточно большим периодом полураспада по отношению к возрасту Земли, поэтому практически весь природный торий состоит только из этого нуклида. Некоторые из его изотопов могут определяться в природных образцах в следовых количествах, так как входят в радиоактивные ряды: 227Th (Т. 2 = 18,68 дней), 228Th (Г, 2 = = 1,9116 л), 229Th (Г½ = 7340 л),™Th (Г|/2 = 75 380 л), 2%h (Г,2 = 25,52 ч), 234Th (Г½ = 24,1 дня). Средняя энергия а-излучения 22fiTh, 227Th, 228Th, 229Th, 230Th, 232Th равна соответственно 6,42; 5,95; 5,49; 4,95; 1,38−10 2; 4,07 МэВДБк-с).
Торий-228 — историческое название радиоторий (RdTli) — открыт в 1905 г. Отто Ганом. Принадлежит к радиоактивному семейству 232Th. 228Th непосредственно образуется в результате (3 -распада нуклида 228Ac (MsTh2 — дочерний MsThl (228Ra); Tl/2 = 6,15 ч):
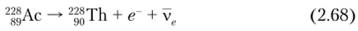
Кроме того, 228Th образуется при р'-распаде 228Ра и а-распаде 232U:
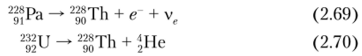
228Th а-радиоактивен (Г½ = 1,9116 л, энергия распада 5,52 МэВ) дочерним нуклидом является 221 Ra:
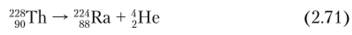
Энергия а-частиц: Еа = 5,42 МэВ, 72,2% и Еа = 5,34 МэВ, 27,2%.
Для 228Th существует также чрезвычайно низкая вероятность кластерного распада (с испусканием ядра 20() и образованием 208РЬ; вероятность события 1,13−10 п%):

Торий-230 — историческое название ионий (1о) — открыт в 1907 г. Б. Болтвудо.м. Принадлежит к радиоактивному семейству 238и.
- 230Th образуется в результате следующих распадов:
- • рраспад 230Ас (Г½ =122 с):
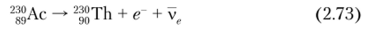
• Р'-распад 230Ра (Т½ = 17,4 дней): 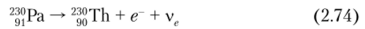
• а-распад 234U (Г|/2 = 2,455• 105 л):

230Th а-радиоактивен (Г,/2 = 7,538−104 л, энергия распада 4,77 МэВ), дочерний нуклид 22BRa (энергия распада 4,77 МэВ):
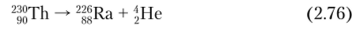
Энергия испускаемых а-частиц 4,687 МэВ (76,3%) и 4,620 МэВ (23,4%).
Для этого нуклида существует также чрезвычайно низкая вероятность кластерного распада (с испусканием ядра 24Ne и образованием ядра 20(!Hg; вероятность события 5,6−10 «%). Спонтанное деление нуклида разрешено законами сохранения, но экспериментально не обнаружено (вероятность менее 5−10 и%).
Торий-231 (UY) — продукт а-распада 235U, Г, 2 = 25,5 ч, испытывает (3 -распад, дочерний нуклид 231Ра. В промышленности получают по реакции 232Th («, 2»)231Th.
Торий-232 — основной изотоп тория. Относится к обширному радиоактивному 4и-семейству (массовый номер каждого из нуклидов в этом ряду может быть представлен в виде А = Ап) генетически связанных радионуклидов, начинающемуся с 256Es (Г, 2 = 25,4 м), и сам является родоначальником природного радиоактивного семейства тория, в котором имеет место цепочка радиоактивных превращений, заканчивающаяся образованием стабильного 208РЬ. В ряду тория имеется радиоактивный газ — торон (220Rn). Активность 1 г Th равна 4070 Бк. С 232ТЬ в равновесии находится 228Th (Г½ = = 1,91 л, аи у-излучатель).
В настоящее время родоначальником ряда тория (4я-семейства) считается 256Es, распадающийся по схеме:
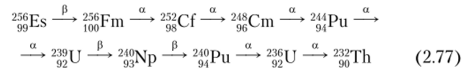
Предшественником ториевого семейства является 248Сш (Г, 2 = 3,39−105 л).
Сечение захвата тепловых нейтронов изотопом 232Th 7,31 барн/атом.
232Th образуется в результате следующих распадов:
• (3 -распад нуклида 232Ас (Т[/2 = 119 с): 
• 7С-захват, осуществляемый нуклидом 232Ра (Г, 2 =1,31 дня):
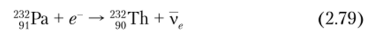
• а-распад нуклида 236U (Г½ = 2,342? 107 л):

232ТЬ подвергается ядерному делению под действием быстрых нейтронов и может использоваться в качестве воспроизводящего материала для получения 233U. Сечение захвата тепловых нейтронов изотопом 232ТЬ 7,31 барн/атом.
Распад 232Th происходит, но следующим направлениям (рис. 2.14):
• а-распад в 228Ra (вероятность 100%, энергия распада 4,081 МэВ), энергия испускаемых а-часгиц 3,947 МэВ (в 21,7% случаев) и 4,012 МэВ (в 78,2% случаев):

- • спонтанное деление (вероятность 11−10 , 0%);
- • кластерный распад с образованием нуклидов 24Nc и 2(>Ne (вероятность распада менее 2,78−10 10%):
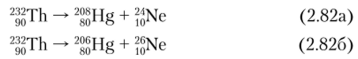
• двойной рраспад (с чрезвычайно малой вероятностью, энергия распада 0,838 МэВ):
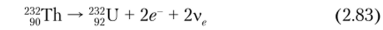
Торий-234 (UX,) — изотоп ряда 238U, Т½ = 24,1 дня, образуется при а-распаде 238U (Г½ = 4,468 • 109 л, энергия распада 4,27 МэВ), Ризлучатель, дочерний нуклид 234Ра (Г, 2 = 6,7 ч, энергия распада 2,197 МэВ), распадается (Г, 2 = 1,17 м) на 234 U.
В природных объектах под влиянием нейтронной бомбардировки постоянно образуются изотопы 227Th, 228Th, 230Th, 231Th, 232Th и 234Th.
Торий — один из источников радиоактивного фона Земли. Содержание тория в минерале торианите составляет 45—88%, в минерале торите — до 62%. Содержание тория в речной воде 8,1 • 10 4 Бк/л. Это на порядок ниже, чем урана, и на два порядка ниже, чем 40К (3,7 • 10~2 Бк/л).
Тория в природе больше, чем урана. Содержание тория в земной коре 8 10^4 вес.% — столько же, сколько свинца.
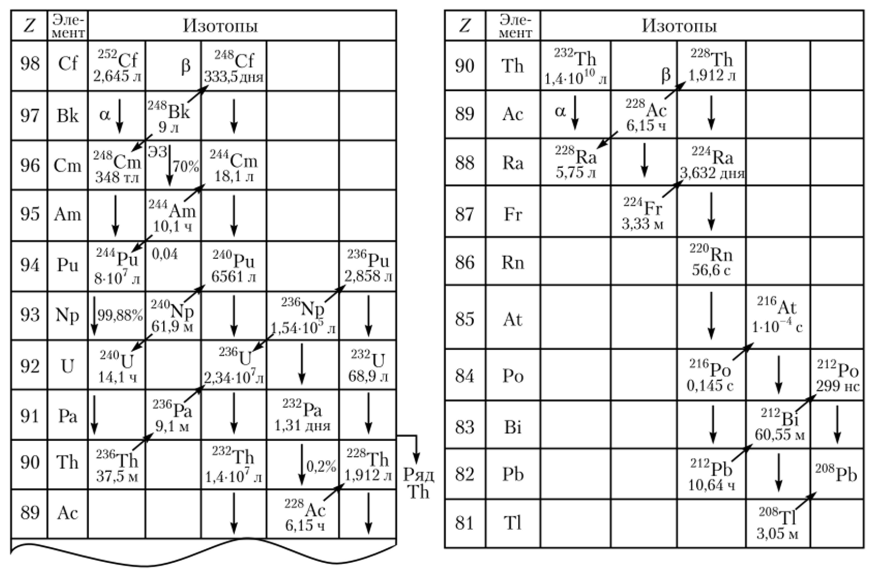
Рис. 2.14. Радиоактивное семейство 4п (включая природный ряд 232Th).
В природных соединениях торий связан с ураном, РЗЭ и цирконием, относится к типично литосферным элементам и концентрируется преимущественно в верхних слоях литосферы. Торий обнаружен более чем в 100 минералах, представляющих собой кислородные соединения, преимущественно оксиды и значительно реже — фосфаты и карбонаты. Основными промышленными минералами тория являются монацит (Се, La, Th, …)Р04, торит ThSi04 и торианит (Th, U)02. Торит очень богат торием (45 до 93% Th02), но редок, так же, как и другой богатый гориевый минерал — торианит (Th, U)02, содержащий от 45 до 93% Т1Ю2. Важный минерал тория — монацитовый песок. В общем виде его формулу записывают в виде (Се, Th) P04, но он содержит кроме церия еще лантан, празеодим, неодим и другие РЗЭ, а также уран. Тория в монаците от 2,5 до 12%. Богатые монацитовые россыпи есть в Бразилии, Индии, США, Австралии, Малайзии. Известны и жильные месторождения этого минерала — на юге Африки.
Монацит — минерал прочный, устойчивый против выветривания. Ручьи и реки уносят его к морю вместе с другими устойчивыми минералами — цирконом, кварцем, минералами титана. Волны морей и океанов довершают работу по разрушению и сортировке минералов, накопившихся в прибрежной зоне. Под их влиянием происходит концентрирование тяжелых минералов, отчего пески пляжей приобретают темную окраску. Так на пляжах формируются монацитовые россыпи — радиоактивные «черные пески».
Электронная конфигурация тория | Rn]6rP7.v2, работа выхода электронов 3,51 эВ, радиус атома 0,18 нм, ковалентный радиус 0,165 нм, радиус иона (+4е) 0,102 нм, электроотрицательность по Полингу 1,3, энергия ионизации 670,4 кДж/моль (6,95 эВ), степени окисления 4, 3, 2, 1 (основная 4+), плотность 11,724, Гпл = 1842 °C, ГКИ|| = 4788 °C, теплота плавления 16,11 кДж/моль, теплота испарения 513,7 кДж/моль, молярная теплоемкость 26,23 Дж/(К-моль), молярный объем 19,8 см3/моль, температура Дебая 100 К, теплопроводность (27°С) 54 Вт/(м К), удельное электросопротивление 15−10 6 Ом см (25°С). До 1400 °C устойчива кубическая гранецентрированная решетка, а = 0,5086 нм, выше этой температуры кубическая объемно-центрированная, а = 0,41 нм. При температуре 1,3 К торий становится сверхпроводником.
Торий — серебристо-белый, пластичный, мягкий, вязкий, ковкий металл, легко подвергающийся механической обработке, стойкий к окислению в чистом виде, но обычно медленно тускнеющий до темного цвета с течением времени. Химически активен.
Торий медленно разрушается холодной водой, но в горячей воде скорость коррозии тория и сплавов на его основе в сотни раз выше, чем у алюминия. Порошок металлического тория пирофорен (его хранят под слоем керосина). При нагреве в воздухе он загорается и горит ярким белым светом. При сильном нагреве он взаимодействует с водородом, галогенами, серой, азотом, кремнием, алюминием и рядом других элементов. Торий плохо растворяется в основных кислотах, за исключением соляной. Он малорастворим в серной и азотной кислотах. Металлический торий растворим в концентрированных растворах НС1 и HN03 в присутствии иона фтора.
Торий по внешнему виду и температуре плавления напоминает платину, но удельному весу и твердости — свинец. Хотя торий относится к семейству актинидов и должен быть аналогом церия, по химическим свойствам он близок к Ti, Zr и Hf. В соединениях ионного или ковалентного типа торий почти исключительно четырехвалентен. При образовании полуметаллической связи (например, в сульфидах, карбидах и др.) наблюдаются иногда значительные отклонения от нормальной валентности. Ион Th4+ отличается сильной склонностью к гидролизу и образованию комплексных соединений.
Th02 имеет структуру флюорита, получается при сжигании тория на воздухе. Прокаленный Th07 почти не растворяется в растворах кислот и щелочей; процесс растворения в азотной кислоте резко ускоряется при добавлении незначительных количеств ионов фтора. Оксид тория является довольно тугоплавкой субстанцией — его температура плавления 3300 °C — самая высокая из всех оксидов и выше большинства других материалов, за несколькими исключениями.
Известно много галогенидов тория: три хлорида, три бромида, три иодида и фторид (валентности тория в этих соединениях: 4+, 3+ и 2+). Хлориды и фторид бесцветны, бромиды и иодиды желтого цвета. Безводный ТЬС13 очень гигроскопичен. Для практики наиболее важны ThF4 и ТЫ4. Первый используют для получения тория электролизом и для растворения его в азотной кислоте: чистый торий в чистой HN03 не растворяется, необходима добавка фторида. Тетраиодид же используют для получения тория высокой чистоты, так как при температуре выше 90 °C это соединение способно к термической диссоциации: 
При нагревании тория в атмосфере водорода до 400…600°С образуется его гидрид ThH2. Если, не меняя условий, начать снижать температуру, то при 250…320°С происходит дальнейшее насыщение тория водородом и образуется гидрид состава Th4H15. Иногда гидриды тория применяют для получения высокочистого тория.
Нитрат тория известен в виде кристаллогидратов с 1, 2, 3, 4,5,6 и 12 молекулами воды; есть указания на существование безводной соли. Товарный нитрат представляет собой соль состава Th (N03)4 • 5,5Н20, хорошо растворим в воде и во многих кислородосодержащих органических растворителях — спиртах, кетонах, эфирах. Это обстоятельство используется в технике для извлечения нитрата тория из водных растворов несмешивающимися с водой органическими растворителями, при наличии в водной фазе высаливателей — нитратов некоторых металлов первых трех групп периодической системы. В связи со значительным различием коэффициента распределения нитратов тория и РЗЭ между водной и органической фазами обеспечивается эффективное их разделение.
Фосфаты тория известны в виде средней Th3(P04)4-4H20 и кислой Th (HP04)7— Н20 солей, выделяющихся из водных солей тория при добавлении соответственно Н3Р04 и Na2HP04. Фосфаты нерастворимы в воде, но растворяются в кислотах. Описан также гипофосфат ThP205 nH20, выделяющийся в виде аморфного осадка при взаимодействии раствора нитрата тория с гипофосфатом натрия.
При взаимодействии растворов солей тория со щелочами или аммиаком выделяется осадок гидрооксида Th (OH)4, причем осаждение начинается при pH 3,5, в то время как гидрооксиды трехвалентных РЗЭ осаждаются при pH 7, что используется для грубого разделения тория и РЗЭ. Гидрооксид тория отличается основным характером — растворяется в разбавленных кислотах и не растворяется в щелочах; легко растворим в растворах некоторых солей, например карбонатов щелочных металлов, оксалатов аммония и др. с образованием комплексных соединений. При нагреве выше 470 °C Th (OH)4 превращается в Th02.
При растворении гидроксида тория в кислотах или солей тория в воде образуется ион Th4+, который обладает большим зарядом, относительно малым радиусом и большим числом электронных уровней, свободных для образования донорноакцепторных связей с электронодонорными лигандами. Это объясняет склонность тория к образованию многочисленных интерметаллических (с Na, Си, Hg, Zn, А1 и другими металлами) и комплексных соединений с неорганическими и органическими лигандами.
В кислых растворах с pH < 3 Th (IV) гидролизовап мало, но при больших значениях pH имеет место сильный гидролиз:
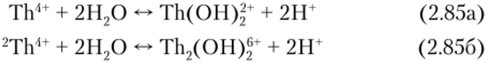
При pH > 3,5 торий в микроконцентрациях образует коллоидный гидроксид.
Торий образует растворимые в воде комплексные соединения с анионами различных кислот, например хлоридами, нитратами, карбонатами, оксалатами, цитратами и др., причем кристаллогидраты содержат до 9 молекул воды. С анионами С1″, ClO. j и Вг03 торий образует только катионные комплексы состава [ТЬА]4-Я, где п= 1, 2, 3. В присутствии всех других лигандов торий в зависимости от условий может находиться в форме как катионных, так и анионных комплексов. Торий образует много двойных солей: нитраты тория и щелочных металлов или аммония, например NaN03Th (N03)4-9H20. Примерами нерастворимых солей тория являются ThF4-4H20, Th (C204)2-6H2Q Th3(P04)4, ТЬ (НР01)2.НзР01.Н2а ThP20,-2H2Q Th (0H)2Cr04 • Н26 и др.
С одноосновными кислотами торий образует комплексные ионы состава ThA3+, ThA2+, ThA3, где, А — анион кислоты. Наиболее устойчивые комплексные ионы тория получаются с наиболее слабыми кислотами. С азотной кислотой торий образует комплекс состава H[Th (N03)5], со фтористоводородной кислотой — H|ThF5] и H2[ThFG|. Основной карбонат тория растворяется в избытке осадителя с образованием карбонатного комплекса H6[Th (C03)5]. Оксалат тория растворим в оксалатах аммония и щелочных металлов с образованием комплексов составов: (NH4)4[Th (C204)4] и Me4[Th (C204)4], где Me1 — одновалентный (щелочной) металл. Для Th (IV) характерны координационные числа 6,8 и реже 10 и 12. Большое число комплексных соединений торий образует с малонатами, тартратами, цитратами и солями других органических кислот. Эти комплексные соединения разрушаются в сильных кислотах, но устойчивы в щелочных растворах.
Характерным свойством тория является также его способность образовывать соединения с альдегидами, кетонами, аминами, внутрикомплексные соединения с 8-оксихинолином, ацетилацетоном, комилексонами (например, с ЭДТА) и др.
Торий получают переработкой монацитового песка, который перемешан с кварцевым, цирконовым, рутиловым. Поэтому первая стадия производства тория — получение чистого монацитового концентрата. Для отделения монацита используют разные способы и приспособления. Первоначально грубо отделяют его на дезинтеграторах и концентрационных столах, используя разницу в плотности минералов и их смачиваемости различными жидкостями. Тонкого разделения достигают путем электромагнитной и электростатической сепарации. Полученный таким образом концентрат содержит 95…98% монацита. Отделение тория затруднено, поскольку монацит содержит элементы, по свойствам близкие к торию, — РЗЭ и уран.
Из многочисленных методов вскрытия монацитовых концентратов промышленное значение имеют лишь два:
1. Обработка крепкой серной кислотой при 200 °C (сульфатизация):
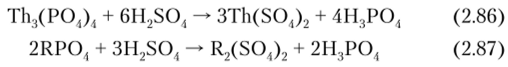
где R — сумма редкоземельных элементов.
Образующиеся сульфаты тория, урана и РЗЭ растворимы в воде.
2. Обработка тонкоизмельченного концентрата 45%-ным раствором NaOH при 140°:
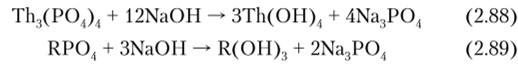
Здесь ценнейшие компоненты монацита остаются в осадке в виде твердых гидроксидов, которые затем превращают в растворимые соединения.
Отделение урана и тория от РЗЭ происходит на стадии процесса экстракции. Чаще всего из водных растворов торий и уран экстрагируют несмешивающимся с водой трибутилфосфатом (ТБФ). Разделение урана и тория происходит на стадии избирательной реэкстракции. При определенных условиях торий из органического растворителя перетягивается в водный раствор HN03, а уран остается в органической фазе. После отделения тория его соединения превращают в металл. Распространены два способа: восстановление ТЬ02 или TliF, металлическим кальцием и электролиз расплавленных галогенидов тория. Продуктом этих превращений является ториевый порошок, который спекают в вакууме при 1Ю0…1350°С.
Отделение тория от большинства элементов, кроме Y, Sc и РЗЭ, производится в виде оксалата. При осаждении тория йодатом калия с ним соосаждаются Sc, Ti и Zr, а также четырехвалентные Се и U. При предварительном введении Н702 Се восстанавливается до трехвалентного, a U окисляется до шестивалентного, что предотвращает их осаждение. Для отделения тория применяется также ряд органических реагентов — себациновая, фениларсоновая, и м-нитробензойная кислоты. Методы выделения тория из минералов типа монацита и отделения его от сопутствующих РЗЭ основаны на экстракции тория ТБФ из азотнокислых растворов после его отделения от основной массы РЗЭ дробным осаждением менее растворимого сульфата тория. Для количественного извлечения тория необходимо проведение многоступенчатого процесса экстракции.
В аналитической химии для экстракционного выделения тория широкое применение нашли хелатообразующие реагенты (8-оксихинолии и др.) и высокомолекулярные амины. Кроме того, для аналитического выделения тория могут быть использованы методы осаждения и соосаждения, а также метод ионообменной хроматографии. Последний основан на том, что TIP* сильно адсорбируется катионитами и в отличие от Ме3+, Ме2+ и Ме+ не вымывается растворами соляной и азотной кислот любой концентрации. В качестве элюента для тория используются растворы комплексующих реагентов (чаще всего раствор щавелевой кислоты концентрацией 0,5 моль/л). Малая устойчивость анионных комплексов тория с хлориди нитрат-ионами позволяет отделять его от урана, нептуния и плутония, а также других переходных элементов, образующих комплексы, адсорбируемые анионитами. Методы соосаждения со специфическими (La, Се) и неспецифическими (Fe (OH)3, BiPO/4 и др.) носителями используются для получения препаратов 228,230,234Th, применяемых в качестве радиоактивных индикаторов.
При весовом определении тория используется осаждение щавелевой кислотой с прокаливанием оксалата до диоксида или же осаждение и взвешивание двойного йодата тория и калия. Из объемных методов применяют комплексометрическое титрование в присутствии ряда индикаторов. В основу колориметрических методов положены реакции образования окрашенных соединений тория с органическими реагентами, чаще всего с реактивом «ТОРОН» красно-фиолетового цвета и арсеназо III (сине-красного цвета).
При определении тория используются гравиметрические, объемные, колориметрические и радиометрические методы. Стандартным гравиметрическим методом является осаждение тория растворами аммиака или щавелевой кислоты с последующим прокаливанием до ТЬ02. Объемные методы основаны на титровании трилоном-Б или осаждении тория в виде труднорастворимых соединений постоянного состава и определении его по избытку осадителя. Для определения малых количеств тория применяются колориметрические методы с использованием реактива «ТОРОН» или я-арсоновой кислоты, а также радиометрические методы. Известен также метод радиометрического титрования тория. Титрование в этом случае производится фосфатом натрия, меченным радиоактивным изотопом фосфора 32Р. В связи с этим радиометрическое определение тория производится по продуктам его распада при наличии радиоактивного равновесия. Качественно и полуколичественно торий можно определять методами оптического спектрального ренгеноспектралыюго анализа. Чувствительность рентное нейтрального определения тория достигает 0,1%.
Непосредственное радиометрическое определение тория (232Th) затруднено из-за его очень большого периода полураспада. Радиохимическое определение тория в случае равновесия с его продуктами распада возможно по накоплению торона. Используется также радиометрический метод определения тория по a-излучению продуктов распада. Часто аналитическое определение тория проводится по торону. При этом через раствор исследуемого препарата продувают непрерывную струю воздуха, увлекающую эманацию тория в эманационную камеру, в которой измеряется радиоактивность газа и сравнивается с эталоном тория.
Сейчас торий используется для легирования некоторых сплавов. Торий заметно повышает прочность и жаростойкость сплавов на железной, никелевой, кобальтовой, медной, магниевой или алюминиевой основе. Большое значение имеют многокомпонентные сплавы на магниевой основе, содержащие торий, а также Zn, Zr и Мп; сплавы отличаются небольшим удельным весом, хорошей прочностью, высокой стойкостью при повышенных температурах. Эти сплавы применяют для деталей реактивных двигателей, управляемых снарядов, электронной и радарной аппаратуры.
ТЬ02 применяют в производстве газокалильных сеток ламп газового освещения. Колпачки из оксидов церия и тория увеличивают яркость и преобразовывают спектр пламени газовых горелок — свет их становится ярче, ровнее. Торий применяется как катализатор в процессах органического синтеза, крекинга нефти, при синтезе жидкого топлива из каменного угля, гидрирования углеводородов, а также в реакциях окисления NH3 до HN03 и S02 до S03. Торий используется как геттер в электронной промышленности.
Важнейшей областью применения тория является ядерная техника. Существуют атомные реакторы, в которых в качестве топлива используются металлический торий, карбид тория, Th3Bi5 и др., часто в смеси с ураном и его соединениями. 232Th не способен делиться тепловыми нейтронами, но он является источником вторичного ядерного горючего (233U), получаемого по ядерной реакции на тепловых нейтронах.

233U — ядерное горючее, поддерживающее цепное деление и имеющее некоторое преимущество перед 235U: при делении его ядра выделяется больше нейтронов. Каждый нейтрон, поглощенный ядром 239Рн или 235и, дает порядка 2,05 новых нейтронов, a 233U — 2,37.
Определение тория в почве, иле и растительности с реактивом арсеназо III основано на предварительном извлечении тория из пробы путем соосаждения с кальцием в виде оксалата, очистке от примесей на анионите АВ-17 с последующим фотометрическим определением с арсеназо III. Чувствительность метода 2 10 6 г/проба; погрешность ±10%. В природных и сточных водах торий определяют фотометрическим методом с арсеназо III. Чувствительность метода 2−10 3 мг Th/л; погрешность ±10%. Метод определения тория в почве, золе костей и молоке основан на соосаждении тория с оксалатом и последующем фотометрическим определением с реактивом «ТОРОН». Чувствительность метода 10 5 г/проба; погрешность ±20%. Определение суммы изотопов тория в почве, иле и растительности основано на выделении изотопов на катионообменной смоле с последующей сорбцией на люминофоре и измерении их a-активности. Для определения выхода изотопов тория используют радиоактивный индикатор — p-активный 231Th, который добавляют в пробу перед проведением анализа. Чувствительность метода 1,85 -10 3 Бк/проба.
Как ни странно, поступление тория в желудочно-кишечный тракт (тяжелый металл, к тому же радиоактивный!) не вызывает отравления. Объясняется это тем, что в желудке — кислая среда, и в этих условиях соединения тория гидролизуются. Конечный продукт — нерастворимый гидрооксид тория — выводится из организма. Острое отравление способна вызвать лишь нереальная доза в 100 г тория. Чрезвычайно опасно попадание тория в кровь. При работе с торием и его соединениями возможно поступление в организм как самого тория, так и его дочерних продуктов. Наиболее вероятным путем проникновения аэрозольных частиц или газообразного продукта являются органы дыхания. Торий может поступать в организм также через Ж КТ и кожу, особенно поврежденную, имеющую мелкие ссадины, царапины. Торий образует прочные комплексы с белками, аминокислотами и органическими кислотами.
Гигиенические нормативы изотопов тория: 227Th — группа Б, М3 А 3,7 • КГ Бк; 228' 230Th группа А, МЗА = 3,7* 103 Бк; 231Th — группа В, МЗА = 3,7 • 105 Бк; 232 234Th — группа Г, МЗА = = 3,7 • 106 Бк, торий естественный — группа Г, МЗА 3,7 • 106 Бк (900 г).
Поступление тория в организм в течение суток составляет от 0,05 до 4 мг, а выделение его с мочой и калом — 0,1 и 2,9 мкг соответственно. Величина всасывания тория из Ж КТ составляет 1 • 10 1. Для растворимых комплексных соединений тория в концентрации 1—200 мг/мл она колеблется от 7 • 10 3 до 1 • 10 Нерастворимые соединения тория могут длительное время задерживаться в легких. Значительные количества тория концентрируются в пульмональных лимфатических узлах. Распределение в организме тория зависит от пути введения. При внутривенном введении содержание радионуклида в почках, печени, селезенке и крови относительно больше, чем при подкожном или внутриартериальном введении. При введении небольших количеств тория он в основном откладывается в костях. При высоких дозах увеличивается депонирование тория в костном мозге. 228Th депонируется исключительно на поверхности костей, в то время как продукты распада накапливаются во всем объеме минеральной части кости. При нанесении на неповрежденную кожу нерастворимых соединений тория незначительные количества их обнаруживаются в крови; в случае растворимых соединений — в крови и внутренних органах. Наибольшее количество тория выделяется в первые дни после поступления в организм.
При поступлении тория через органы дыхания его количество в организме определяется измерением концентрации торона (220Rn) в выдыхаемом воздухе. Поведение торона в организме существенно отличается от других продуктов распада. При вдыхании он смешивается с легочным воздухом, диффундирует из легких в ток крови со скоростью, примерно равной 20% в 1 мин, и разносится по организму. Т: торона из крови составляет 4,5 мин.
Меры профилактики: предупреждение поступления в воздух аэрозолей и газообразных продуктов распада тория. При работе с изотопами тория необходимо соблюдать санитарные правила и нормы радиационной безопасности с применением специальных мер защиты в соответствии с классом работ. В качестве неотложной помощи проводится дезактивация рук и лица водой с мылом, промывание полости рта и носоглотки. Внутрь противоядие от тяжелых металлов или активированный уголь. Рвотные, мочегонные средства, промывание желудка водой. При ингаляционном поражении (пыль, аэрозоль) — внутрь отхаркивающие. Внутривенно 10 мл 5%-ного раствора пентацина.