Давление пара над растворами полимеров

Идеальном; 2 — хорошем; 3 — плохом Для идеального раствора А2 = 0 и зависимость л/с от с выражается прямой, параллельной оси абсцисс; при А2 > 0 растворитель является хорошим, и тем в большей степени, чем больше угол наклона прямых на указанной зависимости. Если А2 < 0, то растворитель является термодинамически плохим. В табл. 2.3 представлены значения А2 для некоторых систем «полимер… Читать ещё >
Давление пара над растворами полимеров (реферат, курсовая, диплом, контрольная)
Идеальными называют растворы, образование которых происходит без изменения объема (V = 0, AVj_= 0), сопровождается нулевым тепловым эффектом (ДЯ= 0, AHj = 0) и идеальной энтропией смешения (Д5ид):
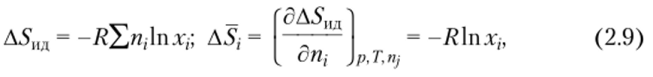
т.е. энтропией, изменяющейся по тому же закону, что и при смешении идеальных газов. В уравнении (2.9) ASj — изменение парциальной молярной энтропии г-го компонента при смешении; щ — число моль z-ro компонента в растворе; Xj — его молярная доля в смеси. Следовательно, изменение химического потенциала z-ro компонента при образовании идеального раствора равно.
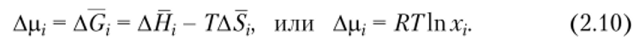
Если пар z-ro компонента над раствором подчиняется законам идеальных газов (а уравнение (2.9) это предполагает), то химический потенциал этого компонента в растворе равен.

где р? — химический потенциал z-го компонента в стандартном состоянии; pi — парциальное давление пара z-ro компонента над раствором.
В то же время химический потенциал чистого компонента в тех же условиях равен.

где pf — давление пара над чистым z-м компонентом.
Следовательно, изменение химического потенциала при переходе от чистого z-ro компонента к его раствору равно.
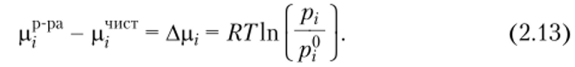
Из уравнений (2.10) и (2.13) следует, что Xj = pjpf. Последнее выражение впервые было эмпирически установлено Ф. Раулем и называется законом Рауля. Этот закон справедлив для идеальных растворов, т. е. растворов, образованных смешением сходных по химическому строению и размерам молекул вещества.
Большинство реальных растворов не являются идеальными. В них так же, как и в идеальных, при повышении концентрации растворенного вещества парциальное давление пара уменьшается, но при этом наблюдаются как положительные (Pi/pf > х,), так и отрицательные (Pi/pf < xt) отклонения от идеальности. Отрицательные отклонения свидетельствуют об уменьшении числа молекул данного компонента в паровой фазе, т. е. о хорошем взаимодействии компонентов в растворе. Положительные отклонения от идеальности являются следствием плохого взаимодействия между компонентами в растворе, поэтому молекулы растворителя стремятся перейти в паровую фазу в большем количестве, что и приводит к возрастанию рх.
Парциальное давление пара, измеряемое над раствором полимеров, является давлением пара только растворителя (полимер не может быть переведен в газообразное состояние), которое всегда меньше, чем давление пара над чистым растворителем. Для растворов полимеров характерны резко отрицательные отклонения от идеальности (рис. 2.4). Поскольку для термодинамически устойчивых растворов рх < Pi у то из уравнения (2.13) следует, что Ар, < 0, т. е. химический потенциал каждого компонента в растворе меньше, чем в чистом виде. С этим связано также и осмотическое давление растворов.
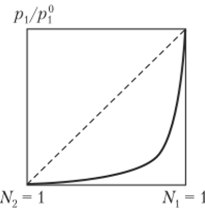
Рис. 2.4. Изменение давления пара над раствором полимера (пунктир — идеальный раствор).
Осмотическое давление растворов полимеров. Если разделить раствор и растворитель полупроницаемой перегородкой, через которую могут диффундировать только молекулы растворителя, то вследствие неравенства химических потенциалов растворителя по обе стороны перегородки его молекулы начнут перемещаться в раствор, повышая его уровень и гидростатическое давление на перегородку. Следовательно, стремление молекул растворителя к самопроизвольному проникновению в раствор, вызванное неравенством Др, — < 0, можно оценить давлением л, называемым осмотическим:

где р и ро — давление на перегородку со стороны раствора и растворителя соответственно в условиях равновесия.
Можно отметить, что осмотическое давление раствора равно добавочному давлению, которое необходимо приложить к раствору для того, чтобы химический потенциал растворителя в растворе стал равен химическому потенциалу чистого растворителя. В дифференциальной форме это можно записать в следующем виде:

отсюда.

где V, — парциальный молярный объем г-го компонента (растворителя). Для несжимаемого раствора V) = const, поэтому после интегрирования уравнения (2.16) с учетом соотношения (2.14) получим.
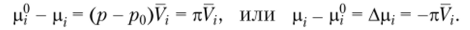
Следовательно,.

Осмотическое давление коренным образом отличается по своей природе от газового, т. е. не является результатом ударов молекул о стенки сосуда или о полупроницаемую мембрану. Осмотическое давление — это термодинамическое сродство между компонентами раствора, отнесенное к единице объема растворителя. Чем выше осмотическое давление, тем больше абсолютное значение Ар, и термодинамическое сродство между компонентами, тем более хорошим является растворитель для данного вещества.
Второй вириальный коэффициент является важным параметром, характеризующим качество растворителя. Рассмотрим раствор полимера в низкомолекулярном растворителе, обозначая индексом 1 растворитель и индексом 2 — полимер. Подставив в уравнение (2.17) Др, из выражения (2.10), получим.
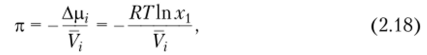
но так как х = 1 — х2, то к = —=^1п (1 — х2).
м" .
Для малых значений х2 (разбавленные растворы) последнее выражение можно переписать в виде.
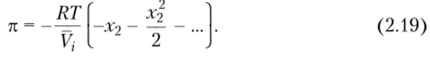
При больших разбавлениях можно взять только первый член в скобках, пренебрегая остальными, и записать.

Молярная доля полимера в растворе .Г2 = п2/(пл + п2) (п и п2 — число молей растворителя и полимера), но при больших разбавлениях, когда П п2, можно с достаточной степенью точности принять х2 ~ п2/щ. Тогда уравнение (2.20) запишется в виде.

так как riV = V — объем растворителя; с2 = n2/V — концентрация растворенного вещества (полимера), моль/л. Уравнение (2.21) было впервые эмпирически установлено Я. X. Вант-Гоффом и носит его имя. Поскольку п2 = g2/M2, то.
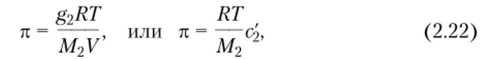
где с2 = g2/V — концентрация растворенного вещества, г/л или г/мл.
Если представить уравнение (2.21) в виде п/с2 = RT> то становится очевидной независимость приведенного осмотического давления п/с2 от концентрации. Однако даже для разбавленных растворов полимеров уравнение Вант-Гоффа неприменимо и концентрационная зависимость приведенного осмотического давления в координатах п/с2 — с2 представляется чаще всего кривыми линиями, математическое описание которых может быть дано в виде ряда:
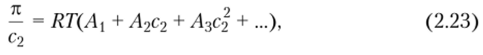
где АI, А2, Л3,… — так называемые вириальные коэффициенты, которые вычисляют по эмпирическим зависимостям к/с2 = f (c2). В общем случае эта зависимость выражается кривыми, вогнутыми к оси абсцисс, однако для малых концентраций полимера с достаточной степенью точности можно ограничиться двумя членами уравнения (2.23). Как следует из сопоставления уравнений (2.22) и (2.23), первый вириальный коэффициент А = 1 /М2, поэтому, предположив, что Л3и высшие вириальные коэффициенты равны нулю, уравнение (2.23) можно представить в виде.

Для растворов одной фракции полимера в различных растворителях зависимость л/с2 = /(с2) при A:i = 0 выражается серией веерообразных прямых, сходящихся в одной точке оси ординат (рис. 2.5). Отсекаемый на этой оси отрезок равен ЯТ/М2, и его величина не зависит от природы растворителя. Угол наклона прямых характеризует второй вириальный коэффициент А2: при одинаковой концентрации полимера чем больше л (и следовательно, АрД, тем больше Л2. Следовательно, этот коэффициент является мерой термодинамического сродства растворителя к полимеру.
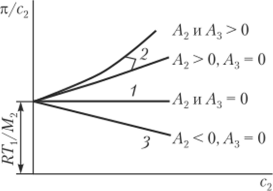
Рис. 25. Зависимость я/с2 от концентрации полимера в различных растворителях:
1 — идеальном; 2 — хорошем; 3 — плохом Для идеального раствора А2 = 0 и зависимость л/с от с выражается прямой, параллельной оси абсцисс; при А2 > 0 растворитель является хорошим, и тем в большей степени, чем больше угол наклона прямых на указанной зависимости. Если А2 < 0, то растворитель является термодинамически плохим. В табл. 2.3 представлены значения А2 для некоторых систем «полимер — растворитель». Можно отметить, что при близкой температуре для одного и того же полимера (полистирола) один растворитель является хорошим (дихлорэтан), а другой — плохим (циклогексан).
Таблица 2.3
Значения второго вириального коэффициента для некоторых еистем «полимер — растворитель».
Полимер | М-10″3 | Растворитель. | Т/С | л2юЛ м3— мол ь/кг2 |
Полистирол. | Толуол Дихлорэтан Циклогексан. |
|
| |
Полиизобутилен. | Бензол Циклогексан. |
|
| |
Поливинилацетат. | Ацетон Метилэтилкетон. |
|
|
Изменение термодинамических параметров при растворении полимеров. Зная давление пара над раствором полимера или его осмотическое давление, можно рассчитать по уравнениям (2.13) и (2.17) Др) для растворителя. Для другого компонента (полимера) Др2 рассчитывают, зная величину Дрь по уравнению Гиббса — Дюгема.
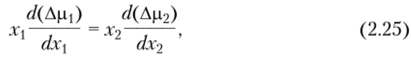
где л'] и л'2 — молярные доли растворителя и полимера в растворе.
Для расчета удобнее пользоваться удельным химическим потенциалом, отнесенным к 1 г каждого компонента. По известным значениям Др,л и Др)'1 рассчитывают среднюю свободную энергию смешения, отнесенную к 1 г раствора:
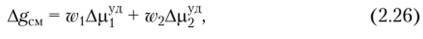
где wi и w2 — массовые доли растворителя и полимера в растворе.
Изменение молярной свободной энергии смешения при образовании раствора полимера определяют по уравнению.
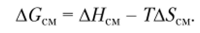
Растворение происходит самопроизвольно, если при этом уменьшается свободная энергия, т. е. GCM < 0. Это возможно в случаях, представленных в табл. 2.4.
Из приведенных в таблице данных следует, что изменение энтальпии и энтропии при растворении может происходить различным образом — и увеличиваться, и уменьшаться, но критерием самопроизвольности образования раствора является неравенство AGCM < 0. Например, в случае атермического растворения (ДН = 0) этот процесс определяется изменением энтропии, но при этом Д5СМ ^ -Д1пх, (иначе это был бы идеальный раствор).
Энтальпия при растворении полимеров изменяется вследствие изменения межмолекулярного взаимодействия при переходе.
Таблица 2.4
Изменение термодинамических параметров при растворении полимеров.
АН | AS | АС | Характер смешения. | Примеры. |
<0. | <0. | Экзотермический. | Нитроцеллюлоза — циклогсксанол. | |
<0. | <0. | <0. | Экзотермическим. | Яичный альбумин — вода. |
= 0. | <0. | <0. | Атермический. | Полиизобутилен — изооктан. |
>0. | >0. | <0. | Э ндотерм ически й. | Натуральный каучук — бензол. |
от разделенных полимера и растворителя к их гомогенной смеси (раствору). Энтальпия, или теплота смешения, определяется по уравнению.
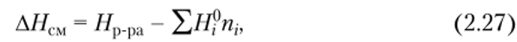
где Яр.ра — энтальпия раствора; Hf — сумма энтальпий компонентов.
Энтальпия смешения равна интегральной теплоте растворения, т. е. теплоте растворения данного количества одного компонента в определенном количестве другого при постоянных давлении и температуре (Qp = ДЯсм). Интегральную теплоту растворения относят к единице массы растворенного вещества или раствора. Если при растворении выделяется теплота, то растворение является экзотермическим, энтальпия системы уменьшается и АН < 0. Если при растворении поглощается теплота, то оно является эндотермическим, энтальпия системы возрастает и АН > 0.
Каждый компонент в растворе характеризуется парциальной энтальпией Я/, которая равна приращению энтальпии раствора заданной концентрации при добавлении малого количества компонента i при постоянных давлении, температуре и постоянном количестве молей других компонентов:

Разность между парциальной энтальпией и энтальпией 1 моль чистого i-го компонента^ДЯ/°) называют парциальной энтальпией смешения ДЯ, = Я/ - Я/°, которая есть не что иное, как дифференциальная теплота растворения[1] (смешения):

Из сопоставления интегральных теплот растворения некоторых полимеров (табл. 2.5) можно сделать следующие общие заключения. Растворение неполярных полимеров в неполярных растворителях сопровождается, как правило, небольшими тепловыми эффектами, причем растворение некоторых полимеров в собственных гидрированных мономерах часто протекает атермически (АН = 0) — системы «полиметилметакрилат — метилизобутират», «поливинилацетат — этилацетат».
Таблица 2.5
Интегральные теплоты растворения некоторых полимеров при 25 °C.
Полимер | М? 1(Г3 | Растворитель. | ДЯ, Дж/г. |
Полиизобутилен. | и-Пентан и-Гексан н-Октан «-Тетрадекан. |
| |
Натуральный каучук. | —. | Бензол Хлороформ. |
|
Поливинилацетат. | Этилацетат Ацетон. |
| |
Поливиниловый спирт. | Этанол Вода. |
| |
Полистирол. | Этилбензол Бензол Метилэтилкетон Ацетон. |
| |
Полиметилметакрилат. | Мсти л изобу ти рат Дихлорэтан. |
| |
Целлюлоза. | —. | Ч етверти ч н ые ам мои иевые основания. | — 147. |
В случае таких систем энергия взаимодействия между участками макромолекул (?22) и между молекулами растворителя {Е) практически равна энергии взаимодействия между молекулами растворителя и структурными звеньями макромолекул (2?'12), т. е. АН = 1 — Е'22 + 2Е12 = 0. Отклонение от атермичного растворения полистирола в этилбензоле (смешение указанных компонентов является экзотермическим) обусловлено рыхлостью (иеравновесностью) упаковки макромолекул этого полимера в конденсированном состоянии, т. е. существенным увеличением ?22;
Значительные тепловые эффекты возникают при растворении полярных полимеров в полярных растворителях (см. табл. 2.5), особенно когда это связано с образованием прочных водородных связей между ними или с формированием сольватных оболочек (растворение целлюлозы в четвертичных аммонийных основаниях).
Энтальпию смешения при образовании раствора полимера можно рассчитать, зная температурную зависимость свободной энергии смешения, по уравнению Гиббса — Гельмгольца.
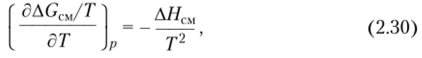
которое справедливо и для парциальных величин:

Для расчета необходимо измерить AG или Дщ при нескольких температурах.
Изменение энтропии при образовании растворов полимеров.
Разность между энтропией раствора и суммой энтропий компонентов называют энтропией смешения:

Еще Д. У. Гиббсом было показано, что при образовании бинарных идеальных растворов изменение энтропии соответствует изменению энтропии при смешении идеальных газов:
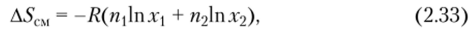
где П и п2 — число смешиваемых компонентов.
Применительно к растворам полимеров П. Флори и М. Хаггинс показали справедливость уравнения (2.33) для энтропии смешения:

где (р| = п/(п + п2г) и ф2 = п2г/(п{ + п2г) — объемные доли; П> п2 — число молей растворителя и полимера соответственно; г — число сегментов макромолекулы, эквивалентных, но размеру молекуле растворителя.
Однако определяемая энтропия смешения А5СМ при образовании растворов полимеров оказывается больше (в большинстве случаев) или меньше, чем вычисленная, но уравнению (2.34). Причина этого заключается в разупорядочении или, наоборот, упорядочении в расположении молекул исходных веществ при смешении. Общая энтропия смешения складывается из двух составляющих: комбинаториальной и некомбинаториальной:
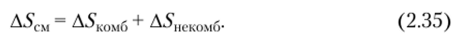
Комбипаториалышя энтропия смешения обусловлена только перестановками в расположении молекул исходных веществ: в растворе число способов расположения молекул больше, чем в разделенных индивидуальных веществах, вследствие появления возможности перестановок разнородных молекул, поэтому Аб’комб всегда положительна.
Вследствие взаимодействия компонентов раствора (водородные связи, донорно-акцепторное взаимодействие) раствор может оказаться более упорядоченным, чем исходные компоненты. Это приведет к уменьшению числа возможных перестановок и уменьшению энтропии. Доля общей энтропии смешения, обусловленная взаимодействием исходных компонентов, называется пекомбинаториалъной (5некомб). При образовании раствора она может убывать или возрастать, в соответствии с чем Д511еКомб может быть отрицательной или положительной.
В зависимости от знака Д5нек0мб и соотношения абсолютных величин Д5К0Мб и Д5мек0мб общая энтропия смешения также может быть положительной или отрицательной.
При растворении неполярных гибкоцепных полимеров в неполярных растворителях экспериментально определяемые энтропии смешения во много раз превышают вычисленные по уравнению (2.34), что наглядно иллюстрируют приведенные в табл. 2.6 данные для случая растворения натурального каучука в толуоле.
Таблица 2.6
Парциальные энтропии смешения каучука и толуола при 25 °C.
Молярная доля каучука в растворе лу 102 | TAS, Дж/моль. | |
расчетная. | экспериментальная. | |
0,146. | 0,36. | 20,9. |
0,341. | 0,84. | 154,9. |
0,795. | 1,96. | 745,2. |
1,360. | 3,36. | 1343,9. |
3,060. | 3,39. | 2876,3. |
6,430. | 15,87. | 3977,4. |
Причина этих расхождений связана с комбинаториальной составляющей энтропии смешения. В конденсированном состоянии макромолекулы не могут реализовать все возможные для них конформации, так как этому препятствуют соседние участки данной цепи или других макромолекул. При растворении участки цепей удаляются друг от друга и становятся легко реализуемыми все возможные конформации цепи, число возможных перестановок сегментов резко возрастает, что и приводит к существенному увеличению 5комб;
При растворении сильно полярных жесткоцепных полимеров в полярных растворителях вследствие сольватации последних подвижность их молекул в сольватных оболочках ограничивается, уменьшается число возможных перестановок, некомбинаториальная энтропия уменьшается, что может привести к уменьшению общей энтропии смешения, хотя растворение протекает самопроизвольно за счет энтальпийной составляющей свободной энергии.
- [1] Дифференциальная теплота растворения — это теплота q" которая выделяется или поглощается при добавлении бесконечно малого числа молей /-го компонента к раствору определенной концентрации, отнесенная к 1 моль этого компонента.