Общие химические свойства металлов

Следует отметить, что чем сильнее разбавлена азотная кислота и более активен металл, тем больше степень восстановления азота; характеризуя свойства металлов, нужно записать уравнения реакций с неметаллами (3—4 уравнения с разными неметаллами), с водой, с водными растворами солей и с кислотами (с соляной, разбавленной и концентрированной серной и азотной кислотами), а для металлов, способных… Читать ещё >
Общие химические свойства металлов (реферат, курсовая, диплом, контрольная)
1. Металлы взаимодействуют с неметаллами (галогенами, кислородом, халькогенами, азотом, фосфором, углеродом, кремнием).
Необходимо отметить, что железо и хром при реакции с галогенами проявляют 5 = III, с кислородом образуют смесь оксидов, валентность в которых равна II и III, при реакции с серой 5=11.
- 2. Щелочные металлы в реакциях с кислородом образуют пероксиды типа Na202 и К204.
- 2. Реагируют с водой:
- 2.1. Металлы I и II групп главных (А) подгрупп взаимодействуют с водой при обычных условиях, образуя щелочь и водород (кроме бериллия и магния):
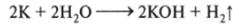
2. 2. Реагируют с водой при нагревании, образуя оксид и водород: 
- 2.3. Алюминий при обычных условиях с водой не реагирует, так как его поверхность покрыта плотной оксидной пленкой, но в присутствии ртути или щелочей реакция протекает с образованием гидроксида алюминия и водорода (напишите уравнение реакции).
- 2.4. Некоторые металлы (серебро, золото, платина и т. д.) не реагируют с водой.
- 2.5. Некоторые металлы (железо, медь и т. д.) корродируют в воде, если она содержит кислород и некоторые другие примеси.
- 3. Взаимодействуют с водными растворами солей (согласно ряду напряжений):
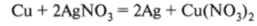
Следует отметить, что железо в этих реакциях проявляет 5=11 и щелочноземельные (кроме магния и бериллия) не вытесняют другие металлы из водных растворов солей, так как взаимодействуют с водой; реакция может протекать в несколько стадий. Если взять соль металла, которому соответствует амфотерный гидроксид, то реакция будет протекать в три стадии:

- (Уравняйте схемы всех процессов.)
- 4. Реагируют с кислотами (необходимо знать, как взаимодействуют металлы с соляной, серной и азотной кислотами — с разбавленными и концентрированными).
- 4.1. Соляная кислота любых концентраций является неокислительной, поэтому взаимодействует только с теми металлами, которые имеют электродный потенциал более отрицательный, чем у водорода; разбавленная соляная кислота не взаимодействует с оловом и свинцом, так как активность этих металлов очень мала, а на поверхности свинца образуется пленка малорастворимого хлорида свинца (П).
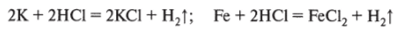
- 4.2. Серная кислота:
- 4.2.1. Разбавленная серная кислота является неокислительной, поэтому реагирует с металлами подобно НС1.
- 4.2.2. Концентрированная серная кислота является окислительной и реагирует с металлами по схемам:
- а) Алюминий, железо, титан, кобальт, никель, марганец, олово, хром не взаимодействуют с концентрированной серной кислотой, так как происходит их пассивация.
- б) Цинк, бериллий образуют с этой кислотой соль, воду, серу, сероводород и диоксид серы.
- в) При действии концентрированной серной кислоты на серебро, медь, ртуть получаются соль, диоксид серы и вода.
- г) С металлами I и II групп главных подгрупп концентрированная серная кислота образует соль, воду и сероводород.
- д) Свинец реагирует с этой кислотой только тогда, когда ее концентрация больше 75%, при этом получаются кислая соль, диоксид серы, вода.
- 4.3. Азотная кислота любых концентраций является окислительной:
- 4.3.1. Разбавленная азотная кислота реагирует с металлами по схемам:
a) HN03(pa36) + Тяжелые металлы (Си, Ag, Pb, Hg)-> Соль + Вода +.
+ Оксид азота (П);
б) НЫ03(разб) + Be, Zn, Al, Cr, Fe (Fe и Сг проявляют В = III)-? Соль +.
+ Вода + Оксид азота (1);
в) НЫ03(разб) + Металлы I и II групп главных подгрупп-? Нитрат аммония + Соль металла + Вода;
г) HN03(oh. разб) + Металлы I и II групп главных подгрупп, алюминий, хром, железо, олово, бериллий, цинк-> Нитрат аммония + Соль металла +.
+ Вода (Fe и Сг проявляют В = III).
- 4.3.2. Концентрированная азотная кислота реагирует с металлами по схемам:
- а) HN03(o4. конц) + Be, Zn-> Соль + Диоксид азота + Вода;
- б) Н1М03(конц) + Be, Zn-> Соль + Вода + Оксид азота (Н);
- в) HN03(kohu) + Тяжелые металлы-> Соль + Вода + Оксид азота (1);
- г) HN03(kohu) + Металлы I и II групп главных подгрупп-> Соль +
+ Вода + Оксид азота (1);
д) с алюминием, железом, кобальтом, никелем, марганцем, хромом, титаном концентрированная азотная кислота не реагирует (происходит пассивация).
Следует отметить, что чем сильнее разбавлена азотная кислота и более активен металл, тем больше степень восстановления азота; характеризуя свойства металлов, нужно записать уравнения реакций с неметаллами (3—4 уравнения с разными неметаллами), с водой, с водными растворами солей и с кислотами (с соляной, разбавленной и концентрированной серной и азотной кислотами), а для металлов, способных реагировать с водными растворами щелочей, и это уравнение.
5. Взаимодействуют с водными растворами щелочей (цинк, бериллий, алюминий, олово, свинец):
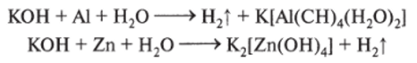
Уравняйте эти схемы.