Область жидкого состояния

Молекула на поверхности жидкости испытывает воздействие других молекул только с одной стороны. В этом случае равнодействующая сил не равна нулю и может быть разложена на два вектора. Один направлен вертикально — это сила внутреннего давления, составляющего величины порядка десятков тысяч килопаскалей. Второй вектор направлен горизонтально. Это сила поверхностного натяжения. Разность значений… Читать ещё >
Область жидкого состояния (реферат, курсовая, диплом, контрольная)
В температурной последовательности жидкое состояние промежуточно между твердым и газообразным. Повышение температуры кристалла и увеличение кинетической энергии частиц в узлах решетки приводит в конце концов к тому, что некоторые частицы переходят в междоузлия, а остальные начинают обмениваться местами. Таким образом, хотя более или менее правильное окружение каждой частицы сохраняется, кристалл теряет свою форму. Появляется новое состояние вещества, в котором ближний порядок вокруг каждой частицы еще сохраняется, но дальний уже существенно нарушен. При одной и той же температуре молярный объем жидкости на 5—10 % больше, чем для кристалла, что говорит об увеличении свободного объема в жидкости по сравнению с кристаллом. Жидкость не имеет собственной формы и под действием силы тяжести принимает форму того сосуда, в который она налита.
Если же исключить действие силы тяжести, то жидкость принимает форму сферы. Сфера представляет собой тело, имеющее наименьшую поверхность при заданном объеме. То, что жидкость стремится уменьшить свою поверхность, говорит об особых свойствах поверхностного слоя.
Действительно, рассмотрим силы, действующие на две молекулы — одну в объеме жидкости, другую-на поверхности (рис. 8.1). Внутри.
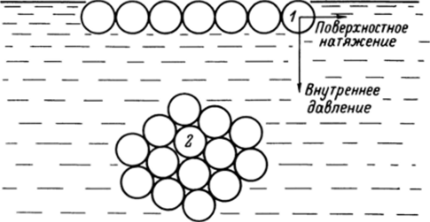
Рис. 8.1. Взаимодействие молекулы со своим окружением на поверхности жидкости (7) и в ее объеме (2) объема молекула взаимодействует со всеми окружающими ее молекулами, и поэтому равнодействующая этих сил равна нулю.
Молекула на поверхности жидкости испытывает воздействие других молекул только с одной стороны. В этом случае равнодействующая сил не равна нулю и может быть разложена на два вектора. Один направлен вертикально — это сила внутреннего давления, составляющего величины порядка десятков тысяч килопаскалей. Второй вектор направлен горизонтально. Это сила поверхностного натяжения. Разность значений поверхностного натяжения на границах жидкость — жидкость, жидкость — газ, жидкость — твердое тело определяет, будут ли две жидкости растворяться друг в друге или нет, если нет, то будет ли одна жидкость на поверхности другой растекаться (как бензин на поверхности воды) или собираться в каплю (как вода на поверхности ртути).
От поверхностного натяжения зависит возможность взаимного растворения двух жидкостей, от внутреннего давления — температурный интервал жидкого состояния вещества.
При повышении температуры жидкости и увеличении энергии системы некоторые из частиц, получившие достаточный запас кинетической энергии, способны преодолеть силы внутреннего давления, покинуть жидкость и перейти в газовую форму. Если система закрытая, то устанавливается равновесие между жидкой и газовой фазами, и среднее число частиц, покидающих жидкость и возвращающихся в нее, становится равным. Состояние вещества, находящегося в газовой фазе в равновесии с жидкостью, называется насыщенным паром.
При заданной температуре давление насыщенного пара есть величина постоянная. Если давление пара меньше этой величины, то пар называют ненасыщенным.
Система, содержащая жидкость и ее ненасыщенный пар, неравновесна: жидкость переходит в пар, стремясь повысить давление до равновесного. Если же резко охладить такую систему, то насыщенный пар может «не успеть» перейти в жидкость, и тогда давление пара оказывается больше, чем насыщенного. Такой пар называется пересыщенным. Система, содержащая пересыщенный пар, неустойчива, и из нее самопроизвольно должна конденсироваться жидкость. В природе равновесная конденсация водяного пара приводит к выпадению росы, а из пересыщенного пара образуется туман.
Рассмотрим еще раз диаграмму состояния воды (см. рже. 5.2). На рис. 8.2 давление приведено в логарифмической шкале, что позволяет изобразить в разумном масштабе полную диаграмму состояния. По сравнению с рис. 5.2 эта диаграмма дополнена областями существования различных полиморфных форм твердой воды, и, кроме того, на ней видно, что кривая, отвечающая равновесию жидкость — пар, кончается при Т «380 °С (650 К) и Р «104 кПа.
Точные координаты этой точки, которая называется критической точкой, Т = 647,4 К и Р = 22 114 кПа. В критической точке свойства жидкости и пара оказываются одинаковыми, и граница раздела фаз исчезает.
Рис. 8.2. Полная диаграмма состояния воды
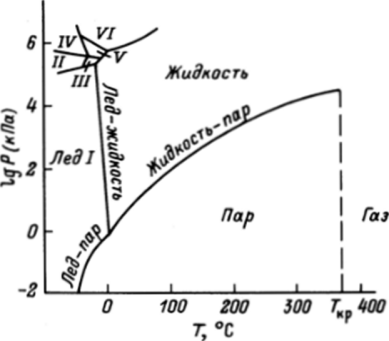
Выше критической температуры никаким давлением невозможно превратить пар в жидкость, и она условно делит область газообразного состояния вещества на две части: ниже Гкр это состояние называется пар, а выше Гкр — газ.
Таким образом, структура и свойства жидкости существенно зависят от температуры. При температурах, близких к температуре плавления, жидкость состоит как бы из «обломков» кристалла, которые непрерывно меняют свою форму, размеры, частицы переходят из одного «обломка» в другой — все течет, все изменяется, но в данный момент времени внутри «обломка» царит тот же полный порядок, что и в кристалле. Ничего, что в следующий момент зтот «обломок» исчезнет — возникнет другой, и в среднем структура жидкости будет сохраняться.
По мере повышения температуры и увеличения кинетической энергии частиц «обломки» становятся все меньше, структура жидкости становится все более хаотичной, и теперь уже свойства жидкости приближаются не к свойствам того твердого вещества, из которого она получена, а к свойствам того газа (или, правильнее, пара), который в свою очередь получится из этой жидкости. При критических условиях разница между жидкостью и паром исчезает, исчезает и граница раздела между ними.
Следовательно, в условиях повышающегося давления область жидкого состояния простирается от температуры плавления до критической температуры.
Если же внешнее давление постоянно, а давление насыщенного пара равно внешнему давлению, то объем системы будет возрастать до тех пор, пока жидкость полностью не перейдет в пар. В открытых системах таким процессом является кипение жидкости. Процесс кипения, т. е. неравновесного перехода жидкости в пар при давлении насыщенного пара, равном внешнему давлению, можно осуществить при любой температуре выше температуры тройной точки. Ниже этой температуры жидкость не существует, и твердое вещество переходит в пар, минуя жидкое состояние. Такой переход называется сублимацией (возгонкой). Например, давление в тройной точке диоксида углерода примерно в 5 раз больше, чем атмосферное. Поэтому под атмосферным давлением твердый С02 сублимируется при -78,5 °С. Под названием «сухой лед» он используется для получения низких температур.
Областью жидкого состояния обычно считают интервал температур от температуры плавления до нормальной температуры кипения. Нормальной температу рой кипения (слово «нормальной» часто опускают) называется температура, при которой давление насыщенного пара над жидкостью равно нормальному атмосферному давлению, т. е. 101 кПа.