Смещение химического равновесия

Для второй реакции Д#298 существенно больше, чем для первой, и константа меняется на 35 порядков, но при этом во всем интервале температур ее значение остается настолько малым, что реально обнаружить продукты реакции даже при 10U0 К практически невозможно. А при каких же температурах их можно обнаружить? Для ответа на этот вопрос по уравнению (14.4) найдем температуру, при которой К — 1. В данном… Читать ещё >
Смещение химического равновесия (реферат, курсовая, диплом, контрольная)
Истинное химическое равновесие может установиться только в закрытой системе. Если скорость реакции невелика, а это часто бывает в гетерогенных системах, равновесие иногда устанавливается за десятки, сотни и даже тысячи часов.
Напротив, в гомогенных газовых системах или в водных растворах большинство реакций протекает с очень большой скоростью и равновесие устанавливается практически мгновенно. Химическая система, пришедшая в состояние равновесия, будет находиться в нем до тех пор, пока условия, определяющие это состояние, сохраняются неизменными. Выйти иэ состояния равновесия самопроизвольно система не может. Если же изменить условия, то система перейдет в новое равновесное состояние.
Изменение состояния равновесия в результате изменения условий принято называть смещением химического равновесия.
Смещение химического равновесия лежит в основе варки стали и варки супа, им определяются карстовые явления и процессы, происходящие во время дыхания. При решении большинства технологических проблем важно знать, как будет смещаться равновесие при заданном изменении условий.
Во многих случаях нет необходимости в точных расчетах, достаточно выяснить направление смещения равновесия, т. е. определить, концентрации каких веществ будут увеличиваться, а каких — уменьшаться.
Чаще всего приходится сталкиваться со смещением равновесия в результате изменения: 1) концентрации (парциального давления) одного из реагирующих веществ; 2) общего давления и 3) температуры.
Иногда все три величины меняются одновременно, но для простоты рассмотрим случай изменения одной из них при постоянстве двух других на примере равновесия образования фосгена:

При температурах 300−400 °С скорость установления этого равновесия невелика и составляет сотни минут, тогда как изменить условия можно значительно быстрее. Будем считать, что условия меняются практически мгновенно, а затем система переходит к новому равновесному состоянию. Проанализируем, что при этом происходит. Дождемся установления равновесия и изменим концентрацию одного из веществ, например хлора. Запишем выражение константы:

Значение константы для заданного равновесия в соответствии с уравнением (14.3) определяется только температурой и не зависит от концентраций.
Увеличение концентрации хлора выведет систему из состояния равновесия и приведет к увеличению знаменателя в выражении константы. Значит, в системе должна пройти такая реакция (говорят: равновесие должно сместиться в такую сторону), чтобы числитель дроби в выражении константы увеличивался, а знаменатель — уменьшался. Для этого равновесие (14.5) должно сместиться вправо, в сторону понижения концентрации введенного вещества. При переходе к новому равновесному состоянию концентрации С12 и СО будут уменьшаться, а концентрация фосгена будет увеличиваться до тех пор, пока при некоторых новых значениях всех концентраций их отношение не будет вновь равно К. Точно так же, если каким-либо способом уменьшить концентрацию СО, то равновесие.
(14.5) будет смещаться влево, в сторону увеличения концентрации удаленного вещества до тех пор, пока не восстановится отношение концентраций равное К.
К аналогичным выводам можно прийти на основании кинетического подхода. Например, увеличение концентрации хлора приведет к возрастанию скорости прямой реакции, не повлияв при этом на скорость обратной. Значит, концентрация СОС12 будет возрастать до тех пор, пока скорости обеих реакций вновь не сравняются, а это произойдет тогда, когда константное отношение новых концентраций всех веществ будет равно величине К.
Дождемся установления равновесия и увеличим общее давление в системе, например, уменьшив в 2 раза объем. При этом концентрации всех веществ изменятся одинаково — увеличатся в 2 раза. К каким изменениям это приведет в выражении для константы равновесия? Очевидно, что числитель в этом выражении увеличится в 2 раза, тогда как знаменатель — в 4 раза. Дробь уменьшится. Состояние равновесия будет нарушено, и равновесие будет смещаться так, чтобы уменьшить концентрации веществ, входящие в знаменатель, что должно сопровождаться увеличением концентрации вещества, входящей в числитель.
При увеличении общего давления равновесие смещается в сторону меньшего числа молей газообразных веществ. Смещение будет происходить до тех пор, пока константное отношение новых концентраций не будет равно величине К.
Если реакция протекает без изменения числа молей газа, то изменение давления практически не влияет на состояние равновесия. Например, увеличение общего давления существенно увеличивает выход аммиака по реакции.
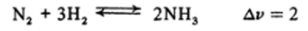
и не сказывается на выходе HI по реакции.
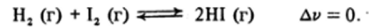
Обратимся теперь к смещению химического равновесия при изменении температуры. В этом случае меняется значение константы равновесия, и для определения направления смещения равновесия необходимо выяснить направление температурного изменения константы.
Зависимость константы равновесия от температуры выражается уравнением (14.3), из которого следует, что направление температурного изменения константы равновесия определяется только знаком ДН°. Если прямая реакция эндотермическая (АН° > 0), то первое слагаемое отрицательно. При увеличении температуры его абсолютное значение уменьшается и, независимо от знака Д5°, константа увеличивается.
Если, наоборот, прямая реакция идет с выделением энергии (АН < 0), то первое слагаемое будет положительным. С повышением температуры его абсолютное значение тоже будет уменьшаться, но теперь это приведет к уменьшению константы, независимо от знака AS°.
Увеличение константы означает, что числитель (концентрации продуктов реакции) увеличивается, а знаменатель (концентрации исходных веществ) — уменьшается.
Вернемся к равновесию образования фосгена (14.5), для которого Д#298 = - ПО кДж; ^^298 = —127 Дж/К. Для прямой реакции АН <0, и с ростом температуры константа будет уменьшаться, т. е. равновесие должно сместиться влево — концентрация фосгена должна уменьшиться, а исходных веществ — увеличиться. В данном случае смещение влево — это смещение в направлении эндотермической реакции.
Напомним еще раз: А//, AS, пК, AG° и AG — все эти характеристики для прямой и обратной реакций равны по абсолютным значениям и противоположны по знаку.
Значит, в любом химическом равновесии одна из реакций характеризуется значением АН° < 0, а обратная ей реакция — значением АН° > 0, и константа любого химического равновесия в направлении эндотермической реакции при увеличении температуры возрастает, а экзотермической реакции — уменьшается. При этом неважно, какая из реакций считается прямой, а какая — обратной. При повышении температуры химическое равновесие всегда смещается в направлении эндотермической, а при понижении температуры — в направлении экзотермической реакции.
Вот несколько примеров равновесных реакций:
AH° прямой реакции. | Направление смещения равновесия. | ||
при увеличении температуры. | при понижении температуры. | ||
 | <0. |  |  |
 | <0. |  |  |
 | >0. |  |  |
 | >0. |  |  |
Таким образом, зная знак АН°> можно точно сказать, в каком направлении будет изменяться константа равновесия при изменении температуры, но нельзя сказать, в каком интервале значений будет происходить изменение.
В качестве примера рассмотрим значения констант равновесия трех эндотермических реакций при трех температурах:
Д" 298. Дж. | 298″ Дж* К'1 | *300. | *500. | *1 000 | |
 | + 37 000 | + 72 | Ю‘а | 0.8 | 10а |
 | + 283 000 | + 85 | 10'4* | Ю-« | 10-'° |
 | + 106 000 | -58 | ю-а| | 10‘14 | 10-* |
Изменение энтальпии Al/^gs в первой реакции наименьшее из трех, и константа меняется относительно мало — всего на 4 порядка. Зато соотношение АИд% и д$ 298 таково, что изменение К происходит от достаточно низкого значения (10″а), при котором равновесие сильно смещено влево, до достаточно большого (10а), при котором равновесие практически полностью сдвинуто вправо.
Для второй реакции Д#298 существенно больше, чем для первой, и константа меняется на 35 порядков, но при этом во всем интервале температур ее значение остается настолько малым, что реально обнаружить продукты реакции даже при 10U0 К практически невозможно. А при каких же температурах их можно обнаружить? Для ответа на этот вопрос по уравнению (14.4) найдем температуру, при которой К — 1. В данном случае Т (ДG° =0) = 283 000/85 = 3 000 К. Только выше этой температуры, А > 1 и концентрации продуктов реакции разложения СОа станут больше, чем концентрация исходного вещества.
Для первой реакции К = 1 при Г = 37 000/72 = 514 К.
А вот для третьей реакции такая температура не существует и К никогда не может быть равна единице. Действительно, в этом случае ДН° и ДS° имеют разные знаки и деление Д#° на Д5° приводит к абсурду — отрицательной абсолютной температуре. Таким образом, хотя и в этом случае константа растет по мере увеличения температуры, но К всегда будет много меньше 1 и пероксид водорода по такой реакции ни при каких условиях не может быть получен в измеримых количествах.
Влияние изменения условий на состояние равновесия может быть выражено одним общим термодинамическим положением, известным под названием принципа Ле Шателье:
Если на равновесную систему оказать воздействие, изменив условия, равновесие в системе сместится так, чтобы уменьшить эффект оказываемого воздействия.
Основные закономерности смещения равновесия, разобранные выше, вполне согласуются с этим принципом и могут быть легко предсказаны на его основе. Так, на увеличение концентрации одного из веществ система должна реагировать смещением равновесия в сторону уменьшения концентрации введенного вещества. Увеличение общего давления должно вызывать смешение равновесия в направлении уменьшения объема, а понижение температуры — в направлении экзотермической реакции, т. е. реакции, идущей с выделением теплоты и тем самым препятствующей понижению температуры.
В заключение рассмотрим два частных, но важных в практическом отношении случая. Во-первых, смещение равновесия, когда в нем участвует единственное газообразное вещество, а все остальные вещества находятся в твердых фазах. Во-вторых, когда в равновесии участвует единственная твердая фаза, а все остальные вещества газообразны.
Классическим примером равновесия первого типа служит разложение карбоната кальция:

Реакция эндотермична, и поэтому с повышением температуры равновесие смещается вправо. В равновесии участвует только одно газообразное вещество — С02, и К = Pqq, так как парциальные давления чистых твердых фаз в выражение константы не входят.
Если карбонат нагревается в закрытой системе, то с повышением температуры давление С02 будет увеличиваться до тех пор, пока выдерживают стенки сосуда. Если же разложение происходит в открытой системе, то при Т = Д//298/A*S298 = 1 090 К = 820 °C К = Pqo2 = 1, давление С02 становится равным атмосферному — 101 кПа. Дальнейшее повышение температуры системы оказывается невозможным, так как при этом равновесное давление С02 должно стать больше, чем 101 кПа, и С02 быстро покидает открытую систему, уходя в атмосферу. Равновесие «пытается» сдвинуться вправо, но С02 уходит из системы, и вся подводимая теплота тратится на разложение карбоната. Новое состояние равновесия установиться не может, и поэтому процесс идет до конца, до принципиально полного исчезновения фазы СаС03. Состояние такой системы полностью аналогично состоянию кипящего чайника — вся подводимая теплота идет на испарение воды, и так продолжается до тех пор, пока вода не выкипит.
Подобным образом разлагаются многие оксиды металлов, солеобразные гидриды и другие твердые вещества.
Примером равновесия второго типа может служить образование оксида углерода по реакции:

При нагревании углерода в атмосфере С02 с ростом температуры равновесие смещается вправо (АН° > 0) и при «s 1 000 К К = 1. В результате реакции часть твердого углерода переходит в газовую фазу. Если теперь понижать температуру, то равновесие будет смещаться влево — в направлении экзотермического разложения СО. При этом часть углерода должна выделиться из газовой фазы (см. разд. 24.4). Как говорят, углерод транспортируется через газовую фазу. Подобные реакции называются транспортными реакциями.
Смещение рассмотренного равновесия является одной из основных причин образования сажи в дымоходах печей.
В настоящее время транспортные реакции широко используются в технике для выращивания кристаллов нелетучих и неплавких веществ, для получения металлических порошков, различных пленочных покрытий.
Вы, вероятно, обратили внимание на то, что в этой главе в качестве примеров равновесных систем рассматривались лишь равновесия, устанавливающиеся в гомогенных или гетерогенных системах с непременным участием газов и при повышенных температурах. Равновесия же в растворах почти не упоминались. Это связано с тем, что равновесия в растворах (особенно водных) устанавливаются, как правило, при постоянной — комнатной — температуре. В растворах растворитель вообще и вода, в частности, — не просто среда, в которой протекают те или иные реакции и устанавливаются какие-то равновесия, а чаще всего они сами являются активным участником этих реакций и равновесий. Именно поэтому равновесия в водных растворах рассмотрены отдельно.