Физические свойства.
Органическая химия в 2 ч. Часть 2

Фенол плохо растворяется в холодной (структу рированной) воде и хорошо в кипящей (мало структурированной) воде. С ростом числа гидроксильных групп растворимость фенолов возрастает. Гидроксильная группа обладает сильным физиологическим действием. Особенно ядовиты одноатомные спирты и фонолы. Сброс фенолов в природные водоемы приносит непоправимый ущерб всей живой природе. Наличие ОН-группы… Читать ещё >
Физические свойства. Органическая химия в 2 ч. Часть 2 (реферат, курсовая, диплом, контрольная)
Физическое состояние низших спиртов, в которых соотношение масс ОН-группы и алкила не подавляется последним, всецело определяется их структурированием (ассоциацией) вследствие образования водородной связи:
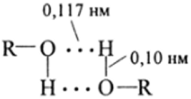
Водородная связь в Н20, спиртах, карбоновых кислотах по энергии (20—30 кДж/моль) приближается к слабому ковалентному взаимодействию и может считаться химической связью. Это означает, что кроме дипольдипольного взаимодействия, которое носит электростатический характер, возникает слабое ковалентное взаимодействие 25-орбитали атома водорода с 2уили 2/э-электронной парой атома кислорода. Длина водородной связи составляет 0,17 нм, тогда как длина Н-О-связи в спиртах составляет 0,10 нм, т. е. имеется полная корреляция длины и энергии.
Ассоциация спиртов резко повышает их плотность, температуры кипения и плавления, поэтому все спирты — жидкости с /кип = 65 °C (метанол), 78 °C (этанол), 97 °C (//-пропанол), 117 °C (//-бутанол), у фенолов температуры кипения и плавления еще выше. Так, фенол имеет /11Я = 41 °C и /кип = 182 °C, что отвечает более высокой прочности водородной связи (40 кДж/моль), чем в спиртах.
Структурирование спиртов и фенолов зависит от числа гидроксильных групп и места их расположения. Так, 1,2-диоксибензол (пирокатехин) имеет = 105 °C и /вип = 245 °C. Значение этих констант фазового перехода у[1]
1,3-диоксибензола (резорцина) и 1,4-диоксибензола (гидрохинона) составляет 110 и 280,8 °С, 172,3 и 286 °C соответственно. Из этих данных следует, что фазовое состояние фенолов зависит от надмолекулярной структуры ассоциатов, которая в свою очередь определяется молекулярной структурой фенола. Из приведенных цифр видно, что силы межмолекулярного взаимодействия, включая Н-связь, максимальны у гидрохинона и определяются главным образом водородной связью. Это следует из очень высоких температур плавления и кипения этиленгликоля (-13 и 197 °С) и глицерина (18,6 и 290 °С), также имеющих по нескольку ОН-групп. Гидроксильная группа изменяет растворимость углеводородов. Спирты с одной или несколькими гидроксильными группами при небольшом углеводородном остатке имеют высокое химическое и структурное сродство к воде и смешиваются с ней во всех отношениях. Рост длины алкила постепенно ослабляет растворимость, которая исчезает совсем у С2о и более, так как в свойствах начинает преобладать влияние углеводородного остатка.
Фенол плохо растворяется в холодной (структу рированной) воде и хорошо в кипящей (мало структурированной) воде. С ростом числа гидроксильных групп растворимость фенолов возрастает. Гидроксильная группа обладает сильным физиологическим действием. Особенно ядовиты одноатомные спирты и фонолы. Сброс фенолов в природные водоемы приносит непоправимый ущерб всей живой природе.
Наличие ОН-группы в спиртах определяется в ИК-спекграх, но интенсивной полосе валентных колебаний в области 3200—3700 см" 1. Частота колебаний Н-О понижается с ростом прочности Н-связи до 3200 см" 1. В ПМРспектре ОН-группе отвечает пик 2—5 м.д. для спиртов и 4,5—7,0 м.д. для фенолов. Положение пика зависит от природы растворителя и концентрации спирта или фенола.
- [1] Данные по /кип и /Л1 округлены.