Электролитическая диссоциация.
Химия в строительстве

К ним относят большинство солей, гидроксиды кальция, стронция, бария, радия и металлов первой группы главной подгруппы (щелочи), бромоводородная, соляная (хлороводородная), хлорная, азотная, серная, хромовая и др. Процесс распада частиц растворенного вещества (молекул, ионных кристаллов) на ионы под действием полярных молекул растворителя называется электролитической диссоциацией. Некоторые… Читать ещё >
Электролитическая диссоциация. Химия в строительстве (реферат, курсовая, диплом, контрольная)
Водные растворы ряда веществ проводят электрический ток, что связано с их электролитической диссоциацией.
Процесс распада частиц растворенного вещества (молекул, ионных кристаллов) на ионы под действием полярных молекул растворителя называется электролитической диссоциацией.
Принципиальное отличие слабого электролита от сильного состоит в том, что в растворах сильных электролитов нет молекул растворенного вещества.
Слабыми называют электролиты, для которых, а < 3% в 0,1 М растворах (а-стспснь электролитической диссоциации).
Такими электролитами являются вода; гидроксид аммония, амфотерные и нерастворимые гидроксиды металлических элементов; азотистая, угольная, кремниевая, сероводородная, хлорноватая, фтороводородная (плавиковая), синильная, одноосновные карбоновые органические кислоты и др.
Сильными называют электролиты, для которых, а > 30% в 0,1 М растворах.
К ним относят большинство солей, гидроксиды кальция, стронция, бария, радия и металлов первой группы главной подгруппы (щелочи), бромоводородная, соляная (хлороводородная), хлорная, азотная, серная, хромовая и др.
Особенности электролитической диссоциации вещества определяют их химические свойства. Известно, что оксиды не диссоциируют, и это необходимо учитывать при характеристике химических реакций, протекающих в водных растворах.
Если вещество при диссоциации образует катион гидроксония [Н30]+ и анион кислотного остатка, то такое вещество является кислотой. Катион гидроксония получается в результате реакции Н+ + Н20 = [Н30]+, но в уравнениях, характеризующих процесс в ионном виде, этот процесс для упрощения не используют и вместо формулы [НэО]+ применяют Н+: 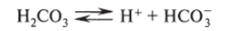
Если при диссоциации гидроксида образуются ионы ОН, то этот гидроксид является основанием:
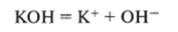
Некоторые гидроксиды диссоциируют, одновременно образуя ионы водорода и гидроксида, поэтому они являются амфотерными гидроксидами (гидроксид цинка, алюминия и др.).
При диссоциации солей образуются анионы кислотного остатка и катионы металла или другие ионы (NHJ и др.):
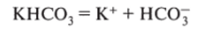
На основании теории электролитической диссоциации записывают уравнения реакций в трех формах: условно-молекулярной, полной и краткой ионной формах; для некоторых реакций полная и краткая ионные формы совпадают. Рассмотрим примеры написания таких уравнений в трех формах.
Пример 1. СаС12 + К2С03 = CaC03j + 2КС1 (уравнение в условномолекулярной форме);
Са2+ + 2С1~ + 2К+ + СО^- = СаС031 + 2К+ + 2С1~ (полное ионное уравнение);
Са2+ + СО^" = СаС031 (краткое ионное уравнение).
Пример 2. Ва (НС03)2 = BaC03j + Н20 + C02f; Ва2+ + 2HCOJ = = ВаС03| + Н20 + С02| (полное и краткое ионные уравнения совпадают).
Электролитическая диссоциация веществ имеет большое значение в строительстве. Так, диссоциация гидроксида кальция в поровой жидкости бетона делает возможным процесс его твердения (позитивная роль). В то же время она способствует протеканию электрохимической коррозии строительных металлоконструкций (негативная роль).
Задания для самостоятельной работы.
- 1. Поясните, чем слабые электролиты принципиально отличаются от сильных электролитов.
- 2. Напишите уравнения в трех формах, протекающих между: а) силикатом натрия и хлоридом бария; б) гидрокарбонатом кальция и соляной кислотой; в) дигидрофосфатом кальция и гидроксидом кальция (гидроксид кальция взят в избытке).
- 3. Приведите два обоснованных примера, иллюстрирующих роль электролитической диссоциации в строительной индустрии.