Реакции кислотной ионизации и протонирования

Водородный показатель выражается через концентрацию ионов водорода сн. и равен pH = -lgс. Если учесть, что концентрация в крепких водных растворах, а тем более неводных растворах сильных кислот отличается от действующей концентрации (активности), то следует вместо с. ввести активность а. Теория сильных электролитов, подробно изложенная в курсах физической, аналитической и неорганической химии… Читать ещё >
Реакции кислотной ионизации и протонирования (реферат, курсовая, диплом, контрольная)
При многочисленных точках зрения на сущность кислот и оснований, а также на само кислотно-основное взаимодействие не просто излагать данную тему. Сущность этих понятий развивалась от кажущихся в настоящее время наивными представлениями прошлого (теория Аррениуса) до разумного понимания Бренстеда в начале XX столетия и прошла через необоснованное расширение понятий «кислота и основание» у Льюиса и Усановича и остановилась на концепции «мягких» и «жестких» кислот и оснований Пирсона. Большинство этих теорий, исключая Бренстеда, базируется на общности ряда признаков координационных, а протонных и протонных соединений. Укоренилось заблуждение в том, что кислоты и основания подразделяются на бренстедовские и льюисовские, «мягкие» и «жесткие». В природе существуют только слабые и сильные окислители и восстановители, слабые и сильные кислоты и основания, хорошие и плохие лиганды и комплексообразователи, хорошие и плохие растворители и осадители.
Классическая кислота (НС1, H2S04) является кислотой потому, что она содержит и может передавать протон растворителю, содержащемуся в слюне. В результате возникает ощущение кислого вкуса. Но кроме этого первичного признака у классической кислоты есть еще ряд более важных признаков, которые позволяют причислить 134.
к кислотам многие молекулы, имеющие слабо подвижный протон и не имеющие поэтому кислого вкуса. Тем не менее они могут в определенных условиях выделять водород при действии активного металла, отдавать в раствор протоны в обмен на ион металла, образуя при этом соли. Из этих простых примеров вполне очевидно, что такое «кислота». Носитель подвижного протона, элементарной частицы материи, — вот что такое кислота.
Зачем же понадобилось вводить в это ясное понятие еще «кислоты» Усановича, Льюиса, Пирсона? По Усановичу. любое вещество, отдающее катион, — это кислота. Но как справедливо заметил Ю. Я. Фналков, если вещество отдает катион, то стало быть оно отдает и анион, так как соль иных частиц не содержит. Таким образом, определение кислоты по Усановичу теряет смысл. Таким образом, подтверждается правило, которое гласит, что безграничное расширение какого-либо понятия уничтожает его, превращая в бессмыслицу.
Аналогично происходит и с кислотами Льюиса. Почему ZnCl2, А1С13, BF3 — кислоты Льюиса? Эти частицы являются сильными комплексообразователями, так как координационно ненасыщены и имеют низкие по энергии вакантные орбитали. Они прочно связывают многие лиганды. Это их свойство напоминает протон, у которого тоже есть вакантная орбиталь, присоединяющая электронную пару лиганда. Значит, эти частицы напоминают протон, т. е. являются координационными центрами (комплексообразователями), а вовсе не хислотами. И с кислотами имеют сходство лишь в том, что в их составе есть анионы, которые они могут в известных условиях отдавать. Бытовая терминология «мягких» и «жестких» кислот Пирсона основана скорее всего на недостоточно точном переводе тех понятий, которые Пирсон вводил для легко и трудно поляризующихся частиц комплексных соединений. Ни льюисовские, ни пирсоновские частицы чаще всего не имеют сами по себе никакого отношения к строго ограниченному по физическому смыслу классу кислот, а являются комплексообразователями.
Рассмотрим теперь основания. По Аррениусу, если вещество по своей химической природе имеет сходство со щелочью, то его можно причислить к основаниям. Na’OH имеет слабо связанный подвижный гидроксид-ион и поэтому является щелочью (сильным основанием). Си (ОН)2 имеет прочно связанный неподвижный гидроксид-ион и поэтому так же, как и NaOH, причислена к основаниям, но слабым. По Аррениусу, основанием является вещество, способное передать гидроксид-ион кислоте и образовывать при этом воду:

Бренстед назвал кислотами все частицы, имеющие в своем составе протон и способные передавать его основанию. Основание, как понятие, противоположное кислоте, по мнению Бренстеда, является частицей, способной присоединять протон. Кислота — донор протона, основание — его акцептор. В передаче протона заключена физическая сущность кислотно-основного взаимодействия:
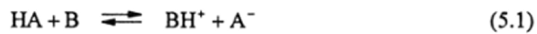
Из этого заключения Бренстеда ясно, что кислота НА, отдав протон, превращается в основание, а основание В, присоединив протон, превращается в кислоту. В этом состоит закон неуничтожаемости химического свойства (так же, как материи и энергии). Этот закон является следствием законов неуничтожаемое™ материи и энергии. Свойство — это проявление действия поля (энергии) на материю, которая является носителем поля (энергии). Свойства также превращаются друг в друга, как материя и энергия, однако характер этих превращений еще мало изучен.
Прежде чем рассмотреть термодинамичсские особенности уравнения (5.1), следует кратко рассмотреть свойства органических кислот (НА) и оснований (В), их ионизированных форм (А" и ВЕГ);
Среди органических кислот можно выделить четыре группы, отличающихся друг от друга атомом-носителем протона и связанной с ним группировкой.
Карбоновые кислоты R—Носителем протона является кар;
боксилат-ион. Гидроксид-ион связан с электроотрицательным карбонилом. Однако в результате сопряжения атома кислородаОН с я-орбиталью С=0 электроотрицательность его повышается и карбоновые кислоты являются уже электролитами, хотя и слабыми. Их константы диссоциации, если R — алкил или арил, составляют в водном растворе интервал Ка = 10-4 -s-10‘5. Если в состав R или Аг входят сильно электроноакцепторные заместители (F, Cl, СООН, С=0 и др.), то кислотность в результате действия электронного a-эффекта этих заместителей возрастает до Ка =10"*. Если в качестве R выступаетCF3, то кислота становится сильным электролитом. В водном растворе CF3COOH является сильной кислотой. Приближается к ней по силе также CCI3COOH.
Сульфоновые, фосфоновые и им подобные кислоты. Носителем протона здесь также является кислородный атом, входящий в состав окружения максимально окисленных атомов S, Р, Se, As, Те, Sb и т. д.
Сильными кислотами являются серная и селеновая, средней силы — фосфорная и мышьяковая, слабыми — теллуровая и сурьмяная. Их органические производные R-S020H (Ar-S020H), R-PO (OH)2, R-Se020H, R-AsO (OH)2 также являются сильными (две первые) или средней силы кислотами. Атом серы двухкратно ионизирован и является сильнейшим электронным акцептором. Этому способствует вакантная низколежащая 3d- орбиталь. Поэтому R-SOzOH в водном растворе являются сильными кислотами и диссоциируют нацело. Аналогичная ситуация у селена. Атом фосфора расширяет валентность за счет промотирования (возбуждения) 3 $2-электрона на З^-орбитали, а не за счет ионизации. Поэтому его акцепторные свойства в максимально окисленном состоянии намного меньше, чем у атома S и фосфоновые кислоты не являются сильными (Ка «КГ3 в водном растворе).
Органические N-H-кислоты. Первые две группы кислот, так же как и спирты R-OH, фенолы Аг-ОН, оксимы R=N-OH, являются ОН-кислотами, у которых отрыв протона связан с гидроксильной группой. В третьей группе кислот отрыв протона происходит от N-H-группировки. Как известно, NH3 и амины R-NH2 (Aj-NH2) не обладают кислотными свойствами, так как протон локализован при атоме азота с помощью сравнительно малополярной ковалентной связи (pN_H = 4,33-Ю" 30 Кл-м). Чтобы проявлялась заметная ионная диссоциация.
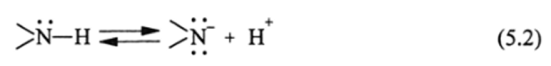
необходимо наличие при атоме азота одного или двух сильных электронных акцепторов, таких какN=0, —(р=0, двухС6Н5 и других атомных группировок, содержащих я-связь. Поэтому нитрозамины С6Н5~-N—Н, ами;
N0.
? ?
ды карбоновых кислот R—С—NH2 (Аг—С—NH2), фенилгидроксиамин НС = СН.
C6H5-NH — ОН, дифениламин C6H5-NH-C6H5, пиррол I N—Н, нс=сн/
аСН.
^ / N—Н, порфирины и фталоцианины являются слабыми кислотами с константами кислотной диссоциации от 5−10-26 до 2*10-11.
СН-кислоты. Эта группа кислот имеет чисто органическую природу, тогда как все остальные группы имеют в большей степени неорганическое происхождение, являясь остатками неорганических кислот, входящими в контакт с углеводородным фрагментом. Среди СН-кислот следует назвать синильную кислоту (нитрил муравьиной кислоты) H-C=N и его моноал;
СН=СН килпроизводные, ацетилен СН = СН, цикл о пентадиен I СН,.
СН—ClK 2
трифенилметан (С6Н5)3СН, малоновый эфир СН2(СООС2Н5)2 и др.
Как известно, алканы, алкены, сопряженные диены и ароматические углеводороды не являются кислотами, так как их способность к протонизации связи СН4 CHj + Н+ ничтожно мала. Константа диссоциации метана оценивается величиной ЛГа = 10-40. Они не обладают также способностью протежироваться кислотами, т. е. не являются основаниями. Поэтому пере- «численные углеводороды относятся к нейтральным соединениям. Это вовсе не означает, что в сверхжестких условиях у них нельзя вызвать кислотные или оенбвные свойства. Кислотами можно считать частицы с константой кислотной диссоциации не ниже КГ25, для которых можно получать стабильный анион в водном или другом растворе. СН3 нельзя считать анионом кислоты, так как в растворах он может существовать как короткоживущий интермедиат некоторых химических реакций. В то же время (С6Н5)3С» устойчив в растворах и его можно уже считать анионом кислоты. Принципиальным отличием СН-кислот, исключая HC=N, является то, что они не образуют высоких концентраций анионов при действии щелочей, даже в их концентрированных растворах. Это связано с тем, что анионы образуются из ион-молекулярных ассоциатов, например:
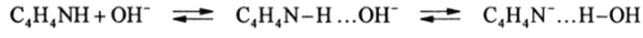
где C4H4N-H …ОН- — ассоциат гидроксид-иона с пирролом, который с трудом переходит в другой ион-молекулярный ассоциат пирролил-аниона с Н20, концентрация которого мала даже в 1 ОМ растворах щелочей. Для пиррола в водном растворе:
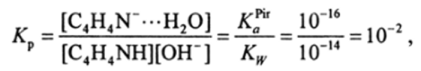
где К*1 — константа кислотной диссоциации пиррола; Kw — ионное произведение воды. Константа равновесия Кр имеет малое значение. Для 0,1 М раствора пиррола в 1 М растворе КОН получим значение равновесной концентрации u u л = ИГ4 моль/л, т. е. диссоциирует всего лишь 0,1% пиррола.
C4H4N 'HjO.
Из СН-кислот наиболее изучена термодинамика диссоциации синильной кислоты. Эта наиболее сильная из СН-кислот имеет ЛГв = 5 -10-10, т. е. по кислотным свойствам соответствует фенолу (Ка = КГ10) и на 6—8 порядков превышает спирты.
Органические основания по своей природе так же многообразны, как и органические кислоты. Фактически все классы соединений за исключением углеводородов, их галогенопроизводных, тиоспиртов и тиоэфиров, нитро-, нитрозои диазосоединений обладают ясно выраженными основными свойствами. При этом по способности к протонированию (реакция 5.1) они располагаются в ряд: амины неароматические > амины ароматические > спирты > > фенолы > простые эфиры > кетоны > альдегиды > азосоединения > сложные эфиры > амиды карбоновых кислот > карбоновые кислоты. Среди этих соединений выделяются неароматические амины, которые в водном растворе 138.
протежируются как сильными, так и слабыми (СН3СООН) кислотами:

Ароматические амины (пиридин, анилин и т. д.) протонируются карбоновыми кислотами через стадию образования Н-ассоциата, т. е. молекулярного ассоциата с водородной связью:
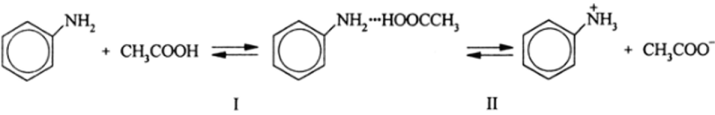
При этом стадия I проходит с высокой константой равновесия, тогда как стадия II с низкой константой равновесия. Концентрация анилиний-иона.
C6H5NH3 сильно зависит от избытка уксусной кислоты. Аналогично ведут себя в реакции (5.1) все основания, стоящие в ряду основности после ароматических аминов. Их протонирование до ВН+ происходит только в моногидрате H2S04, хлорной кислоте, CF3COOH и сверхкислотах, таких как HBF4, FS020H, HSbF6, H4[Fe (CN)6] и др.
Другие кислоты, в том числе сильные (НС1, HBr, HI), протонируют эти основания преимущественно до Н-ассоциата:

Особое место среди органических оснований занимают молекулы, содержащие гидроксид-ион. К их числу относятся все гидроксиды тетраалкиламмония и триалкилсульфония [SR3]+OH~. Они являются сильными электролитами и удобно заменяют в сфере реакции неорганические щелочи в тех случаях, когда присутствие катионов металлов нежелательно и нужна более высокая растворимость щелочи в органических растворителях.
При изучении закономерностей кислотно-основного взаимодействия (5.1) главными вопросами являются такие, как влияние атомно-электронной природы кислоты и основания на глубину протекания реакции или на константу равновесия Кр, на зависимость Кр от температуры и других воздействий и зависимость реакции (5.1) от природы растворителя. Последнее особенно важно знать в связи с тем, что большинство реакций с участием органических соединений протекает в растворах и чаще всего сложных, многокомпонентных. Поэтому предсказательная сила термодинамической теории в реакциях (5.1) будет определяться полнотой изучения структурных и сольватационных проблем.
Кислотно-основное взаимодействие, записанное в общем виде (5.1), удобно расчленить на ряд отдельных стадий зависимости от природы частиц НА и В.
1. Если в качестве основания В выступает растворитель (В = S), то процесс (5.1) будет представлять собой кислотную диссоциацию НА. Константа равновесия процесса кислотно-основного взаимодействия.
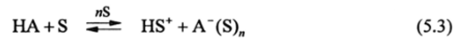
будет определяться силой кислоты в Н2О и свойствами растворителя S такими, как полярность и поляризуемость, диэлектрическая проницаемость е, электронодонорная способность (основность), наличие в составе молекулы подвижных протонов и др.
Поскольку в реакции диссоциации (5.3) образуются заряженные частицы, то для их разделения (диссоциации) и стабилизации желательно, чтобы растворитель обладал высоким значением 8. Поэтому, как правило, рост 8 растворителя приводит к увеличению силы кислоты, т. е к росту константы кислотной диссоциации.

за счет ослабления ион-ионного взаимодействия и сдвига равновесия (5.3) вправо. Этому сдвигу будет способствовать рост основности молекул S, измеряемый в газовой фазе протонным сродством (РА) (от англ, proton affinity):
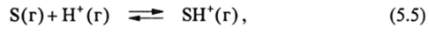
а в растворах энтальпией взаимодействия ЛЯ молекул S с акцепторами электронной пары (например, SbCl5 в случае так называемых донорных чисел Гутмана, обозначаемых DNSbClj):
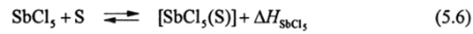
В табл. 5.1 приведены значения протонного сродства, донорных чисел и константы автопротолиза (НХ + НХ Н2Х+ + X').
Таким образом, протонное сродство в газовой фазе, или донорные числа в растворе, определяют силу взаимодействия протона с растворителем. Чем больше их значение, тем кислота должна быть сильнее, если 8 и химическое сродство к анионам остаются постоянными при переходе от растворителя Sj к S2. У анионов сродство к растворителю осуществляется: а) за счет энергии ион-дипольного взаимодействия, которая определяется выражением:

где z — заряд аниона; р — электрический момент диполя; г — расстояние от аниона до центра диполя; аугол, образуемый диполем относительно линии г;
Таблица 5.1. Физико-химические характеристики некоторых растворителей
Растворитель S | Протонное сродство РА | Донор ные числа DNs*, | Акцепторные числа AN | Диэлектрическая проницаемость ? | 'пл.°С | Лит" °С | Кон станта авто- прото- лиза logic. |
" -СбН|2 | — | — | 6,5 | 80,7 | — | ||
СС14 | — | 8,6. | — | -23 | 76,5 | — | |
C1CH2CH2CI | — | 14,7 | — | -35 | 83,5 | — | |
c6H6 | 0,1. | 8,2. | 2,28 | 5,5 | 80,1 | — | |
CH3CN | 14,1 | 18,9 | 37,5 | -45,7 | 81,6 | ^ 33,3 | |
СКСНгСНг^О | — | 14,8 | 10,8. | 2,21. | 11,8. | — | |
СН3СОСН3. | 17,0 | 12,6. | 20,70 | -95,4 | 56,2 | 32,5 | |
СН3СООС2Н5 | — | 17,1 | — | 6,02. | -83,6 | 77,1 | 22,83 |
Н20 |
| 54,8 | 78,39 | 14,00 | |||
(С2Н,)20 | — | 19,2 | 3,9 | 4,34 | -116 | 34,5 | — |
ТГФ | — | 20,0. | 8,0. | 7,58 | -65 | — | |
ДМФА | 26,6 | 16,0 | 37,0 | -61 | 29,4 | ||
ДМСО | — | 29,8 | 19,3 | 46,68 | 18,4 | 189(р) | 33,3 |
С2Н5ОН | 31,5 | 37,1 | 24,55 | -114,5 | 78,3 | 18,88 | |
Пиридин | — | 33,1 | 14,2 | 12,4 | -41,8 | 115,6 | — |
NH3 |
| 59,0 | — | — | -77,7 | -33,4 | 32,5 |
СН3СООН. | — | 52,9 | 6,15 | 16,6 | 14,45 |
воде. Зависимость Ка от природы растворителя несколько иная у кислот.
различного заряда, например у RCOOH, RP02(0H) и RNH3, т. е. оно зависит от типа кислотного центра. Так, например, замена Н20 на этанол уменьшает Ка пикриновой кислоты C6H2(N02)30H не в 106 раз, как у RCOOH, а только в 1500 раз. Это связано с тем, что отрицательный заряд пикратаниона рассредоточен с атома кислорода на орто- и яяря-положения бензольного ядра:
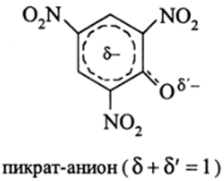
Рассредоточение заряда резко снижает энергию сольватации (повышает энтальпию сольватации ДHmW) как в Н20, так и в ROH. Поэтому различие Ка в Н20 и ROH понижается для всех сложных кислот, анионный заряд которых может быть делокализован за счет wi-сопряжения по всей частице.
Влияние сольватации основными растворителями протонированных оснований ВН*, выступающих в ряду катионных кислот, сказывается очень.
? +? ?
своеобразно. Так, в ряду NH4 > RNH3 > R2NH2 > R3NH сила кислот, т. е. значение Ка, убывает, если речь идет о газовой фазе или инертных растворителях (углеводородах), тогда как в водном растворе из-за убыли сольвата;
Н-.-ОН2 R.
+ 1 +1.
ции N-H-связей по типу R—N—Н* • *ОН2, R—м—Н* • -ОН2 самой слабой Н-.-ОН, ^.
кислотой является не R3NH, как следовало бы ожидать из +/-эффекта ал- ?
кильных групп, a R2NH2. Это результат противоположного действия электронного /-эффекта и сольватации.
Понятие донорных и акцепторных чисел применимо не только к растворителям, но и к любым частицам. Донорное число воды точно не определено, поскольку Н20 вступает с SbCl5 не только в донорно-акцепторное, но и в обменное взаимодействие — реакции замещения СГ и гидролиза по связи Sb-Cl. Поэтому по разным источникам для воды значения DNSbClj изменяются от 18 до 33. Важным в химии неводных растворов, в которых чаще всего протекают химические органические реакции, является понятие акцепторного числа. Акцепторное число AN отражает способность растворителя (или другой частицы) притягивать электронную пару на свои вакантные орбитали. Оно определяется на опыте как химический сдвиг 31Р продукта взаимодействия растворителя S с триэтилфосфиноксидом 0=Р (С2Н5)3 в среде инертного растворителя (w-гексан, 1,2-дихлорэтан). Существуют и другие методы определения DN и AN растворителей. Акцепторные числа позволяют оценить протонную донорность органического протонсодержащего растворителя, а для апротонного растворителя — поляризацию л-электронной пары и диполь-дипольные силы.
DN и AN позволяют решить многие химические проблемы в растворах на качественном уровне. Учитывая то, что химия еще остается больше качественной, чем количественной наукой, широко используют DN и AN для различных корреляций со свойствами органических соединений, химических реакций и физико-химических процессов.
- 2. В качестве основания В может выступать не только растворитель, но и любое нейтральное основание, сильное или слабое. Сильные основания В взаимодействуют легко, быстро, с высокой константой равновесия реакции (5.4) и сильно отрицательной энтальпией. Поскольку в реакции (5.4) из двух незаряженных частиц образуется два носителя заряда, способные к сильному ион-дипольному взаимодействию (5.7) с растворителем, как правило, общее число частиц сильно уменьшается, что приводит к отрицательной энтропии (-AS) для таких реакций.
- 3. В качестве основания выступает анион В". Тогда в результате взаимодействия

происходит протонный обмен между двумя анионами. Изменение энтропии в таком процессе близко к нулю, а изменения энтальпии и энергии Гиббса определяются разностью протонного сродства А" и В": 
4. В качестве основания может выступать положительно заряженная частица. Этот редкий, но интересный случай наблюдается у молекул, являющихся двухкислотными или поликислотными основаниями. К их числу относятся бициклические и полициклические основания, такие как дипиридил, фенантролин, порфирины и др., например:
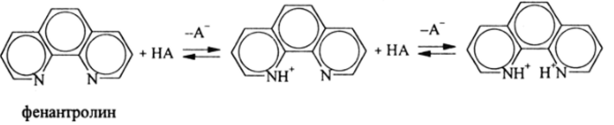
а также линейные диамины, полиамины, простые дии полиэфиры, например:

Присоединение второго протона для плоских ароматических систем обычно связано с большими трудностями и происходит при высокой кислотности. Тепловой эффект такого процесса отрицательный (изменение энтальпии положительно), а изменение энтропии может быть или положительным, или отрицательным в зависимости от жесткости атомно-молекулярного скелета. В сильнокислых средах в качестве кислоты выступает обычно не моле;
кула НА, а сольватированный протон Н30 H (S). Очень часто такие взаимодействия имеют место в концентрированных H2S04 или НС104. Если плоская молекула в ходе присоединения второго протона.
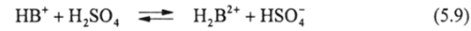
испытывает искажения с резким отклонением носителей протона (обычно.
/N—Н) от плоскости, то присоединение второго протона происходит с такой же затратой энергии, что и присоединение первого. Такие случаи наблюдаются при протонировании порфиринов:
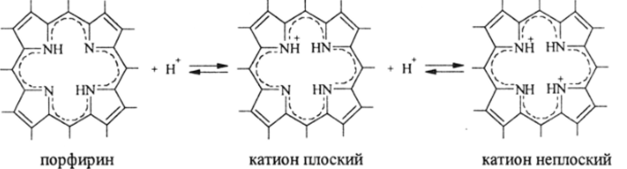
Когда такая деформация плоского ароматического основания невозможна из-за очень высокой энергии сопряжения в 16-членном макрокольце.
(основание фталоцианина), тогда протонирование на центральных атомах не происходит и основание протонируется однократно на периферии даже в самых сильных кислотах (моногидрат H2S04, олеум):
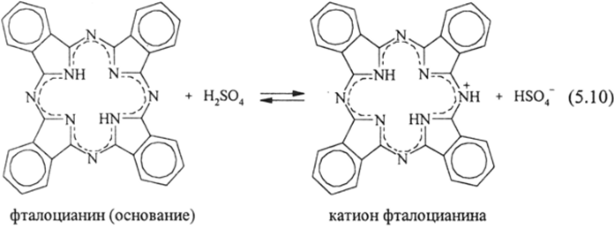
Термодинамика протонирования оснований в реакциях (5.9) и (5.10) подробно изучена и имеет большое значение для получения сверхчистых порфиринов и фталоцианинов как материалов особого назначения.
Для описания и измерения кислотности в кислых растворах, содержащих высокие концентрации сильных кислот, широко используется понятие функции кислотности, введенной в обиход крупным физикохимиком Л. Гамметом. Это понятие существенно отличается от водородного показателя pH, широко используемого в практике разбавленных растворов сильных кислот.
Водородный показатель выражается через концентрацию ионов водорода сн. и равен pH = -lgс. Если учесть, что концентрация в крепких водных растворах, а тем более неводных растворах сильных кислот отличается от действующей концентрации (активности), то следует вместо с. ввести активность а. Теория сильных электролитов, подробно изложенная в курсах физической, аналитической и неорганической химии, объясняет причины отличия концентрации с и активности а. Однако познавательные и расчетные возможности этой теории очень ограничены в результате бесконечного многообразия растворов электролитов и неэлектролитов и сложности межмолекулярных взаимодействий в растворах. Гем не менее в ряде случаев использование теории активности и учет изменения физико-химической природы частиц с помощью коэффициентов активности остается пока единственным способом создания расчетного аппарата равновесных процессов в химии растворов.
В условиях применения функции кислотности для ее измерения используется система кислотно-основных индикаторов, которые имеют различные электронные спектры кислой (ВН+) и основной (В) форм. Если таким индикатором будет л-нитроанилин.
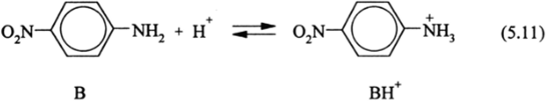
то будем иметь более длинноволновый (В) и более коротковолновый (ВН+) электронный спектр поглощения. Исходя из этого, можно по оптической плотности (закон Бугера—Бэра) определить концентрации В и ВН+, логарифм их отношения (/) и связь pH с константой диссоциации индикатора:

Тогда.
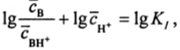
а после смены знаков.

Уравнение (5.13) строго пригодно для бесконечно разбавленных растворов. Для реальных растворов эксперимента с. умножается на коэффициент активности: с = а. Аналогичные преобразования делаются с с, и с .: н н н ° вн св/в = ав и свн./вн. = авн. Тогда из уравнения (5.12) получим:

В уравнении (5.14) константа кислотной диссоциации индикатора К° является термодинамической, не зависящей от концентрации частиц в данном растворе, в то время как константа К, в уравнении (5.12) является концентрационной, которая не зависит от концентрации В, Н+, ВН* и других только в определенном концентрационном интервале (обычно 0 — 1(Г3 моль/л).
Соотношение = а", ~^в было названо кислотностью и.
H'JH f н f
-'вн* ?'вн*.
обозначается h0, а — lg А0 = Н0 получило название функции кислотности Гамметга. Окончательно выражение закона действующих масс для индикатора (5.14) в логарифмической форме имеет простой вид: 
Оно позволяет по известным значениям / (определяется из опыта) и рК°, (берется из справочных таблиц) определить функцию кислотности растворителя или же по известным Н0 и / определить риндикатора.
Кроме шкалы Н0 (функции кислотности Гамметта), существует большое число шкал функций кислотности (//, с различными индексами), которые установлены для индикаторов иных классов, тогда как Н0 получена с серией нитрои галогенопроизводных анилина для растворов с большим интервалом кислотности. Различные серии Н, изменяются с неодинаковой скоростью при нарастании кислотности. Это обстоятельство связано с различием хромофорных систем выбранных индикаторов, с неодинаковым воздействием на них протона (одного из сильнейших ауксохромов), а также с различной сольватацией основной (В) и кислой (ВН*) форм различных индикаторов. Это привело Гамметта, основоположника теории функции кислотности, к заключению о том, что понятия абсолютной силы кислоты или основания не имеют смысла и что нельзя построить абсолютную шкалу кислотности растворителей.
Тем не менее изучение термодинамики диссоциации кислот и протонирования оснований составляет одно из главных направлений развития теории растворов и ее ядра — теории сольватации.